罗格列酮抑制TLR-4/NF-κB信号通路对肠缺血再灌注损伤的影响
2015-05-07刘启胜程正位
刘启胜,程正位
0 引言
肠缺血再灌注损伤是临床上常见的危重事件,常伴发于腹部外伤、失血性休克、肠移植、严重创伤、感染、烧伤等病理和手术状态下[1-2]。其发病机制包括炎症、凋亡、坏死等,但其具体机制目前依然不清楚[3-4]。PPAR-γ激动剂罗格列酮因其卓越的降糖作用而被广泛用于临床,最近研究发现,其不但有降糖作用,还具有明显的抗炎作用[4-5],而炎症是肠缺血再灌注损伤的重要发病机制[6-8]。本实验利用大鼠肠系膜上动脉(SMA)夹闭模型,研究静脉注射罗格列酮对肠道缺血再灌注损伤后的作用,并探讨其可能的作用机制。
1 材料与方法
1.1 主要试剂、仪器和动物 罗格列酮(Sigma,USA),水合氯醛(Google生物)。TLR-4(CST,USA),p-p65(CST,USA),p65(CST,USA),PPAR-γ(CST,USA),p-PPAR-γ(CST,USAP),βactin(abgent,USA),TRIzol reagent(Invitrogen,USA),逆转录试剂盒(GeneCopoeia,USA),SYBR green(Takara,Japan),qPCR 引物(擎科生物技术有限公司,序列见表1),ELISA试剂盒购自于eB-science,HE试剂由温州医科大学第一附属医院病理实验室配制。紫外分光光度计(Thermo fisher),逆转录仪(eppendorf),qPCR仪(BIO-RAD IQ5),显微镜(Olympus BX51)及成像系统(HITMAS-30)均由四川省人民医院病理科提供。SD大鼠,SPF级,北京华富康动物实验中心。
1.2 动物模型的建立与分组 30只健康雄性SD大鼠,2月龄,平均体重220~250 g,合格证编号:103079。适应性喂养1周后,状态良好,按体重随机分为假手术组(Sham组)、肠缺血再灌注损伤组(IRI组)和罗格列酮预处理组(RGZ组),每组10只。RGZ组术前1 h给予罗格列酮静脉注射(0.3 mg/kg),剂量参考文献[9]。Sham 组和 IRI组给予等体积静脉注射生理盐水;Sham组行假手术,IRI组和RGZ组行小肠缺血再灌注损伤手术。具体手术方式如下:大鼠在腹腔注射10%水合氯醛(4 mL/kg)麻醉状态下,行腹部正中切口,钝性分离肠系膜上动脉根部(SMA),用微血管夹夹闭SMA根部,完全阻断血流45 min后松开血管夹,恢复肠道血流形成再灌注。缝合腹部,再灌注4 h后处死大鼠,收集标本。Sham组操作同上,但开腹后不夹闭肠系膜上动脉。
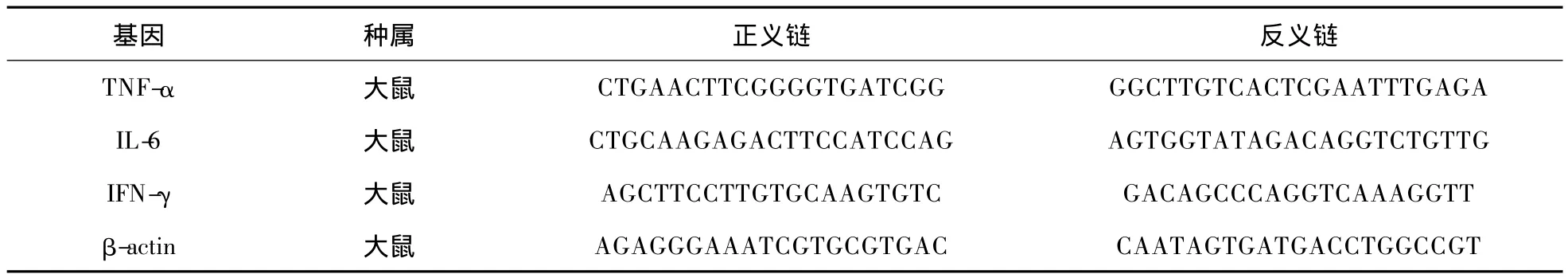
表1 实时定量PCR检测的引物序列
1.3 肠道组织学检查 小肠组织切片经10%中性甲醛固定、石蜡包埋、PAS染色之后,在光镜下观察小肠组织病理学变化。小肠损伤程度用Cuzzocrea等[9]报道的积分法评估。0分为正常绒毛和腺体;1分为部分绒毛顶部上皮轻度受损;2分为上皮下腺体轻度受损;3分为上皮下间隙扩大,毛细血管充血;4分为上皮与固有层中度分离,腺体受损;5分为部分绒毛顶部脱落;6分为绒毛脱落明显,毛细血管扩张;7分为固有层绒毛脱落,腺体受损明显;8分为固有层开始消化分解;9分为出血、溃疡。
1.4 Western印迹检测 取小肠组织于精微天平称重,按照每50 mg组织中加入1 mL RIPA裂解液,冰上匀浆,裂解30 min后,4℃ 12 000 r/min离心30 min后取上清,BCA法测定蛋白浓度。以含50 μg蛋白质的上样量,经十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,后转膜,然后洗膜,以5%脱脂奶粉(TBST配制)封闭1 h,PPAR-γ(1∶1 000)、p-PPAR-γ(1∶500)、p65(1∶1 000)、pp65(1∶1 000)、TLR-4(1∶500)、β-actin(1∶3 000)单抗孵育过夜,再次振洗后加入羊抗兔IgG-HRP(二抗)37℃孵育1 h。洗膜后加ECL试剂,Kodak化学发光仪曝光显示目的蛋白,并拍照。以Quantity one对条带进行定量分析,以目的条带和β-actin条带积分灰度值比值作为结果。
1.5 实时定量 PCR(RT-PCR)检测 IL-6、TNF-α和IFN-γ 称取适量小肠组织,于液氮中研磨成粉末状提取总RNA,紫外分光光度计测量浓度,逆转录以及扩增反应按试剂盒说明书进行。以管家基因β-actin作为内参对照基因,用得到的各样本的Ct值按公式2-ΔΔCT计算相对表达量。
1.6 ELISA检测血清IL-6、TNF-α和IFN-γ表达水平 按照ELISA试剂盒说明书操作步骤检测血清中 IL-6、TNF-α 和 IFN-γ表达水平。
1.7 统计学方法 采用SPSS 12.0统计软件包进行资料分析,实验结果采用±s表示,资料采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 促红细胞生成素预处理对缺血再灌注损伤小肠组织结构的影响 光镜下观察肠道组织病理学变化,可见Sham组肠道黏膜细胞排列基本整齐,结构完整,无组织坏死、缺失及水肿。肠缺血再灌注组可见小肠黏膜上皮下间隙扩大,腺体受损及毛细血管充血、水肿,肠道组织有大量绒毛脱落、糜烂、炎性细胞浸润、肠道组织结构破坏。罗格列酮预处理治疗可以减轻缺血再灌注损伤导致的病理损伤。各组小肠缺血再灌注损伤程度见图1。
2.2 RGZ预处理对 PPAR-γ激活的影响 与Sham组比较,IRI组 p-PPAR-γ表达明显增高(P<0.01),但 PPAR-γ表达无明显差异(P>0.05)。与IRI组比较,经RGZ预处理的RGZ组p-PPAR-γ表达进一步升高(P<0.05)。见图2。
2.3 RGZ预处理对TLR-4激活的作用 与Sham组比较,IRI组TLR-4表达明显增高(P<0.001),与IRI组比较,RGZ组TLR-4表达明显减低(P<0.05)。见图3。

图1 RGZ预处理对肠缺血再灌注损伤导致的肠组织病理改变的影响(10只/组)(400×)注:与 IRI组比较,*P <0.05,***P <0.001

图2 RGZ预处理对PPAR-γ蛋白表达的影响(10只/组)注:与 IRI组比较,*P <0.05,**P <0.01
2.4 RGZ预处理对NF-κB的影响 与Sham组比较,IRI组p-p65表达明显增高(P<0.001),但p65表达无明显差异(P>0.05)。与IRI组比较,经RGZ预处理的RGZ组,p-p65表达明显减低(P<0.05)。但p65表达依然无明显差异(P>0.05)。见图4。
2.5 RGZ预处理对促炎症因子TNF-α、IFN-γ和IL-6表达的影响 炎症因子是调节炎症反应的重要影响因素。实时定量PCR检测显示,IRI组与Sham 组比较,TNF-α、IFN-γ和IL-6mRNA表达水平明显增高(P<0.001),RGZ组与Sham组比较,TNF-α、IFN-γ 和 IL-6 mRNA 表达水平明显降低(10只/组)(P<0.05)。见图5。

图3 RGZ预处理对TLR-4蛋白表达的影响(10只/组)注:与 IRI组比较,*P <0.05,***P <0.001
2.6 RGZ预处理对TNF-α、IFN-γ和IL-6分泌的影响 ELISA检测显示,与 IRI组比较,IRI组TNF-α、IFN-γ 和 IL-6 分泌明显增高(P <0.001),与 Sham 组比较,RGZ 组 TNF-α、IFN-γ 和 IL-6 mRNA分泌明显降低(P<0.05),见图6。

图4 RGZ预处理对p65蛋白表达的影响(10只/组)注:与 IRI组比较,*P <0.05,***P <0.001

图5 RGZ预处理对TNF-α(A)、IL-6(B)和IFN-γ(C)mRNA表达的影响(10只/组)注:与 IRI组比较,*P <0.05,***P <0.001
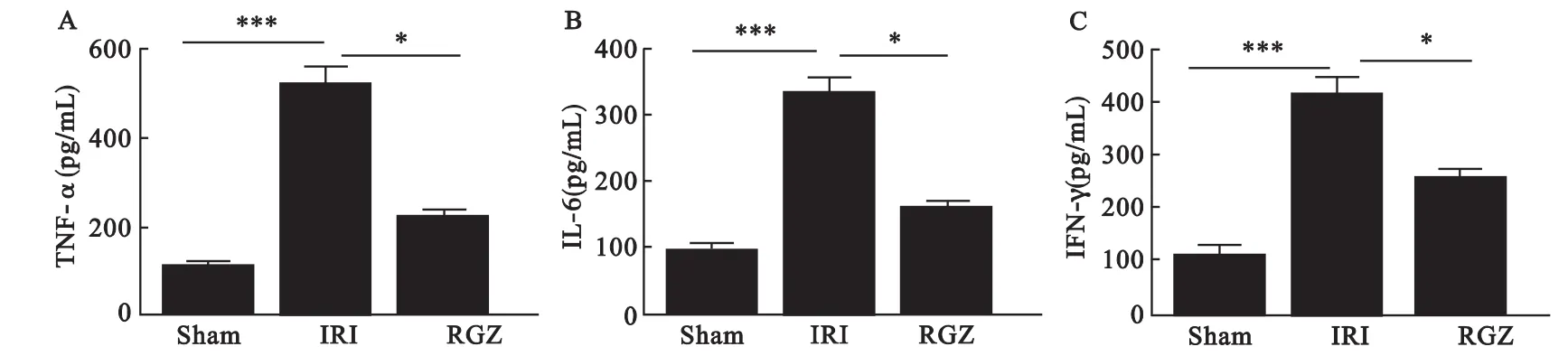
图6 RGZ 预处理对 TNF-α(A)、IL-6(B)和 IFN-γ(C)的影响(10 只/组)注:与 IRI组比较,*P <0.05,***P <0.001
3 讨论
肠缺血再灌注损伤是肠道缺血后恢复血液循环难以避免的一种损伤,好发于肠移植、休克、肠梗阻等疾病,常导致非常严重的后果[1-3]。其发病机制包括炎症、凋亡、坏死等,但具体机制目前依然不明[6-8]。
近年来的研究表明,炎症在肠I/R的发病过程中起重要的作用[6]。肠I/R可显著提高内毒素攻击的敏感性、可使机体单核/巨噬细胞、中性粒细胞处于致敏状态。激发机体产生和释放各种细胞因子及炎性介质,使细胞因子网络平衡,从而引发SIRS、甚至MODS[6]。因此,削弱炎症是减轻肠缺血再灌注损伤的有效途径之一。
TLR-4/NF-κB介导的炎症信号通路在肠缺血再灌注损伤发挥重要作用[10]。NF-κB激活取决于其亚单位p65的激活[11]。罗格列酮为过氧化物酶增殖酶受体(PPAR-γ)激动剂之一,因其具有广泛的降糖作用而广泛用于临床[4-5]。最近研究发现,PPAR-γ 激活可以调节 TLR-4/NF-κB 信号通路[12]。
实验结果显示,肠缺血再灌注损伤可引起肠道充血、水肿、出血、坏死,肠腔内可见糜烂、出血及溃疡,肠腺上皮细胞水肿、坏死脱落。罗格列酮预处理能明显减轻上述症状,减轻IRI导致的肠道病理变化,对肠道机械屏障也具有明显的保护作用。研究发现,肠 I/R 后,TNF-α、IL-6、IFN-γ 等促炎症细胞因子均明显升高;罗格列酮预处理可明显抑制 I/R 导致的 TNF-α、IL-6、IFN-γ促炎症因子表达水平升高,提示罗格列酮可抑制促进抗炎因子的释放,控制持续扩大的炎症反应,防止肠黏膜局部及全身组织器官损伤,从而达到防治肠缺血再灌注损伤的目的。对罗格列酮在肠I/R抑制促炎症细胞因子表达的机制研究显示,罗格列酮预处理通过进一步激活PPAR-γ,可以抑制肠I/R导致的TLR-4/NF-κB信号通路的激活。
[1] Shen H,Kreisel D,Goldstein DR.Processes of sterile inflammation[J].J Immunol,2013,191(6):2857-2863.
[2] Kalyanaraman B.Teaching the basics of redox biology to medical and graduate students:Oxidants,antioxidants and disease mechanisms[J].Redox Biology,2013,1(1):244-257.
[3] Lenaerts K,Ceulemans LJ,Hundscheid IH,et al.New insights in intestinal ischemia-reperfusion injury:implications for intestinal transplantation[J].Curr Opin Organ Transplant,2013,18(3):298-303.
[4] Mingfeng D,Xiaodong M,Yue L.Effects of PPAR-γ agonist treatment on LPS-induced mastitis in rats[J].Inflammation,2014,37(6):1919-1924.
[5] Deplanque D.Cell protection through PPAR nuclear receptor activation[J].Therapie,2004,59:25-29.
[6] Lamprecht G,Heininger A.Current aspects of sepsis caused by bacterial translocation[J].Zentralbl Chir,2012,137(3):274-278.
[7] Zickri MB,Embaby A,Metwally HG.Experimental study on the effect of intravenous stem cell therapy on intestinal ischemia reperfusion induced myocardial injury[J].Int J Stem Cells,2013,6(2):121-128.
[8] Haj B,Sukhotnik I,Shaoul R.Effect of ozone on intestinal recovery following intestinal ischemia-reperfusion injury in a rat[J].Pediatr Surg Int,2013,5(3):111-113.
[9] Cuzzocrea S,Pisano B,Dugo L,et al.Rosiglitazone and 15-deoxy-Delta12,14-prostaglandin J2,ligands of the peroxisome proliferator-activated receptor-gamma(PPAR-gamma),reduce ischaemia/reperfusion injury of the gut[J].Br J Pharmacol,2003,140(2):366-376.
[10] Henry SD,Guarrera JV.Protective effects of hypothermic ex vivo perfusion on ischemia/reperfusion injury and transplant outcomes[J].Transplant Rev(Orlando),2012,26(2):163-175.
[11] He GZ,Zhou KG,Zhang R,et al.The effects of n-3 PUFA and intestinal lymph drainage on high-mobility group box 1 and Toll-like receptor 4 mRNA in rats with intestinal ischaemia-reperfusion injury[J].Br J Nutr,2012,108(5):883-892.
[12] Dubuquoy L,Jansson EA,Deeb S,et al.Impaired expression of peroxisome proliferator-activated receptor gamma in ulcerative colitis[J].Gastroenterology,2003,124(5):1265-1276.
