乙酸染色结合FICE内镜技术在胃黏膜肠上皮化生中的诊断价值
2015-05-07余卫中贾业贵
肖 丹 余卫中 贾业贵
目前普遍认为胃癌可能是由慢性浅表性胃炎-萎缩性胃炎-肠上皮化生-异型增生发展而来[1]。胃黏膜肠上皮化生(intestinal metaplasia,IM)是指胃黏膜上皮及腺上皮病变区被类似肠黏膜上皮及腺上皮所替代。IM是一种癌前状态,是慢性胃炎发展到胃癌过程中的重要环节,与胃癌的发生有密切关系[2]。因此,早期发现并诊断肠上皮化生,并对其治疗和随访,有助于病变的逆转,对早期胃癌的防治有积极的作用。
对于诊断IM的金标准仍是内镜下病理组织学诊断。在普通内镜下,IM可有多种表现,如黏膜粗糙、小结节、隆起糜烂灶、溃疡等,且多灶性分布,易漏诊。目前临床上采用多种内镜技术如染色内镜、放大内镜、电子分光技术(NBI和FICE)增强对肠上皮化生的诊断。目前对NBI放大内镜研究较多,对FICE放大内镜研究较少,本文通过应用乙酸染色结合富士能分光染色 (Fuji intelligent chromo endoscopy,FICE)放大内镜技术,更细致的观察病变的腺管开口及细微结构,发现普通内镜下易漏诊的病变,通过靶向活检提高病检的阳性率,并对普通内镜与FICE内镜诊断的一致性对比研究,了解乙酸染色结合FICE放大内镜对IM诊断的可行性和优越性。
研究对象与方法
一、研究对象
从2012年12月至2014年12月,我院普通内镜发现的可疑肠上皮化生病变如单个或多个结节、黏膜粗糙、糜烂、溃疡等患者为研究对象,排除内镜检查禁忌症者,分为3组,每组128例,分别采用普通内镜观察、FICE内镜观察、乙酸染色结合FICE内镜进行观察。所有入选患者均签署知情同意书。
二、研究设备
富士能Fujinon4400主机,带FICE功能及光源,高分辨率放大内镜 (富士能FujinonEG-590ZW)。3%的醋酸(白醋浓度大于5%,以3:2蒸馏水稀释)。
三、方法
1.操作方法
检查前10 min患者口服利多卡因及西甲基硅油(德国柏林化学股份公司)混合液10 mL,充分祛除泡沫后对病变区域进行观察,对普通白光下发现存在上述可疑肠上皮化生表现部位进行观察,转换至FICE放大模式观察,放大至60~200倍观察病灶形态及胃小凹形态,随后白光模式下将配制好的乙酸溶液约15 mL经活检孔均匀喷洒于病灶表面,观察病灶形态变化,然后在FICE模式及放大模式下进行观察,分别于观察后采集图片;在乙酸染色联合FICE模式下显示的黏膜白斑处或浅蓝色脊样结构(1ight blue crest,LBC)处活检,标本进行HE染色,由病理科专家进行诊断。
2.图像观察及分析
选择最佳清晰度图像,评价普通白光、FICE内镜及乙酸染色+FICE放大内镜时病变轮廓、腺管开口形态,观察有无黏膜白斑LBC,将各型内镜判定结果与最终的病理诊断进行比较,评价其诊断肠上皮化生的敏感性、特异性、阳性和阴性预测值。
四、统计学分析
数据采用SPSSl5.0统计软件进行分析,以病理结果为金标准,与不同方法诊断肠上皮化生做比较,算出其敏感性、特异性、阳性和阴性预测值。组间比较用χ2检验,P<0.05为有统计学意义。
结 果
一、内镜下胃黏膜肠上皮化生的形态特征
肠上皮化生在普通白光下表现为单个或弥散性小结节、黏膜粗糙、隆起糜烂灶,部分可无特殊表现。在普通FICE模式下,IM表现为黏膜白色隆起和LBC,放大模式下腺管开口形态多表现为绒毛状及斑块状;乙酸染色后,普通内镜下可见黏膜白化现象,病变黏膜可见点片状粗大颗粒或鱼鳞样隆起改变,而在醋酸染色+FICE模式下主要表现为黏膜白色隆起。喷洒乙酸后,LBC在FICE模式下表现为白色隆起,但喷洒后普通模式下看似正常的黏膜组织也可发现黏膜白色隆起,隆起更加明显,且病变区域与正常黏膜对比度更强,腺管开口形态显示更清析,更易发现病灶,从而避免漏诊,如图1。
二、三种内镜检查方法与病理结果的比较
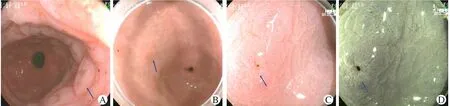
图1 IM内镜所见(A:IM在乙酸染色后白化现象;B:白光下易漏诊IM病灶;C:病灶乙酸染色放大后表现;D:病灶乙酸染色+FICE放大后表现)
从表1及表2可以看出,普通内镜诊断IM的敏感度70.1%,特异度45.2%,总符合率64.1%;FICE内镜诊断IM的敏感度82.5%,特异度70.9%,总符合率79.7%,阳性预测值89.9%,阴性预测值56.4%;乙酸染色+FICE内镜诊断IM的敏感度92.2%,特异度83.8%,总符合率90.6%,阳性预测值94.7%,阴性预测值78.8%。分别将FICE内镜、乙酸染色+FICE内镜组与普通内镜组进行组间比较发现,FICE内镜、乙酸染色+FICE内镜诊断IM的敏感度、特异度优于普通内镜,差异有统计学意义(P<0.05)。FICE内镜与乙酸染色+FICE内镜组间比较提示两者敏感度、总符合率、阴性预测值差异有统计学意义(P<0.05),但其特异度、阳性预测值差异无统计学意义(P>0.05)。
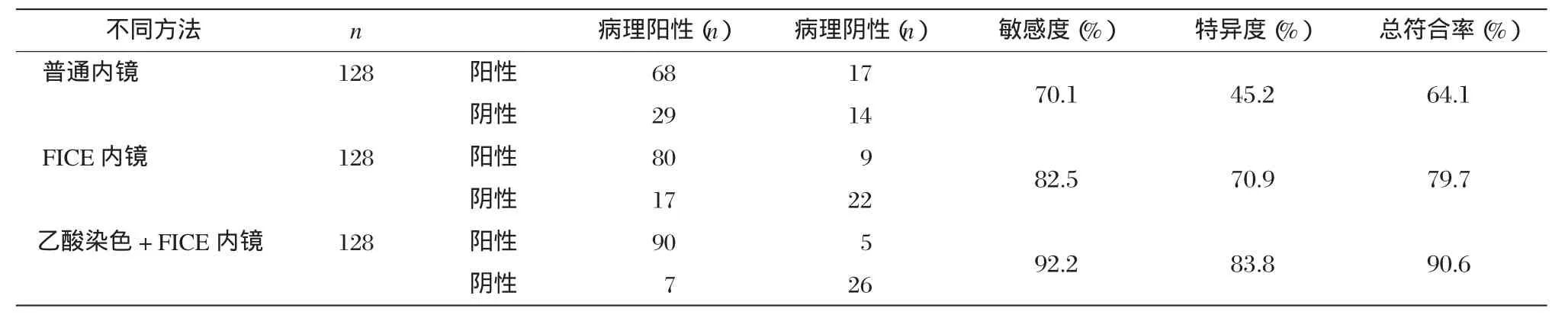
表1 三种内镜检查方法诊断IM与病理结果的比较
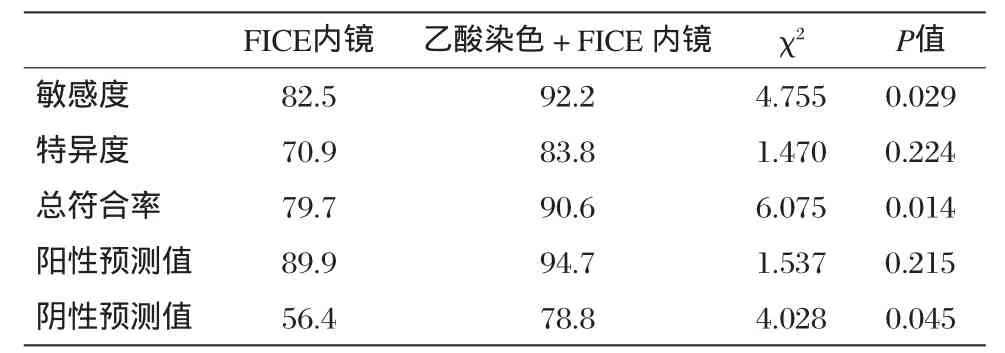
表2 FICE内镜和乙酸染色结合FICE内镜诊断IM的差异(%)
讨 论
胃黏膜肠上皮化生是胃黏膜病变病检中常见的病理现象。研究表明[1,3]IM与胃黏膜的异型增生及胃癌的发生有一定的相关性,故早期诊断IM对早期胃癌的防治具有积极作用。目前内镜技术取得了较大的发展,随着染色放大内镜及电子分光技术的应用,肠上皮化生的检出率已有较大的提高。FICE技术是通过电子分光技术将彩色电荷耦合器件采集到的不同色彩进行分解、纯化,从白光显像光谱中抽取出相应信息后,再进行图像的再合成重建得到FICE图像,以达到电子染色的最佳观察效果[4]。肠上皮化生的诊断仍主要依赖于胃镜下黏膜病理学检查。文献报道[5],典型的肠上皮化生形态在内镜下表现主要分为淡黄色结节型和弥漫型,弥漫型可表现为颗粒状弥漫不平或散在米粒状。但缺乏这些特异性表现时,可仅表现为黏膜粗糙、隆起糜烂灶,且多灶性分布,常规胃镜对IM的诊断仍有一定困难。Kaminishi等认为普通内镜下灰色结节对IM的诊断特异性为98%~99%,但敏感性仅为6%~12%,提出普通内镜并不适合于诊断所有伴IM的胃黏膜病变[6]。
Guelrud等[7]研究发现乙酸可使胃黏膜上皮细胞内细胞质蛋白质发生可逆性变性,内镜下应用乙酸进行染色,可在黏膜表面形成一过性发白现象,这称为白化现象,此变化在乙酸作用消除后3~8 min即可恢复,白化现象使病变部位和正常部位的对比度得到了增强,使病变的观察更为突出、直观,另外,乙酸还可以减少黏膜表面的黏液,从而使黏膜微细结构更清楚。临床广泛应用于寻找、确定IM的位置,进行靶向活检。但研究[8]显示,单纯乙酸染色用于IM的诊断并不多见。
有研究显示[9-10],NBI放大内镜可发现上皮表面呈LBC,LBC对肠上皮化生的阳性率为 80%~100%。哥斯达黎加CIMA医院应用FICE技术研究发现不完全肠化显示出明亮的高对比区域;对完全肠化生则显示表面不规则,有散在结节,其边缘呈亮蓝色,完全肠化生的程度与FICE显示的蓝色边缘的颜色深度成正比[11]。Sakaki等[12]研究表明放大内镜下绒毛状胃小凹则是肠上皮化生的特征性改变。通过FICE内镜观察病变的胃小凹分型,发现绒毛状胃小凹形态多提示肠上皮化生,乙酸可减少黏膜表面的黏液,使病变部位特别是多发病变更明显,两者结合观察时,能更清晰的显示黏膜微细结构,且醋酸价格低廉,安全无毒,避免了染色剂如美兰等对人体的危害,本研究中FICE内镜、乙酸染色+FICE内镜诊断IM的敏感度、特异度优于普通内镜,FICE内镜与乙酸染色+FICE内镜组间比较提示两者敏感度、总符合率、阴性预测值差异有统计学意义,但特异度、阳性预测值差异无统计学意义。敏感度又称为真阳性率,反应了诊断方法检出患者的能力。有报道指出[13],单纯乙酸染色对于早期胃黏膜病变诊断的敏感性并不高,仅为83.7%,可以联合其他辅助染色如电子染色等方法,以提高其诊断率。阴性预测值表示待评价的诊断方法诊断为阴性的病例中实际是非患者的概率。在本研究中,部分病灶在FICE模式下未出现明显黏膜白斑和LBC,但在喷洒醋酸后能观察到黏膜白斑表现。
因此,醋酸联合FICE内镜较普通FICE内镜更能发现肠上皮化生病灶,在敏感度、特异度、阴性预测值上高于FICE内镜,能减少漏诊,提高活检的准确率,具有更高临床诊断价值。但是,对于增强放大染色诊断的准确性方面还有一些细致工作要做,如不同醋酸浓度对于白化现象及电子染色效果的影响,如何避免白化现象在在短时间内消除对图像观察的影响,以及胃小凹其他类型亦可能是IM现象的表现等问题,还需要我们重视及通过大样本多中心的对照研究进一步明确。
1 Correa P.Human gastric carcinogenesis:a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention.Cancer Res,1992,52(24):6735-6740.
2 罗丹,邓尚华,覃立锋,等.色素内镜在上消化道病变诊断中的临床应用价值.湖北民族学院学报(医学版),2011,28(1):22-25.
3 Genta RM,Rugge M.Gastric precancerous lesions:heading for an international consensus.Gut,1999,45(suppl 1)15-18.
4 沈奕,钟捷,范荣,等.FICE技术应用于胃肠道病变的诊断.国际消化病杂志,2009,29(5):305-307.
5 周丽雅,李建辉,林三仁,等.胃黏膜肠上皮化生的内镜分析.中华消化内镜杂志,2001,18(2):84-86.
6 Kaminishi M,Yamaguchi H,Nomura S,et al.Endoscopic classification of chronic gastritis based on a pilot study by the research society for gastritis.Dig Endosc,2002,14:138-151.
7 Guelrud M,Herrera I,Essenfeld H,et a1.Enhanced magnification endoscopy:a new technique to identify specialized intestinal metaplasia in Barrett′s esophagus.Gastrointest Endosc,2001,53(6):559-565.
8 Lambert R,Rey JF,Sankaranarayanan R.Magnification and chromoscopy with the acetic acid test.Endoscopy,2003,35(5):437445.
9 Kreǐmer VD,Tiurin VP,Kogan EA,et a1.Eficiency of new NBI technology for endoscopic examination of patients with chronic gastritis.Klin Med(Mosk),2008,86(12):43-47.
10 Bansal A,Ulusarac O,Mathur S,et a1.Correlation between narrow band imaging and nonneoplastic gastric pathology:a pilot feasibility trial.Gastmintest Endosc,2008,67(2):210-216.
11黄旭明,刘锦涛.智能染色内镜和放大内镜的应用及对胃部疾病的诊断价值.国际消化病杂志,2010,30(2):86-88.
12 Sakaki N,Iida Y,Okazaki Y,et al.Magnifying endoscopic observation of the gastric mucosa,particularly in patients with atrophic gastritis.Endoscopy,1978,10(4):269-274.
13 Wasielica-Berger J,Baniukiewicz A,Wroblewski E,et a1.Magniifcation endoscopy and chr0moend0sc0py in valuation of specialized intestinla metaplasia in Barrett′s esophagus.Dig Dis Sci,2011,56(7):1987-1995.
