Paenibacillus polymyxa ZJ-9混合发酵菊粉和葡萄糖合成 R,R-2,3-丁二醇*
2015-05-05徐尤勇高健徐虹曹灿黄巍巍
徐尤勇,高健,徐虹,曹灿,黄巍巍
1(南京工业大学食品与轻工学院、材料化学工程国家重点实验室,江苏南京,211816)2(盐城工学院化学与生物工程学院,江苏盐城,224051)
2,3-丁二醇是一种重要的化工原料和液体燃料,广泛应用于化工、食品、燃料及航空航天等领域,具有生物降解性[1-2]。2,3-丁二醇含有2个手性碳原子,因此具有3种旋光异构体(分别为R,R-2,3-丁二醇、S,S-2,3-丁二醇和 meso-2,3-丁二醇)。R,R-2,3-丁二醇除了具有上述用途以外,还是优良的抗冻剂,也是合成手性试剂、手性配体的重要中间体,在手性药物和天然产物的合成中也有潜在的重要应用[3-4]。研究发现,能够代谢合成R,R-2,3-丁二醇的微生物寥寥无几,而多粘类芽孢杆菌(Paenibacillus polymyxa,前称Bacillus polymyxa)是其中唯一具备工业化生产R,R-2,3-丁二醇潜力的微生物[4-5]。P.polymyxa 中的极少数菌株能够产菊粉酶,可以直接利用能源植物菊芋菊粉(菊糖)一步法发酵制备高附加值的R,R-2,3-丁二醇。菊芋中主要成分为菊粉,占湿重的15% ~20%、干重的80%左右。菊粉是一种生物多糖,它由果糖分子通过β(1→2)键连接,聚合程度为2~60,一般平均为10,其终端为葡萄糖单位,故又称为果聚糖。菊粉经菊粉酶或酸降解可转化为果寡糖和果糖[6]。
受胞外蛋白水解酶及多种复杂化学物质作用,P.polymyxa分泌的菊粉酶极易失活,导致其在发酵过程中水解菊粉的酶活并不高,并伴随发酵的进行酶活逐渐下降。分批发酵高浓度的菊芋菊粉制备R,R-2,3-丁二醇时,通过工艺条件优化,依然底物利用率低、残糖多,产物产量提高收效甚微,严重制约了R,R-2,3-丁二醇的工业化发酵制备[7]。改用连续发酵工艺,由于底物浓度等发酵条件受到严格限制,菊粉酶活力和菊芋菊粉的利用均获得了提高,然而底物浓度受限的发酵条件也决定了产物产量甚至比分批发酵低。补料分批发酵是介于分批培养过程与连续培养过程之间的一种过渡培养方式,是指在分批培养过程中,间歇或连续地补加新鲜培养基的培养方法,又称半连续培养或半连续发酵。补料分批发酵工艺已经被广泛应用于抗生素、鼠李糖脂、威兰胶、氨基酸和维生素等产品的发酵生产[8-10],而 P.polymyxa利用菊芋菊粉和葡萄糖补料分批发酵制备R,R-2,3-丁二醇尚未见相关报道。
一些研究表明,分别利用葡萄糖、纯菊粉、果糖和蔗糖等糖类作为碳源时,P.polymyxa发酵制备R,R-2,3-丁二醇效果差,产量均极低,而利用菊芋菊粉粗提液直接作为发酵底物时,产物产量得到大幅度提高。原因分析显示,菊芋菊粉粗提液中还含有一些微量元素、特殊氨基酸和稀有维生素等成分,这些物质有利于发酵目标产物的合成[11]。因此,理性设计P.polymyxa补料分批发酵制备 R,R-2,3-丁二醇策略,在发酵前期,直接以菊芋菊粉粗提液中的菊粉为初始碳源,在发酵后期添加合适的糖类,特别是葡萄糖,不仅有利于底物碳源的利用,提高底物的转化率,而且可促进产物R,R-2,3-丁二醇的合成,从而为工业化应用奠定良好的基础。
在前期研究基础上[11],根据 P.polymyx ZJ-9利用菊芋菊粉粗提液一步法发酵制备R,R-2,3-丁二醇的特点,在分批发酵过程中进行补料,分别以葡萄糖、纯菊粉、果糖、蔗糖为补料底物,进行发酵效果分析,进而对菊粉和葡萄糖混合发酵工艺条件进行系统深入研究,采用补料分批发酵工艺以期达到提高底物利用率和目标产物R,R-2,3-丁二醇产量的目的。
1 材料与方法
1.1 实验菌株以及培养条件
菌株:多粘类芽抱杆菌 (Paenibacillus polymyxa)ZJ-9,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为:CGMCC No.3044[12]。
活化培养基(g/L):蛋白胨10,牛肉膏3,NaCl 5,琼脂10~20,pH 7.0。取冰箱保藏菌株划线到活化培养基上,置于培养箱内30℃恒温培养1d。
种子培养基(g/L):菊粉20,蛋白胨10,酵母膏3,NaCl 5,配好的种子液115℃灭菌30 min,置于30℃,200 r/min的摇床中培养22 h至对数生长中后期。
发酵培养基(g/L):菊粉 75,酵母膏 6,蛋白胨2,MgSO4·7H2O 0.5,K2HPO43.09,MnSO4·H2O 0.001,NH4Cl 0.93,FeSO4·7H2O 0.04,ZnSO4·7H2O 0.001,pH 6.0[11]。
1.2 培养方法
补料分批发酵:补糖浓度500 g/L,分别以3种不同方式补料添加:(1)一次全加,在发酵24 h时添加30 g/L的葡萄糖;(2)恒速流加,在发酵24~40 h时以恒定速度流加30 g/L的葡萄糖;(3)分批补加,分别在24 h,31 h时添加15 g/L的葡萄糖。
摇瓶发酵培养:将上述培养好的种子液按8%的接种量接入装有100 mL发酵培养基的500 mL三角瓶中培养,30℃ ,120 r/min摇瓶培养44 h。
7.5 L发酵罐培养(BioFlo110,美国 NBS公司):温度30℃,通气量1 vvm,装液量4 L,接种量8%,前22 h转速为300 r/min,后22 h调为200 r/min,pH调控策略为:发酵初期不控发酵液pH,待发酵过程中随着pH值降到6.0以下时,用4 mol/L NaOH调pH为6.0。
1.3 菊芋菊粉粗提液制备
新鲜的菊芋洗净,对半切,沸水浴中煮5 min(灭PPO酶);切丝,75℃于电热恒温鼓风干燥箱干燥8 h;干丝用粉碎机粉碎,过40目筛,将得到的粗菊粉于冰箱中保存备用。按照1∶6的比例称取粗菊粉于水中搅拌后,70℃水浴加热浸提2 h,冷却后用 Ca(OH)2调pH置10.0,80℃水浴加热浸提1 h,用6层纱布,过滤后即可得到菊粉粗提液[13]。
1.4 发酵液细胞干重的测定
取不同时间段的发酵液稀释25倍于分光光度计660 nm下检测OD660。取5 mL发酵液于预先称重的离心管中,8 000 r/min室温离心10 min,弃去上清液再加人5 mL生理盐水反复洗涤2次,弃上清液,将沉淀置于80℃的烘箱内烘干至恒重,烘干后的总重量减去离心管重即为细胞干重(Dry Cell Weight,DCW)。以OD660为横坐标,DCW为纵坐标,作OD660-DCW的标准曲线。
1.5 发酵液总糖的测定
配制100 mg/L的果糖标准液,分别取0.1,0.2,0.3,0.4,0.6,0.8,1 mL 的果糖标准液用蒸馏水稀释到1 mL与4 mL的蒽酮沸水浴反应10 min,流动水冷却测出OD620,以空白作对照制作标曲。
吸取1 mL待测样品(将发酵液稀释1 000倍),加入4 mL蒽酮试剂,做3个平行;另外吸取1 mL蒸馏水,加入4 mL蒽酮试剂,以此作为对照。将对照和待测样品沸水浴保温10 min,取出流动水冷却至室温,620 nm测吸光值。再在标曲中查找相应的总糖含量(g/L)。
1.6 发酵液R,R-2,3-丁二醇,乙偶姻产量测定
发酵液R,R-2,3-丁二醇,乙偶姻产量测定采用气相色谱法检测,利用面积外标法定量。取1 mL发酵液10 000 r/min离心10 min,取上清液按1∶1体积比加入乙酸乙酯萃取,静置分层后取上层清液进行气相分析。
检测条件:毛细管色谱柱DB-WAX,30 m×250 μm ×0.5 μm;进样口温度210 ℃,进样量 0.4 μL;分流比20∶1;载气为高纯N2,流速1.2 mL/min;柱温保持150℃;FID检测器,检测器温度210℃。
1.7 数据处理

2 结果与分析
2.1 菊粉粗提液菊粉浓度对R,R-2,3-丁二醇发酵的影响
以菊芋菊粉粗提液直接作为发酵底物,控制粗提液中菊粉含量分别为 65.0、75.0、85.0、95.0 g/L,其他条件相同,进行发酵培养。检测分批发酵过程中菊粉消耗、菌体生长和R,R-2,3-丁二醇产量等各参数,并进行比较,结果如表1所示,伴随初糖浓度的增加,菊粉利用率以及R,R-2,3-丁二醇的生产强度出现下降趋势,高初糖浓度下(95.0 g/L)最为明显,说明发酵液中菌体分泌的菊粉酶酶活有限,培养基初糖浓度过高,细胞合成产物的能力相对减弱;另一方面,菊粉浓度的增加虽然对提高R,R-2,3-丁二醇的产量、最大生物量(DCW)有积极作用,但是,发酵液中菊粉残留量也相应增加,原料利用率呈下降趋势。由此可见,对于R,R-2,3-丁二醇的发酵生产,分批培养难以实现高产率、高转化率和高生产强度的统一,因此有必要采用补料分批培养来实现R,R-2,3-丁二醇的高产。

表1 菊粉粗提液不同菊粉浓度下R,R-2,3-BD发酵过程参数Table 1 The process for one-step fermentation of raw inulin extract from Jerusalem artichoke tubers with different inulin concentration using P.polymyxa ZJ-9 to produce R,R-2,3-BD
实验中进一步考察了65.0、75.0、85.0和95.0 g/L的菊粉质量浓度对分批发酵过程中细胞比生长速率和产物比合成速率的影响,如图1所示。在所考察的菊粉浓度范围内,菌体均能较好的生长,但菊粉浓度过高时,发酵前期细胞的比生长速率和产物的比合成速率都明显受到抑制,发酵周期相对延长;发酵后期,适当提高糖浓度,有利于产物产量的提高。在发酵前期,菊粉质量浓度为75.0 g/L时,细胞比生长速率,R,R-2,3-丁二醇比合成速率两者均处于最优水平,同时菌体在此浓度下生长较好,菊粉的利用率也较高,因此在R,R-2,3-丁二醇的补料分批发酵中,将初糖质量浓度选择在75.0 g/L左右是比较合适的,在发酵后期补加碳源,提高糖浓度,将促进R,R-2,3-丁二醇的合成。
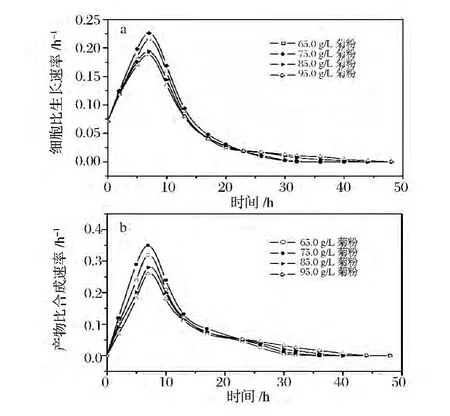
图1 不同菊粉浓度对细胞比生长速率和产物比合成速率的影响Fig.1 Comparison of kinetic parameters in R,R-2,3-BD batch fermentation by P.polymyxa ZJ-9 under different initial inulin concentration
2.2 补糖种类的确定
前期研究过程中发现,P.polymyxa ZJ-9分批发酵能较好地利用菊芋菊粉粗提液作为发酵底物,而以葡萄糖,纯菊粉,果糖,蔗糖等糖类作为碳源时,发酵产物R,R-2,3-丁二醇的产量均很低,分析原因,可能是菊芋菊粉粗提液中一些微量元素、维生素和氨基酸等成分促进了发酵产物的合成[11]。补料分批发酵,前期以菊芋菊粉粗提液作为发酵底物,控制菊粉的初始质量浓度为75.0 g/L左右,在发酵后期分别考察补料添加葡萄糖、纯菌粉、果糖和蔗糖对菌体生长和产物合成影响情况。
从图1可以看出,在发酵后期(发酵22 h后)添加碳源有利于菌体生长和R,R-2,3-丁二醇的合成,因此选择在发酵22 h(此时菌粉质量浓度已降到约25 g/L)时,分别添加20.0 g/L的葡萄糖、纯菊粉、果糖、蔗糖,当碳源浓度再次降到25 g/L时,第二次分别添加20.0 g/L相同的底物。由图2可知,在7.5 L发酵罐中,P.polymyxa ZJ-9能够很好利用补加的葡萄糖、菊粉、果糖、蔗糖,与分批发酵相比,通过两次脉冲补加糖,R,R-2,3-丁二醇的产量得到了提高。其中葡萄糖的利用效果最好,发酵44 h产量达到49.5 g/L,为同批次最高,其次是菊粉、果糖和蔗糖,蔗糖的利用率相对较低,发酵44 h产量仅达到42.8 g/L,残糖达到17.6 g/L。伴随发酵进行,P.polymyxa ZJ-9能够有效地利用上述补料添加的糖类,表明菊芋菊粉粗提液中残存的微量元素、维生素和氨基酸等成分能够继续促进菌株对添加碳源的利用。考虑发酵液最终产物的产量以及葡萄糖成本相对较低,补糖分批发酵选择补加葡萄糖为研究对象。然而,实验发现补糖分批发酵在提高产量的同时,最终发酵液中残糖浓度相对较高,在补加葡萄糖的发酵液中仍然残留9.4 g/L,因此有必要对混合发酵菊粉和葡萄糖补料分批发酵工艺条件进行进一步改进。

图2 P.polymyxa ZJ-9发酵合成R,R-2,3-BD的补料分批发酵过程曲线Fig.2 The production of R,R-2,3-BD by P.polymyxa ZJ-9 with Fed-batch fermentation of raw inulin extract from Jerusalem artichoke tubers using different sugar supplemention
2.3 菊粉和葡萄糖混合发酵工艺条件研究
由上述研究可知,当补加40.0 g/L的葡萄糖时,残糖质量浓度依然达到约10 g/L,表明补加的葡萄糖过量,最终确定补料分批发酵的过程中添加30.0 g/L葡萄糖。在7.5 L发酵罐中,研究了一次性补加,恒速流加,分批补加三种不同补料方式对P.polymyxa ZJ-9混合发酵菊粉和葡萄糖对合成R,R-2,3-丁二醇的影响,在发酵末期分别测量 DCW,R,R-2,3-丁二醇,乙偶姻,残糖浓度等情况。图3可以看出,22 h之前为菌体大量生长阶段,22 h以后,为产物大量合成阶段,与对照相比,通过后期补糖有利于P.polymyxa ZJ-9对糖的利用率,并促进产物R,R-2,3-丁二醇大量积累。其中分批补加方式(图3d),即分别在22 h(此时菌粉质量浓度已降到约25 g/L)和31 h(此时总糖浓度再次降到约25 g/L)分别补加15.0 g/L的葡萄糖,发酵到44 h时,R,R-2,3-丁二醇的产量达到最大值约47.8 g/L,残糖量少,同时,菌体量相对较高。分析原因,可能一次性补加葡萄糖时,过多的糖抑制了菌体的生长代谢,不利于产物的合成。而恒速流加补糖,发酵周期延长,菌体生长代谢能力低,底物利用效率不高,残糖多,导致产物R,R-2,3-丁二醇产量偏低。
表2可以看出,补料分批发酵终点与分批发酵相比细胞干重有所提高,其中分批补加方式细胞干重达到22.6 g/L。通过分批补加葡萄糖,R,R-2,3-丁二醇达到了47.8 g/L,与对照相比,糖转化率由原来的34.9%提高到45.5%,生产强度由原来的0.70 g/(L·h)提高到1.09 g/(L·h)。所以,补料分批发酵对于菌体的生长、产物的合成以及糖转化率等均具有积极作用。此外,补料分批发酵终点,残糖浓度相对较低,有利于工业化应用。

图3 不同的补料方式对发酵合成R,R-2,3-BD的影响Fig.3 Effects of different feeding glucose methods in R,R-2,3-BD production with Fed-batch fermentation of raw inulin extract from Jerusalem artichoke tubers by P.polymyxa ZJ-9
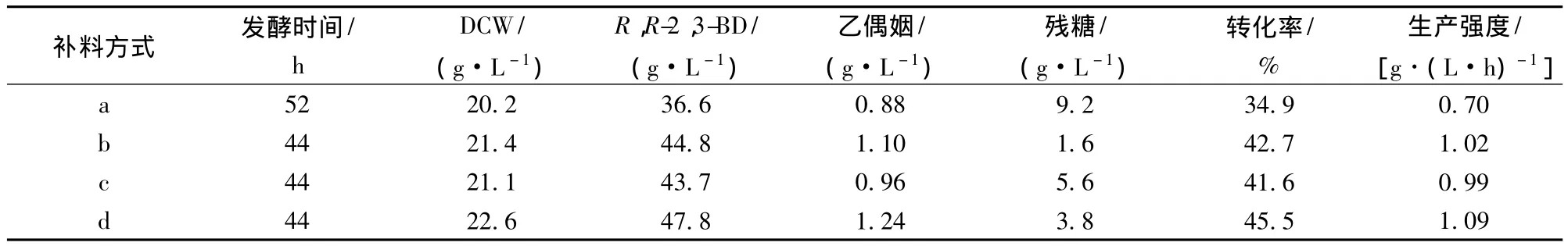
表2 7.5 L发酵罐中不同补料方式发酵过程参数比较Table 2 Comparison of feeding glucose methods in R,R-2,3-BD production with Fed-batch fermentation of raw inulin extract from Jerusalem artichoke tubers by P.polymyxa ZJ-9
2.4 25 L发酵罐中补料分批发酵扩大实验
为了验证P.polymyxa ZJ-9混合发酵菊粉和葡萄糖制备R,R-2,3-丁二醇发酵工艺条件的可行性,在25 L发酵罐上进行了扩大实验。如图4所示,通过补料分批发酵,当发酵44 h时,R,R-2,3-丁二醇产量达到最高值48.5 g/L,而乙偶姻以及残糖相对较低,分别为 1.34 g/L 和 3.2 g/L,碳源对 R,R-2,3-丁二醇转化率达到46.2%,从而证明了P.polymyxa ZJ-9混合发酵菊粉和葡萄糖合成R,R-2,3-丁二醇最佳发酵工艺条件的可行性和可操作性,为工业化发酵制备R,R-2,3-丁二醇奠定了坚实的基础。
3 结论

图4 25 L发酵罐中补料分批发酵过程Fig.4 The producction of R,R-2,3-BD by P.polymyxa ZJ-9 with Fed-batch fermentation of mixture of inulin and glucose in a 25 L bioreactor
本研究选取菊芋菊粉粗提液直接作为发酵前期底物,考察不同初始菊粉浓度发酵条件下的P.polymyxa ZJ-9 细胞比生长速率(μ)和 R,R-2,3-丁二醇比合成速率(qp),在此基础上,分别补料添加葡萄糖、菊粉、果糖和蔗糖进行发酵效果分析比较,确定了补料添加葡萄糖的发酵策略,并在7.5 L发酵罐上进行了分批、补料分批工艺研究。通过上述发酵工艺条件研究,最终确定了P.polymyxa ZJ-9混合发酵菊粉和葡萄糖制备R,R-2,3-丁二醇的最佳工艺条件。研究结果表明,该补料分批发酵工艺具有成本低、效率高和适合工业化生产等优势。
[1] Tran A V,Chambers R P.The dehydration of the fermentative 2,3-butanediol into methyl ketone[J].Biotechnol Bioeng,1987,29(3):343 -351.
[2] Ng T K,Busche R M,McDonald C C,et al.Production of feedstock chemicals[J].Science,1983,219(4585):733-740.
[3] 罗云富,李援朝.手性邻二醇-(2S,3R)21,2,32丁三醇212对甲苯磺酸酯的不对称合成[J].有机化学,2002,22(4):262-264.
[4] Celińska E,Grajek W.Biotechnological production of 2,3-butanediol-Current state and prospects[J].Biotechnology Advances,2009,27(6):715 -725.
[5] YU Bo,SUN Jian-bin,Rajesh Reddy Bommareddy,et al.Novel(2R,3R)-2,3-butanediol dehydrogenase from potential industrial strain paenibacillus polymyxa ATCC 12321[J].Applied and Environmental Microbiology,2011,77(12):4 230-4 233.
[6] CHI Zhen-ming,ZHANG Tong,CAO Tian-chu,et al.Biotechnological potential of inulin for bioprocesses[J].Bioresource Technology,2011,102(6):4 295 -4 303.
[7] 杨欢欢,高健,徐虹,等.利用菊芋菊粉制备R,R-2,3-丁二醇发酵工艺条件的优化[J].食品与发酵工业,2011,37(11):6 -10.
[8] ZHU Ling-qing,YANG Xue,XUE Chao-you,et al.Enhanced rhamnolipids production by Pseudomonas aeruginosa based on a pH stage-controlled fed-batch fermentation process[J].Bioresource Technology,2012,117:208 -213.
[9] 陈雄,章莹,袁金凤,等.聚-ε-赖氨酸补料发酵的初步研究[J].工业微生物,2007,37(4):20-22.
[10] Lee,Jeongseok,Lee Sang Yup,Park Sunwon,et al.Control of fed-batch fermentations[J].Biotech Adv,1999,17(1):29.
[11] GAO Jian,XU Hong,LI Qiu-jie,et al.Optimization of medium for one-step fermentation of inulin extract from Jerusalem artichoke tubers using Paenibacillus polymyxa ZJ-9 to produce R,R-2,3-butanediol[J].Bioresource Technology,2010,101(18):7 076 -7 082.
[12] 高健,彭斌,李凤伟,等.一种多粘类芽抱杆菌及利用其制备光学纯R,R型2,3-丁二醇的方法[P].中国发明专利,ZL 200910026807.1.
[13] 高健,彭斌,徐虹.菊芋中菊粉的提取分离研究[J].安徽农业科学,2009,37(l):184 -185.
