利用常压室温等离子体(ARTP)诱变选育高产核酸酶P1菌株
2015-05-05梁剑光顾秋忆秦修东陈中兵余华顺
梁剑光,顾秋忆,秦修东,陈中兵,余华顺,姚 娟
(1.常熟理工学院 生物与食品工程学院,江苏常熟 215500;2.浙江升华拜克生物股份有限公司,浙江湖州 223232;3.安琪酵母股份有限公司,湖北宜昌 215500)
利用常压室温等离子体(ARTP)诱变选育高产核酸酶P1菌株
梁剑光1,2,顾秋忆1,秦修东1,陈中兵2,余华顺3,姚 娟3
(1.常熟理工学院 生物与食品工程学院,江苏常熟 215500;2.浙江升华拜克生物股份有限公司,浙江湖州 223232;3.安琪酵母股份有限公司,湖北宜昌 215500)
为提高核酸酶P1的发酵酶活,以桔青霉菌株CK-3为出发菌株,利用常压室温等离子体(ARTP)诱变方法,获得了3株(CK-3-1,CK-3-7,CK-3-9)高产核酸酶P1菌株,其中CK-3-9突变株酶活较高,其核酸酶Pl发酵酶活达到1232 U/mL,比出发菌株CK-3(酶活866 U/mL)提高到了42.2%,遗传实验表明稳定性好,有望用于工业化生产。
核酸酶P1,桔青霉,ARTP,诱变
核酸酶P1(Nuclease P1,EC3.30.1),又名5′-磷酸二酯酶,是一种含锌的金属酶,核酸酶P1能水解RNA和热变性DNA得到5′-核苷酸,可用于食品调味剂(呈味核苷酸)和核苷酸医药工业,具有广泛的实用价值,在核苷酸工业生产中起到的重要作用[1]。1960年日本科学家发现5′-肌苷酸具有强烈鲜味首先将核苷酸类物质作为鲜味剂生产,并于上世纪60年代后日本成为核苷酸增鲜剂的最大生产国[2]。国内采用深层发酵法生产核酸酶P1的厂家几乎没有,导致价格被日本味之素企业垄断,其主要原因是发酵生产菌种产酶水平低,导致生产成本居高不下,因此,如何获得高产核酸酶P1的生产菌种是解决生产核酸酶P1的关键技术之一[3]。常压室温等离子体(Atmospheric and Room Temperature Plasma ARTP)具有射流温度低、产生的等离子体均匀、无需真空装置、操作简易、成本低、与生物大分子和细胞作用明显等优点[4-5]。ARTP放电均匀稳定、活性粒子浓度高、操作简便、诱变快速、环境友好、对操作者安全无辐射、操作可控性强等特点,已成为一种应用广泛的、快速高效的新型生物诱变育种方法[6]。到目前为止,ARTP 诱变育种仪已经成功应用于包括细菌、真菌、微藻在内的多种微生物,并且突变率和正突变率均较高,突变株遗传稳定性好等诸多优点[7]。本实验以核酸酶P1的产生菌为出发菌株,利用常压室温等离子体(ARTP)诱变筛选高产核酸酶P1菌株,从而获得高产菌种,有望用于工业生产。
1 材料与方法
1.1 材料与仪器
葡萄糖,鱼粉蛋白胨,蔗糖,吐温-80,钼酸铵,高氯酸,酵母核糖核酸RNA等实验试剂 国药集团。
桔青霉 出发菌种CK-3 常熟理工学院微生物与分离工程实验室。
常压室温等离子体(ARTP)思清源生物科技有限公司;霉菌培养箱 MP-160B型 上海申贤设备厂;大容量恒温培养摇床 SPH-211型 上海世平实验设备有限公司;紫外可见分光光度计UNIKONXS型, 尤尼柯(上海)仪器有限公司。
1.2 实验方法
1.2.1 斜面和平板培养 斜面和平板培养基采用PDA培养基:马铃薯20%,葡萄糖2%,琼脂粉2%,pH自然。用接种环挑取一环于无菌生理盐水中进行稀释(10-7),涂布于斜面或平板上,放置于28 ℃霉菌培养箱中进行培养5 d。
1.2.2 种子培养及发酵方法 采用一级种子发酵方法,具体如下:种子培养基(质量体积分数):葡萄糖3%,蛋白胨0.15%,KH2PO40.15%,K2HPO40.15%,MgSO40.24%,CaCl20.15%,pH6.5。从母瓶中挖取约1 cm2菌苔接种于250 mL三角瓶(装液量40 mL)的液体种子培养基中,在28 ℃,转速250 r/min,摇床培养24~26 h。
产酶基础培养基(质量分数):蔗糖1.5%,蛋白胨0.6%,KH2PO40.05%,K2HPO40.05%,MgSO40.04%,CaCl20.08%,ZnSO40.02%,吐温80 0.05%,pH6.5。从液体种子培养基中移取3 mL种子液到250 mL三角瓶(装液量30 mL)的产酶基础培养基中,28 ℃,转速250 r/min,摇床培养66~72 h,测定发酵液酶活。
1.2.3 ARTP 诱变方法 参考文献[8-9]进行。用10 mL无菌生理盐水加入1支斜面孢子,震荡1 min后菌液颜色变深,适当用无菌水稀释成不同浓度(10-4,10-5,10-6,10-7,10-8)。用移液枪取出适量在ARTP诱变金属片上,依照说明书操作,其主要流程如图1[10]。在诱变过程中,大部分孢子死亡,只少部分处理后的孢子存活下来,可以用致死率来表示。因此,致死率是指经过诱变处理后,死亡的细菌或孢子与处理之前的细菌或孢子总数的比值。本实验在测定时候,取同一份孢子悬液,分成两份,一份经诱变处理后进行平板计数,另一份不诱变就进行平板计数,然后将两者结果进行比较即可。具体计算公式如下:
致死率(%)=未经处理平板菌落总数-经过处理后的平板菌落总数/未经处理平板菌落总数×100

图1 ARTP诱变基本流程图Fig.1 The basic flow of the ARTP mutation
1.2.4 核酸酶P1测定 参考文献[11],略有改动。在试管中加入1.9 mL底物溶液(3% 酵母核糖核酸RNA,煮沸20 min,调节pH到5.0,用pH为5.0醋酸-醋酸钠缓冲液定容),置于68 ℃水浴保温10 min后,加入预处理好的发酵液0.1 mL,继续保温15 min后,置冰水中冷却,迅速加入2.0 mL核酸沉淀剂(0.25%钼酸铵-2.5%高氯酸),继续冷却10 min,于3500 r/min离心15 min,取0.2 mL上清液加双蒸水稀释定容至50 mL,于260 nm处测定吸光度。
空白对照:1.9 mL底物,在68 ℃保温25 min,加入核酸沉淀剂2.0 mL,再加酶液0.1 mL,余下步骤同样品测定。上述测酶活的条件下,每min所生成的核苷酸量在260 nm光密度为1.0时,定义为1个酶活单位。
相对酶活(U/mL)=筛选后的菌株酶活-对照菌株酶活/对照菌株酶活×100%
本文所有的酶活测定均为三个平行样的平均值。
1.2.5 高产菌株筛选方法 初筛:菌悬液经过ARTP诱变处理后,适当稀释涂平板,在28 ℃培养箱中培养5 d,观察菌落孢子量和颜色并测定菌落直径大小,选取孢子量多,菌落直径相对较大的菌落进行摇瓶发酵验证。复筛:在初筛菌株基础上,对酶活较高的菌株进行在进行一轮ARPT诱变,通过摇瓶发酵,选取酶活更高的菌株。
1.2.6 突变株菌落形态变化 以CK-3菌株为出发菌株,其孢子经过ARTP处理后,稀释涂布于PDA平板上,28 ℃培养4 d,观察菌落形态变化。
2 结果与分析
2.1 ARTP诱变处理时间的选择
桔青霉菌株孢子外壁较厚,物理处理孢子诱变时间一般在1 min以上。因此,本实验ARTP 诱变处理时间单位为分钟(min)。实验结果见图2,横坐标表示处理时间(min),纵坐标为孢子致死率(%)。从图2中可知,桔青霉菌株孢子在ARTP处理过程中,随着处理时间的增加,致死率在不断增加,当处理时间为3 min后,孢子致死率达到93.3%,超过4 min时,孢子致死率接近100%,桔青霉菌株孢子几乎都被杀死。因此,本实验ARPT处理桔青霉孢子时间为3~4 min即可。

表1 等离子诱变初筛突变菌株的酶活
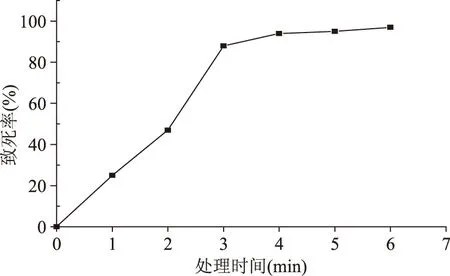
图2 ARPT诱变致死率曲线Fig.2 Variation of the lethality rate by ARTP with different exposure time
注:酶活为三个平行样的平均值。
2.2 ARPT诱变高产突变株选育
2.2.1 突变株菌落形态变化 通过第一轮ARTP诱变,获得11株相对高产的突变菌株(编号依次为CK-3-1,CK-3-2,CK-3-3,CK-3-4,CK-3-5,CK-3-6,CK-3-7,CK-3-8,CK-3-9,CK-3-10,CK-3-11)。各突变株的菌落形态图。
根据图3菌落形态颜色可看出菌落CK-3-1、CK-3-2、CK-3-3与CK-3-9的菌落颜色都发生了较为明显的变化:CK-3-1与CK-3-9的菌落颜色偏深灰色且菌落直径较大,菌落生长较为旺盛;CK-3-2与CK-3-3菌落颜色偏深灰绿色。从菌落大小上来看,大多数突变菌株的生长较出发菌株偏大,突变株培养4 d菌落直径就达到1.5 cm,而出发菌株培养5 d左右菌落直径才能达到1.5 cm(见表1)。从菌落颜色的变化间接证明了菌株的代谢产物发生了一定的变化,而菌落大小说明了突变株的生长速度较快。

图3 ARPT诱变后菌落与出发菌落对比Fig.3 The comparison between CK-3 strian and the ARPT mutation strains
2.2.2 突变株发酵性能初步筛选 参照1.2.5实验方法,在平板上挑取各突变株菌落进行菌株筛选发酵性能验证,结果见表1。从相对酶活结果来看,共有3株突变菌株(CK-3-1,CK-3-7,CK-3-9)获得相对酶活7%以上的提高,分别为107.4%,114.3%和116.4%。11株突变株的菌落形态颜色变化较大,CK-3-1和CK-3-9均为深灰色,说明深灰色菌落可能孢子量较多,酶活相对较高,将3株突变株保存,进行下一步实验。
2.2.3 高产突变株发酵复筛 在初筛突变菌株CK-3-1,CK-3-7,CK-3-9基础上,对3株突变菌进一步发酵复筛,实验条件和培养基与 出发菌株相同,进行摇瓶发酵复筛。在实验过程中,因CK-3-9最为明显,以CK-3-9 与出发菌株对照比较为例,发现桔青霉突变株种子液菌球形态和发酵菌球形态和颜色存在较大差异,结果见图4。
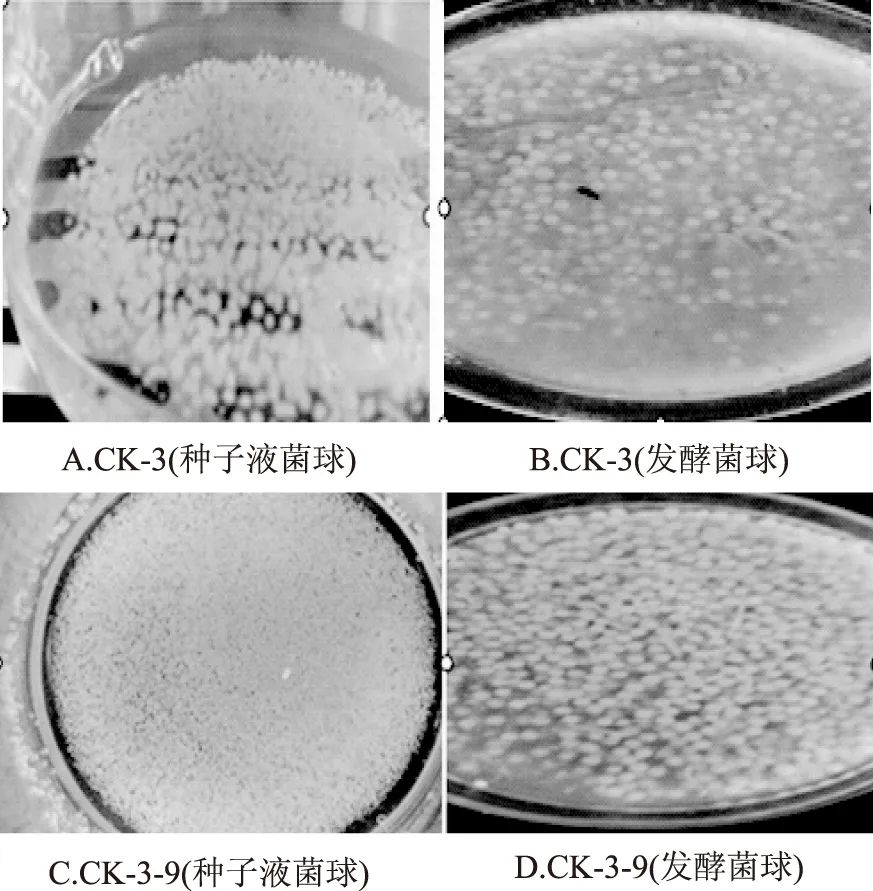
图4 出发菌株CK-3与突变株CK-3-9发酵过程菌形比较Fig.4 The mycelial morphology comparison between the original CK-3 strian and the ARPT mutation strain CK-3-9
经过图4可以看出突变株CK-3-9种子瓶中的菌球细腻,菌球小、菌球量多,种子液清澈,颜色浅;而出发菌株CK-3种子瓶的菌丝球大、菌球量少,颜色淡黄、菌液清澈。通过发酵液酶活测定,3株突变菌的发酵酶活结果见表2。

表2 等离子诱变后突变菌株的酶活
最终结果表明,以核酸酶Pl产生菌桔青霉CK-3作为出发菌株,经过常压室温等离子体诱变处理,得到了3株高产核酸酶P1突变株,经发酵复筛验证,其中CK-3-9产生的核酸酶Pl酶活提高到1232 U/mL,比原始出发菌株CK-3(866 U/mL)提高了42.3%,该菌株在安琪酵母有限公司进行中试生产,达到了工业化要求。
2.2.4 突变株遗传稳定性考察 对上述的3株高产核酸酶P1突变菌进行发酵稳定性考察,其结果如图5所示。

图5 高产突变株遗传稳定性考察 Fig.5 Genetic stability of the high-yielding strain
从图5中可以看出,CK-3-1、CK-3-7和CK-3-9的菌株随着传代次数在3代以内酶活程增加趋势,随着传代次数增加到第4和第5代,其产核酸酶P1的酶活均有不同程度的降低,但总的来看,3株高产菌株的酶活没有大起大落,均较稳定。核酸酶P1酶活在第2和3代有所升高可能是因为随着传代次数的增加,突变菌逐渐适应了外界的环境,其新陈代谢逐渐调整到最佳状态。经过高产核酸酶P1遗传稳定性考察,CK-3-9的酶活稳定在1200 U/mL左右,这样我们就得到了ARTP诱变后产核酸酶P1酶活高的桔青霉菌株,接近于工业化生产菌株。
3 结论
本文首次利用ARTP 诱变桔青霉菌株,成功获得了3株高产核酸酶P1突变株,其中CK-3-9产生的核酸酶Pl酶活高达1232 U/mL,其遗传稳定性好,为工业化生产核酸酶P1提供了较好菌株和菌种育种科学依据。
[1]李科德,韩木兰,柏建玲,等. 5’-磷酸二酯酶高产菌株的选育和发酵培养条件的优化[J]. 微生物学杂志,200l,21(3):28-33.
[2]胡丹东,崔玉娟. 一株高产核酸酶P1菌株的诱变选育[J].西北师范大学学报,2008,6(44):79-93.
[3]梁剑光,黄鹏,徐正军. 桔青霉发酵法生产核酸酶P1工艺条件及影响因素[J]. 中国酿造, 2007,11:27-30.
[4]金丽华,方明月,张翀. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J]. 生物工程学报,2011,27(3):461-467.
[5]夏书琴,刘龙,张东旭,等. 大气压辉光放电低温等离子体诱变选育谷氨酰胺转胺酶高产菌株[J]. 微生物学通报,2010,37(11):1642-1649.
[6]Lu Yuan,Wang Liyan,Ma Kun,et al. Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma(APTP)[J]. Biochemical Engineering Journal,2011,55(1):17-22.
[7]Li HP,Li G,Sun WT,et al. Radio-frequency,atmospheric pressure glow discharges:production methods,characteristics and applications in bio-medical fields[J],Complex Systems,2008,982:584-591.
[8]金丽华,方明月,张狲,等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J]. 生物工程学报,2011,27(3):461-467.
[9]Li G,Li HP,Wang YL,et al. Genetic effects of radio-frequency,atmospheric-pressure glow discharges with helium[J]. Appl Phys Lett,2008,92:2551504.
[10]Wang L Y. Huang Z L,Li G,et al. Novel mutation breeding method forStreptomycesavermitilisusing an atmospheric pressure glow discharge plasma[J]. Applied Microbiology,2009,1365-2672.
[11]徐正军,肖林平,吕洁等. 实验设计法优化核酸酶P的发酵培养基[J]. 过程工程学报,2003,3(5):433-437.
Screening of high-yield nuclease P1 strain by exposed under atmospheric and room temperature plasma
LIANG Jian-guang1,2,GU Qiu-yi1,QIN Xiu-dong1,CHEN Zhong-bing2,YU Hua-shun3,YAO Juan3
(1.School of Biology and Food Engineering,Changshu Institute of Technology,Changshu 215500,China;2. Zhe Jiang Shenghua Biok Biology Co. Ltd,Huzhou 313220,China;3. Angel Yeast Co.Ltd.,Yichang 443003,China)
To enhance the productivity of nuclease P1 fromPenicilliumcitrinum,a novel mutation system with atmospheric and room temperature plasma(ARTP)was used. Experiment results indicated that the high-yield nuclease P1 strains(CK-3-1,CK-3-7,CK-3-9)was obtained,and the CK-3-9 nuclease P1 enzyme activity reached 1232 U/mL,which was increased by 42.2% compared with the parent strain CK-3. The result showed that the genetic stability was good.
Nuclease P1;penicilliumcitrinum;ARTP;mutation
2015-01-26
梁剑光(1979-),男,博士研究生,副教授,研究方向:微生物及发酵工程,E-mail:liang4523@126.com。
TS201.3
A
1002-0306(2015)21-0183-04
10.13386/j.issn1002-0306.2015.21.029
