六堡茶提取物对高脂小鼠肠道菌群的影响研究
2015-05-05赵园园韦保耀滕建文
赵园园,黄 丽,韦保耀,滕建文,夏 宁
(广西大学轻工与食品工程学院,广西南宁 530004)
六堡茶提取物对高脂小鼠肠道菌群的影响研究
赵园园,黄 丽,韦保耀*,滕建文,夏 宁
(广西大学轻工与食品工程学院,广西南宁 530004)
将六堡茶提取物与高脂小鼠粪便进行体外发酵培养,比较正常对照组和体外发酵组的菌群变化情况,探讨六堡茶对高脂小鼠肠道菌群的影响。结果显示,随着发酵时间的延长,总厌氧菌的数量与发酵0 h比较呈现显著增长趋势,且在发酵至24 h,总厌氧菌的数量明显超过了正常对照组,而总需氧菌数量在发酵36 h后,才发生显著性变化,较0 h明显降低了8.4%,并显著低于正常对照组水平。其中,双歧杆菌、乳酸杆菌、拟杆菌和肠球菌的数量在发酵36 h后,与正常对照组相比无显著性差异,均趋向于正常对照组水平,而大肠杆菌的数量虽呈降低趋势,但仍高于正常对照组。研究结果表明,六堡茶提取物能够促进高脂小鼠肠道菌群中厌氧菌的生长,并抑制需氧菌的繁殖,调节高脂饮食引起的小鼠肠道菌群紊乱。
六堡茶提取物,体外发酵,肠道菌群,高脂血症
人体肠道内微生物种类繁多,这些菌群与宿主的健康息息相关[1]。越来越多的研究表明,肠道菌群与血脂之间有千丝万缕的联系,高脂血症能够影响肠道菌群的结构,使肠道正常菌群系统紊乱,双歧杆菌、乳酸菌等有益菌数量降低[2-3]。
研究证明茶叶具有改善肠道菌群结构、辅助降血脂的功效。然而研究发现,随着茶的摄入,其功能性物质在胃肠道较稳定,大约有90%~95%的成分未被小肠吸收,而是进入结肠,经过肠道微生物代谢后被吸收入血,进而发挥作用[4]。吴香兰[5]、金莉莎[6]的研究表明茶叶对常见致病菌和肠道有害菌的抑制效果明显,并且能够有效调节肠杆菌、肠球菌、双歧杆菌和乳杆菌的数量,具有恢复肠道微生态平衡的作用。Tzounis等人通过体外发酵模型对多酚单体对肠道菌群的影响进行了研究,发现加入儿茶素后双歧杆菌的数量显著增加,而大肠杆菌和梭菌属被抑制[7]。这些研究均表明茶叶的功能性组分能够调节肠道菌群,但未能与某些疾病引起的肠道菌群变化联系起来,对茶叶如何通过肠道菌群发挥其生理功能的研究尚不多见,因此对于茶叶的保健功能作用机制阐述不够全面。

表1 肠道菌群计数用培养基、培养条件
六堡茶属黑茶类,因其独特的品质,成为广西梧州地理标志产品。经实验证明,六堡茶具有降血脂的功效[8],但其作用机理还未见报道;因此本研究通过体外培养的方法将六堡茶提取物与小鼠粪便进行体外发酵,对发酵后的肠道菌群的结构进行分析,研究六堡茶提取物对高脂小鼠的肠道菌群的调整作用,为探讨六堡茶的降血脂机理提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
六堡茶 梧州中茶茶厂,产品批号为:6918;实验小鼠 选择日龄相同的SPF级昆明种健康小鼠,雌雄各半,体重为(20±2)g,广西医科大学动物实验中心实验,许可证号为SCXK桂2009-0002;基础饲料与高脂饲料 广西医科大学动物实验中心;血清总胆固醇(TC)检测试剂盒(批号:140104)、血清甘油三酯(TG)检测试剂盒(批号:140301)、血清高密度脂蛋白胆固醇(HDL-C)检测试剂盒(批号:140407) 长春汇力生物技术有限责任公司。
RE-5205型旋转蒸发器 上海亚荣生化仪器厂;SHB-III型循环水式多用真空泵 郑州长城科工贸有限公司;HHS型电热恒温水浴锅 上海博迅实业有限公司医疗设备厂;YFD-2000型真空冷冻干燥机 西安德派生物科技公司;YQX-Ⅲ型厌氧培养箱 上海龙跃仪器设备有限公司;722型可见分光光度计 上海分析仪器三厂,HF-800A型半自动化生化分析仪 上海舒康仪器技术有限公司。
1.2 实验方法
1.2.1 六堡茶提取物的制备 称取粉碎后的茶叶10 g,加入70%乙醇在80 ℃下水浴回流浸提3次(固液比分别为1∶10、1∶8和1∶6),合并浸提液,离心,经0.45 μm微孔滤膜过滤后收集滤液,旋转蒸发,冻干得六堡茶提取物3.18 g,其茶多酚含量占冻干物质含量的10.3%。
1.2.2 实验小鼠造模和粪便的采集 将20只小鼠编号,随机分为2组,各10只,一组为正常对照组,一组为高脂模型组。两组均给予基础饲料,适应性喂养6 d,取尾血,测定TC、TG、HDL-C水平。比较正常对照组和高脂模型组TC、TG、HDL-C差异均无显著性后,正常组给予基础饲料,高脂组给予高脂饲料,喂养30 d后,取尾血,测定TC、TG、HDL-C水平。粪便采集:造模成功后,分别采集正常组和高脂组小鼠的粪便于无菌EP管中,低温保存,用于后续分析。
1.2.3 体外发酵方法 参考文献[9],取高脂小鼠粪便1 g,加入到4 mL已灭菌的生理盐水中,在涡旋混合器上混合均匀,过滤。取1 mL滤液与10 mL厌氧培养液混合,制成肠菌培养液,在肠菌培养液中加入10 mg六堡茶提取物,混合均匀,在37 ℃下进行厌氧培养0、6、12、24、36 h。实验重复三次,以上操作均在无菌环境下进行。
1.3 分析方法
1.3.1 血脂水平测定 利用自动化生化分析仪和分光光度计,按测定试剂盒使用说明书进行检测。
1.3.2 茶多酚含量的测定 参考文献[10],测定茶多酚的含量,称取0.1 g冻干样品,用蒸馏水溶解,转移至100 mL容量瓶中,用水定容至刻度,摇匀,待测。
没食子酸工作液的制备:称取0.110 g±0.001 g没食子酸,于100 mL容量瓶中溶解并定容至刻度,摇匀。用移液管分别移取1.0、2.0、3.0、4.0、5.0 mL的上述溶液于100 mL容量瓶中,分别用蒸馏水定容至刻度,摇匀,浓度分别为10、20、30、40、50 μg/mL。
测定:用移液管分别移取没食子酸工作液、水(空白对照)及测试液各1.0 mL于刻度试管内,在每个试管内分别加入5.0 mL的福林酚试剂,摇匀。反应3~8 min内,加入4.0 mL 7.5% Na2CO3溶液,加水定容至刻度、摇匀。室温下放置60 min,用10 mm比色皿,在765 nm波长条件下用分光光度计测定吸光度。
1.3.3 微生物的培养与计数
1.3.3.1 正常对照组小鼠粪便菌群培养 按照1.2.3所述,将正常对照组小鼠粪便制成肠菌培养液后,取1 mL培养液,用灭菌生理盐水递10倍稀释,涂布,培养,平板计数法进行计数。培养条件见表1。
1.3.3.2 发酵组小鼠粪便菌群培养 分别在培养0、6、12、24、36 h后取1 mL培养液,如1.3.3.1所述操作,平板计数法进行计数。
1.4 数据分析

2 结果与分析
2.1 小鼠高脂血症模型的建立
具体结果见表2。
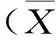
表2 正常对照组与高脂组小鼠血脂水平含量的变化±S,mmol/L)
注:**表示与正常对照组比较血脂水平差异极显著p<0.01。

表3 小鼠粪便菌群计数结果
注:**表示与正常对照组比较,差异性极显著(p<0.01);##表示与发酵0 h比较差异性极显著(p<0.01)。
从表2可以看出,适应期时,高脂模型组小鼠血脂水平与正常对照组比较,无显著性差异。造模30 d后,高脂组小鼠的血清TG和TC含量分别为3.72 mmol/L和7.11 mmol/L,HDL-C为0.54 mmol/L,高脂组与正常对照组比较,TG和TC的含量显著性升高,而HDL-C含量显著性降低(p<0.01)。与国家食药总局颁布的评价方法[12]中描述一致。因此结果表明高脂血症模型建立成功。
2.2 六堡茶对高脂血症小鼠肠道菌群的影响
菌群计数结果如表3所示。

图1 发酵不同时间各菌群数量相对于正常对照组菌群变化情况Fig.1 Changes of the number of bacterium of fermentation different time relative to normal control group注:SA=(QA-QA0)/QA0×100%;SZ=(QA-QZ)/QZ×100%。SA:发酵不同时间各菌群数相对于发酵0 h菌群数的变化率;QA:发酵不同时间各菌群数量;QA0:发酵0 h菌群数量;SZ:发酵不同时间各菌群数相对于正常对照组菌群数的变化率;QZ:正常对照组菌群数量。
2.2.1 高脂小鼠肠道菌群失调验证 由图1可以看出,发酵0 h的总厌氧菌、双歧杆菌、乳酸菌、拟杆菌和肠球菌的数量与正常对照组比较,分别降低了24.7%、9.6%、14.5%、10.9%、8.9%,而需氧菌和大肠杆菌的数量与正常对照组比较分别升高了6.2%、17%,与正常对照组差异性显著。已有研究证明,高脂血症可引起小鼠肠道菌群系统发生紊乱[2-3,13],因此实验结果符合这一结论。

图2 发酵不同时间各菌群数量相对于发酵0 h菌群变化情况Fig.2 Changes of the number of bacterium of fermentation different time relative to fermentation 0h group
2.2.2 六堡茶提取物对高脂小鼠肠道菌群数量的影响 由图2可见,随着发酵时间的延长,总厌氧菌的数量与发酵0 h比较呈现显著增长趋势,且在发酵至24 h,总厌氧菌的数量明显超过了正常对照组(图1),而总需氧菌数量在发酵36 h后,才发生显著性变化,较0 h明显降低了8.4%,并显著低于正常对照组水平(图1)。结果表明,六堡茶提取物能促进高脂小鼠粪便菌群中厌氧菌的生长,并抑制需氧菌的繁殖,随着发酵时间的延长,总需氧菌和总厌氧菌数量逐渐趋向于正常小鼠的肠道菌群数量。
双歧杆菌的变化情况:由图2可知,六堡茶提取物与高脂小鼠粪便进行发酵至6 h与12 h时,双歧杆菌数量变化不明显,发酵至24 h后,双歧杆菌数量较0 h明显增加了4.1%,继续发酵至36 h后,双歧杆菌数量较0 h显著增加了10.4%,但仍高于正常对照组水平。
乳酸杆菌的变化情况:由图2可知,随着发酵时间的延长,乳酸杆菌的数量呈显著增加趋势,发酵至36 h,乳酸杆菌的数量与正常对照组相比无显著性差异(图1),由此可见,发酵至36 h后,乳酸杆菌的数量趋向于正常对照组水平。
拟杆菌的变化情况:由图2可知,发酵6 h与24 h,拟杆菌的数量变化不明显,发酵至24 h后,拟杆菌数量显著增加,较0 h明显增加了9.2%,继续发酵至36 h,拟杆菌数量较0 h显著增加了10.9%,且在发酵24 h,拟杆菌的数量与正常对照组相比无显著性差异(图1),由此可见,发酵至24 h,拟杆菌的数量趋向于正常对照组水平。
肠球菌的变化情况:由图2可知,肠球菌数量的变化情况与拟杆菌相似,呈逐渐增加趋势,发酵至36 h,肠球菌的数量与正常对照组相比无显著性差异(图1)。
大肠杆菌的变化情况:由图2可知,发酵至24 h,大肠杆菌的数量与0 h相比明显降低了3.1%,继续发酵至36 h,大肠杆菌的数量较0 h显著降低了10.9%,但仍高于正常对照组水平(图1)。
结果表明,六堡茶提取物能够促进高脂小鼠肠道中双歧杆菌、乳酸杆菌、拟杆菌和肠球菌的生长,并在一定程度上抑制大肠杆菌的生长繁殖。
3 结论与讨论
正常人体肠道中的细菌约400~500种,主要有拟杆菌属、乳杆菌属、梭菌属、大肠埃希菌属和双歧杆菌属等,其中约99%为厌氧菌。有研究表明,高脂饮食可使大鼠肠道乳酸菌和双歧杆菌明显降低[13]。丰富的碳水化合物及膳食纤维能够促进肠道厌氧菌的生长,而由于高脂饮食中脂类成分较多,使大肠菌群的养料来源减少,导致大肠杆菌等有害菌群快速生长,可能成为大肠菌群失衡的原因。而肠道菌群失调同时也会加重脂质代谢紊乱。研究发现,双歧杆菌、乳酸杆菌、肠球菌、拟杆菌中均可产生胆汁酸水解酶(BSH酶),此酶可把结合胆汁酸转变成游离胆汁酸,影响胆汁酸的肠肝循环,促使肝脏利用胆固醇合成胆汁酸增加,使血中的胆固醇更多的被转化,实现降低血胆固醇的作用[14-20]。双歧杆菌、乳酸杆菌、肠球菌和拟杆菌普遍存在于肠道中,其数量的减少可以削弱血中胆固醇被转化利用的过程,使血脂升高。
茶叶具有改善肠道菌群结构功效,其功能已经得到广泛的认同。吴香兰以茯砖茶、青砖茶、千两茶和六堡茶四种具有代表性的黑茶为研究对象,研究其抑菌效果和对肠道菌群结构的影响,研究表明四种茶叶对常见致病菌和肠道有害菌的抑制效果明显,而对肠道有益菌群双歧杆菌和乳酸菌的生长具有促进作用,且六堡茶抑菌效果相对较好[5]。茶叶可分为绿茶、黄茶、黑茶、白茶、青茶、红茶六大类。金莉莎也对六大茶类茶叶-石门银峰、君山银针、大红袍、白毫银针、信阳红和茯砖的保健功能进行了研究,建立肠道菌群失衡模型,探讨六种茶叶对肠道菌群的调整作用,结果表明大红袍、茯砖和信阳红能够有效调节肠杆菌、肠球菌、双歧杆菌和乳杆菌的数量,具有恢复肠道微生态平衡的作用[6]。
本实验通过建立高脂血症小鼠模型,采集小鼠粪便,将六堡茶提取物与高脂小鼠粪便进行发酵培养,探讨六堡茶提取物对高脂血症小鼠肠道菌群的影响。结果显示,加入六堡茶提取物与高脂小鼠粪便进行发酵培养后,各菌群结构发生明显变化。随着发酵时间的延长,总厌氧菌的数量与发酵0 h比较呈现显著增长趋势,且在发酵至24 h,总厌氧菌的数量明显超过了正常对照组,而总需氧菌数量在发酵36 h后,才发生显著性变化,较0 h明显降低了8.4%,并显著低于正常对照组水平。其中,双歧杆菌、乳酸杆菌、拟杆菌和肠球菌的数量在发酵36 h后,与正常对照组相比无显著性差异,均趋向于正常对照组水平,而大肠杆菌的数量虽呈降低趋势,但仍高于正常对照组。研究结果表明,六堡茶提取物能够促进高脂小鼠肠道菌群中厌氧菌的生长,并抑制需氧菌的繁殖,调节高脂饮食引起的小鼠肠道菌群紊乱。
[1]Eckburg PB,Bik E M,Bernstein C N,et al. Diversity of the human intestinal microbial flora[J]. Science,2005,308(5728):1635-1638.
[2]任婷婷.从高脂血症大鼠模型大、小肠菌群改变探讨肠道菌群与高脂血症的关系[D].长沙:中南大学,2005.
[3]张翼.膳食诱导肥胖大鼠的肠道菌群结构研究[D].上海:上海交通大学,2009.
[4]Victor R. Preedy. Tea in Health and Disease Prevention[M]. London,UK:Academic Press,2013:399-483.
[5]吴香兰.黑茶改善胃肠道功能的实验研究[D].长沙:湖南农业大学,2013.
[6]金莉莎.茶对肠道功能调节作用的研究[D].长沙:湖南农业大学,2012.
[7]Tzounis X,Vulevic J,Kuhnle G,et al..Flavanol monomer-induced changes to the human faecal microflora[J].British Journal of Nutrition,2008(99):782-792.
[8]彭静静. 六堡茶的降血脂功能性研究[D].南宁:广西大学,2012.
[9]Luis Condezo-Hoyos,Indira P Mohanty,Giuliana D Noratto. Assessing non-digestible compounds in apple cultivars and their potential as modulators of obese faecal microbiotainvitro[J]. Food Chemistry,2014(161):208-215.
[10]高玉萍,涂云飞,杨秀芳,等.茶多酚制品中多酚含量测定方法比较研究[J].中国茶叶加工,2013(3):28-32.
[11]中华人民共和国卫生部.保健食品检验与评价技术规范[M].北京:人民卫生出版社,2003.
[12]国家食品药品监督管理总局.《辅助降血脂功能评价方法》.
[13]徐仁应,万燕萍,方启宇,等.高脂饮食对大鼠肠道益生菌和肝脂肪含量的影响[J].营养学报,2011(33):367-375.
[14]Pallavi Bhangea,N Sridevi Deu S Bhange,et al. Immobilization of bile salt hydrolase enzyme on mesoporous SBA-15 for co-precipitation of cholesterol[J]. International Journal of Biological Macromolecules,2014(63):218-224.
[15]Fatemeh Miremadia,Mutamed Ayyashb,Frank Sherkat. Cholesterol reduction mechanisms and fatty acid composition ofcellular membranes of probiotic Lactobacilli and Bifidobacteria[J]. Journal of Functional Foods,2014(9):295-305.
[16]Guijie Li. Intestinal Probiotics:Interactions with Bile Salts and Reduction of Cholesterol[J]. Procedia Environmental Sciences,2012(12):1180-1186.
[17]岳婷婷,侯红漫.胆盐水解酶的研究现状[J].中国乳品工业,2010(38):33-37.
[18]王俊国,孟和毕力格,包秋华,等.具有胆盐水解酶活性的乳酸菌对高血脂症大鼠的血脂调节作用[J].食品科学,2013(34):257-226.
[19]李云梅.长双歧杆菌NCC2705胆盐水解酶基因(BSH)的克隆表达及其特性研究[D].西安:西北农林科技大学,2012.
[20]王继超,胆盐水解酶的分离纯化及酶学性质的研究[D]. 哈尔滨:黑龙江大学,2010.
Effect of Liupao tea extract on fecal microbiota in hyperlipidemic mice
ZHAO Yuan-yuan,HUANG Li,WEI Bao-yao*,TENG Jian-wen,XIA Ning
(College of Light Industry and Food Engineering,Guangxi University,Nanning 530004,China)
The Liupao tea extract were cultured with fecalinvitroto investigate the effects of Liupao tea extract on intestinal flora in hyperlipidemia mice. The results showed that the number of total anaerobic incresed significantly compared with normal group with the extension of the fermentation time. While the number of total aerobic changed significantly after fermentation 36 h and significantly decreased 8.4% compared with fermentation 0 h. Among them,the number ofBifidobacterium,Lactobacillus,BacteroidesandEnterococcishowed no significant diffirence compared with normal group after fermentation 36 h,and tended to the normal group level. While the number ofE.colihad shown a decreasing trend,but still higher than the normal group level. The study indicated that the Liupao tea extract could promote anaerobic and inhibit aerobic bacteria in fat mice intestinal flora,regulate disorder of intestinal flora in high-fat diet-induced mice.
Liupao tea extract;fermentationinvitro;intestinal flora;hyperlipemia
2015-02-13
赵园园(1988-),女,在读硕士,研究方向:天然产物活性成分功能性研究,E-mail:619992508@qq.com。
*通讯作者:韦保耀(1963-),男,博士,教授,研究方向:天然产物化学成分分离及化学结构研究,E-mail:273417261@qq.com。
广西自然科学基金(2012GXNSFBA053024)。
TS272.5
A
1002-0306(2015)21-0364-05
10.13386/j.issn1002-0306.2015.21.067
