乙酰化黑木耳多糖的制备及其抗氧化活性研究
2015-05-05杨春瑜杨春莉刘海玲景志刚徐晓鑫王田慧
杨春瑜,杨春莉,刘海玲,景志刚,徐晓鑫,王田慧
(1.哈尔滨商业大学食品工程学院黑龙江省食品科学与工程重点实验室,黑龙江哈尔滨 150076;2.哈尔滨商业大学轻工学院,黑龙江哈尔滨150028;3.黑龙江省玄鸟生物科技股份有限公司,黑龙江哈尔滨 150000)
乙酰化黑木耳多糖的制备及其抗氧化活性研究
杨春瑜1,杨春莉2,刘海玲1,景志刚1,徐晓鑫3,王田慧1
(1.哈尔滨商业大学食品工程学院黑龙江省食品科学与工程重点实验室,黑龙江哈尔滨 150076;2.哈尔滨商业大学轻工学院,黑龙江哈尔滨150028;3.黑龙江省玄鸟生物科技股份有限公司,黑龙江哈尔滨 150000)
本实验采用二次回归正交组合设计法优化了乙酰化黑木耳多糖的制备工艺,并对乙酰化前后黑木耳多糖的抗氧化活性进行了比较研究。实验以甲酰胺为溶剂,乙酸酐为酰化试剂,N-溴代琥珀酰亚胺(NBS)为催化剂,采用二次回归正交组合设计法,以反应时间、反应温度、酰化试剂用量和NBS添加量为实验因素,采用羟胺比色法测定乙酰取代度的大小,以乙酰化取代度大小为实验指标,利用SPSS软件进行数据分析。结果表明,酰化试剂用量和NBS添加量对黑木耳多糖乙酰化有显著影响(p<0.05),经过方程运算,得到制备乙酰化黑木耳多糖的最优实验条件为,反应时间3.5 h,反应温度80.0 ℃,乙酰化试剂用量32.5 mL,NBS添加量为1.0%,在此实验条件下,得到的乙酰化取代度平均值为0.55。通过对原多糖和乙酰化多糖的红外光谱检测,显示乙酰化黑木耳多糖制备成功。抗氧化活性研究结果显示,黑木耳多糖乙酰化改性后清除羟自由基和超氧阴离子自由基的能力有所增加;还原能力也要比原料多糖有所提高。
黑木耳多糖,乙酰化,红外光谱(IR),抗氧化活性
真菌中多糖具有抗肿瘤,抗氧化,降血脂,降血糖和增强免疫等作用[1]。影响多糖活性的因素包括多糖的主链性质、支链性质和多糖分子的高级结构[2]。为了更好的发挥多糖的活性,对多糖分子进行修饰和结构改造具有重要意义[3]。多糖的乙酰化是一种重要的多糖支链修饰方法,乙酰基能使多糖的伸展发生变化,导致多糖羟基暴露,增加多糖在水中的溶解度,从而改善多糖的生理活性,使多糖得到有效利用[4]。多糖的活性与多糖的结构、分子量、溶解性等诸多因素紧密相关。但是多糖的衍生化也有使原有活性减弱或丧失,因此多糖的衍生化关键在于确定多糖的结构与活性关系,确保多糖在衍生化后活性中心的立体构象处于最佳状态[5]。天然多糖是一种多羟基的化合物,这些羟基均为活性基团,在适当环境中,它们可被亲核基团或亲核化合物取代,而发生亲核取代反应,生成相应的多糖酯。多糖乙酰化反应,实质上是多元醇与酸发生的酯化反应[6],其酯化反应机理如见图1:

表1 因素上下水平及因子编码
注:Z1=x1Δ1+Z01;Z2=x2Δ2+Z02;Z3=x3Δ3+Z03。
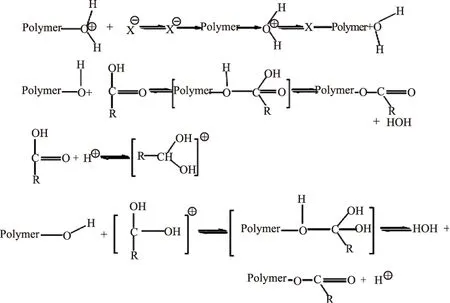
图1 多糖酯化反应机理Fig.1 Reaction mechanism of polysaccharide esterification
另外,羟自由基和超氧阴离子等自由基,与炎症等疾病有着密切的关系[7]。大量研究表明,黑木耳多糖具有体外抗氧化活性[8],本文主要对黑木耳多糖进行乙酰化修饰,并对其体外抗氧化活性进行比较。从而为开发出更利于人类健康的产品提供科学依据。
1 材料与方法
1.1 材料与仪器
黑木耳 产于黑龙江省牡丹江林口地区;盐酸羟胺、氢氧化钠、浓盐酸、三氯化铁、乙酸酐、正丁醇、氨水、柠檬酸、丙酮、活性炭、三氯甲烷、过氧化氢、磷酸氢二钠、无水乙醇、甲酰胺、3600 u透析袋、N-溴代琥珀酸亚胺(NBS)、番红花、磷酸二氢钠、磷酸氢二钠、双氧水、乙二胺四乙酸铁钠(EDTA-Fe)、邻苯三酚、Tris、HCl、铁氰化钾、三氯乙酸、三氯化铁等均为分析纯,实验用水均为蒸馏水。
高转速离心机 北京医用离心机厂;ESJ120-4电子天平 沈阳龙腾电子称量仪器公司;多功能摇摆粉碎机 上海市新亚净化器件厂;721E型可见光光度计 上海天美科学仪器有限公司;78-1型磁力加热搅拌器 上海南江电汎器材厂;DK-98-I型电子恒温水浴 天津泰斯特仪器公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;DHG-9240型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司、傅立叶变换红外光谱仪 北京备份瑞利分析仪器有限公司;UV-5100B型紫外可见分光光度计 上海元析仪器有限公司。
1.2 实验方法
1.2.1 黑木耳多糖的提取 根据同一个课题组前期的研究[9],确定黑木耳多糖提取的最优条件为温度80 ℃、时间5.5 h、料液比1∶110、pH5.5。根据同一课题组前期研究得到工艺流程[10]如下:
黑木耳粉→去脂→浸提→上清液→4100 r/min离心30 min→上清液→测糖含量→Sevag法[11]除蛋白→活性炭脱色→95%乙醇沉淀→丙酮沉淀→离子交换→浓缩干燥
1.2.2 乙酰化黑木耳多糖的制备 称取2.000 g黑木耳多糖溶于80 mL甲酰胺中,恒温搅拌一定时间,滴加相应体积的乙酸酐(含1% NBS,提前溶于乙酸酐中),恒温搅拌反应,反应结束后测乙酰取代度。85%的乙醇沉淀;用95%乙醇洗涤沉淀1~2次。将沉淀溶于10~20 mL蒸馏水中。3600 u透析袋蒸馏水透析2 d,减压浓缩,冷冻干燥,由IR检测乙酰化是否成功[12-13]。
1.2.3 二次回归正交组合设计实验 以反应时间、反应温度、乙酰化试剂用量,NBS添加量四个因素进行考察,对四个因素进行单因素实验,比较实验结果,选择主要影响乙酰化效果的水平做二次回归正交组合设计实验,对结果进行方差分析,确定黑木耳多糖乙酰化最好的工艺条件。
1.2.4 乙酰取代度的测定方法 采用羟胺比色法[14]测定黑木耳多糖的乙酰取代度,是利用强碱条件下游离出来的乙酰基与羟胺反应生成乙酰肟羟酸,再与Fe3+生成可溶性红色络合物羟肟酸铁,即可利用分光光度计进行乙酰取代度测定;该法较为简便快捷、灵敏度高,适用范围较广。
1.2.4.1 乙酰基含量标准曲线的制备β-D-五乙酰葡萄糖储备液的配制:精密称取β-D-五乙酰葡萄糖(分子量390.34 u)0.6978 g,置100 mL量瓶中,加20 mL乙醇于60 ℃水浴加热溶解后,冷却至室温,再加水稀释至刻度,摇匀后即得。储备液中乙酰基(分子量 43.05 u)浓度按对照品的55.14%计,为3.848 mg/mL。β-D-五乙酰葡萄糖系列标准溶液的配制:精密吸取β-D-五乙酰葡萄糖对照品储备液2、4、6、8、10、12 mL,分别置 50 mL 容量瓶中,加水稀释至刻度,摇匀即得,依次标记为1~6号对照品溶液。最大吸收波长测定:以三氯化铁为显色剂,以水做空白对照,用紫外吸收分光光度计对生成的棕色络合物进行全波长扫描。确定最大吸收波长之后,精密吸取1~6号对照品溶液5 mL于50 mL容量瓶中,照方法,于最大波长处(500 nm)处测定吸收度值(A)。以乙酰基的浓度(C,mg·mL-1)为横坐标,吸收度 A为纵坐标作图。
1.2.4.2 乙酰基最大吸收波长的确定 精密吸取4号0.62 mg·L-1标准液5 mL 于 50 mL 容量瓶中,照“1.2.4.1”项下方法,取该溶液2.5 mL,置于1 cm石英比色皿中,作为对照品溶液;以相同量的去离子水代替多糖,作为空白溶液,在200~800 nm的波长范围内扫描。
1.2.4.3 样品乙酰取代度的测定方法 样品溶液配制:精密称取乙酰化黑木耳多糖0.02901 g,置10 mL容量瓶中,加水适量,置60 ℃水浴上加热溶解,待完全溶解后冷却至室温,再加水定容,即得。
样品测定步骤:精确吸取一定量的多糖溶液于50 mL棕色容量瓶中,准确加入0.1 mol·L-1新配制盐酸羟胺溶液5 mL,加入1.5 mol·L-1氢氧化钠溶液5 mL,混匀,静置20 min后,加入2 mol·L-1盐酸3.5 mL以中和过量的碱,混匀后静置20 min,滴加0.37 mol·L-1三氯化铁溶液10 mL混匀,用去离子水定容,静置10 min后,取2.5 mL,置1 cm石英池中,作为供试品溶液。另以相同量的去离子水代替多糖溶液同法操作,作为空白,一定时间内测定吸收度。
1.2.4.4 乙酰取代度计算方法 乙酰取代度度是指平均每个失水葡萄糖单元上被乙酰基取代的羟基数目,具体数值按以下公式得出:
W2(%)=W2/W1×100
式(1)
式(2)
式中:W1-多糖的质量(mg),W2-多糖中乙酰基的质量(mg),162-乙酰化黑木耳多糖中一个单糖基相对分子质量,43-乙酰基相对分子质量,1-氢原子的相对原子质量。
1.2.5 单因素实验
1.2.5.1 反应时间对黑木耳多糖乙酰化的影响 将2.000 g样品溶于80 mL的甲酰胺中,加入32.5 mL的乙酰化试剂(含有1%NBS的乙酸酐)在80 ℃下,分别反应2、3、4、5、6 h。反应结束后,将乙酰化多糖干燥后,测乙酰取代度。
1.2.5.2 反应温度对黑木耳多糖乙酰化的影响 将2.000 g样品溶于80 mL的甲酰胺中,加入32.5 mL的乙酰化试剂(含有1%NBS的乙酸酐)在20、40、60、80、100 ℃下,分别反应4 h。反应结束后,将乙酰化多糖干燥后,测乙酰取代度。
1.2.5.3 乙酰化试剂用量对黑木耳多糖乙酰化的影响 将2.000 g样品溶于80 mL的甲酰胺中,分别加入15、23.75、32.5、41.25、50.00 mL的乙酰化试剂(含有1% NBS的乙酸酐)在80 ℃下,分别反应4 h。反应结束后,将乙酰化多糖干燥后,测乙酰取代度。
1.2.5.4 NBS添加量对黑木耳多糖乙酰化的影响 将2.000 g样品溶于80 mL的甲酰胺中,加入分别含有0.5%、1%、1.5%、2%、2.5% NBS的32.5 mL乙酰化试剂,在80 ℃下,分别反应4 h。反应结束后,将乙酰化多糖干燥后,测乙酰取代度。
1.2.6 红外光谱检测 利用二次回归正交组合设计实验得到的最优实验方案,制备乙酰化黑木耳多糖。取10 mg左右的黑木耳多糖、乙酰化黑木耳多糖,用 KBr 研磨压片后,在4000~400 cm-1范围内进行扫描。

清除率(%)=(A样品-A空白)/A对照×100
式(3)
清除率(%)=(ΔAo-ΔA)/(ΔAo)×100
式(4)
式中,ΔAo为邻苯三酚自氧化速率,ΔA 为加入多糖溶液后,邻苯三酚的自氧化速率,单位均为吸光度每分钟的增加值。
1.2.9 还原能力 在不同浓度的样品 1.25 mL(0.5~4.0 mg/mL)中,加入磷酸缓冲液(0. 2 mol/L pH6. 0)配制的1%(w/v)的铁氰化钾1.25 mL,在50 ℃下保温20 min,用1. 25 mL三氯乙酸(10%,w/v)终止反应,5 min后加入1. 5 mL 0. 1%三氯化铁,室温放置30 min,700 nm下测定吸光度,吸光度越大,还原能力越强[19-20]。
1.3 数据处理分析方法
本文采用SPSS数据处理软件,对结果进行分析。
2 结果与分析
2.1 乙酰基最大吸收波长的确定
如图2结果显示在200~800 nm可见光波长处测定时,对照品溶液在500 nm波长处最大吸收,相应的空白溶液干扰小,故选用500 nm为测定波长。
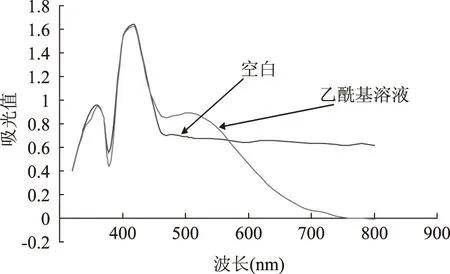
图2 β-D-五乙酰葡萄糖的紫外吸收图谱Fig.2 Acetyl β-d-glucose byUV absorption spectrum
2.2 乙酰基标准曲线
以乙酰基的浓度(C,mg·mL-1)为横坐标,吸收度A为纵坐标作图。
如图3,得到乙酰基标准曲线为Y=14.178x+0.0589,R2=0.9909。表明,乙酰基浓度在0.01~0.1 mg·mL-1范围内,吸收度与浓度呈良好的线性关系。
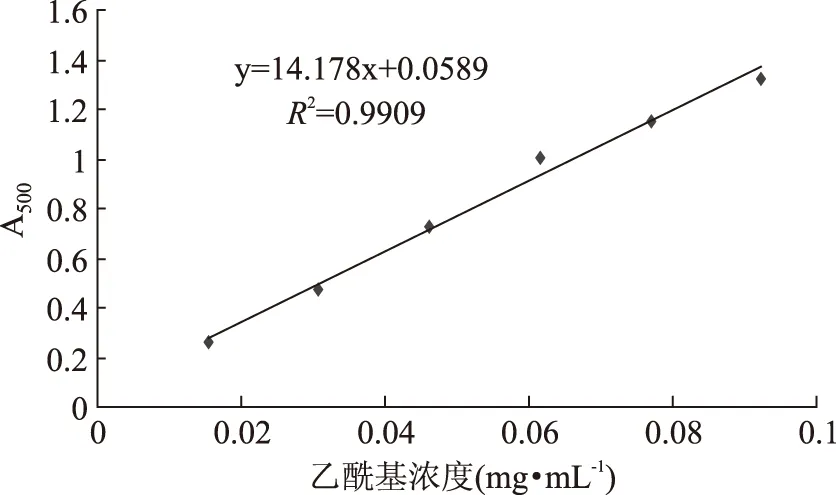
图3 乙酰基标准曲线Fig.3 Acetyl standard curve
2.3 单因素及二次回归组合正交实验
2.3.1 反应时间对黑木耳多糖乙酰化效果的影响 由图4可知,乙酰取代度开始随反应时间的增加而增加,当反应4 h时,乙酰取代度的值最大,乙酰化效果最好;此时乙酰化试剂与黑木耳多糖恰好反应完全,当反应时间继续增加时,乙酰取代度开始减少,可能是由于,反应时间过长,使一部分乙酰化多糖的乙酰基游离出来,导致取代度降低,随后随时间的延长,乙酰基又与多糖集合,乙酰度又开始增大。因此,选择3~5 h进行后续优化实验。

图4 反应时间对黑木耳多糖乙酰化的影响Fig.4 Effect of reaction time on polysaccharide acetylated of Auricular auricularia
2.3.2 反应温度对黑木耳多糖乙酰化效果的影响 由图5可知,乙酰化取代度开始随反应温度的增加而增大,80 ℃时,乙酰取代度最大,乙酰化效果最好,此时的温度能够使乙酰基与多糖紧密结合;当反应温度继续增加时,乙酰取代度开始降低,温度过高的同时会降低乙酰基与多糖的结合力,并且溶液开始产生副反应物,出现明显的黄色,不利于乙酰化多糖的制备。因此,选择温度为60~100 ℃进行后续实验。

图5 反应温度对黑木耳多糖乙酰化的影响Fig.5 Effect of reaction temperature on polysaccharide acetylated of Auricular auricularia
2.3.3 乙酰化试剂用量对乙酰化效果的影响 由图6可知,乙酰取代度随反应时间的增加而增加,乙酰化试剂添加量为32.5 mL时,乙酰取代度最大,乙酰化效果最好,此时乙酰化试剂与黑木耳多糖反应完全;当乙酰化试剂继续增加时,生成物乙酰化多糖对该反应起到抑制作用,乙酰取代度开始降低。因此,当乙酰化试剂添加量为32.5 mL时,乙酰化黑木耳多糖的效果最好。

图6 乙酰化试剂添加量对黑木耳多糖乙酰化的影响Fig.6 Effect of acetylated reagent addition on polysaccharide acetylated of Auricular auricularia
2.3.4 NBS添加量对乙酰化效果的影响 由图7可知,乙酰取代度随NBS添加量的增加而增加,NBS作为一种催化剂,NBS添加量为1%时,乙酰取代度最大,乙酰化效果最好,当NBS继续增加时,反应溶液黏度逐渐增加,影响溶液中乙酰化试剂与多糖的充分反应,乙酰取代度开始降低。因此,当NBS添加量为1%时,乙酰化黑木耳多糖的效果最好。
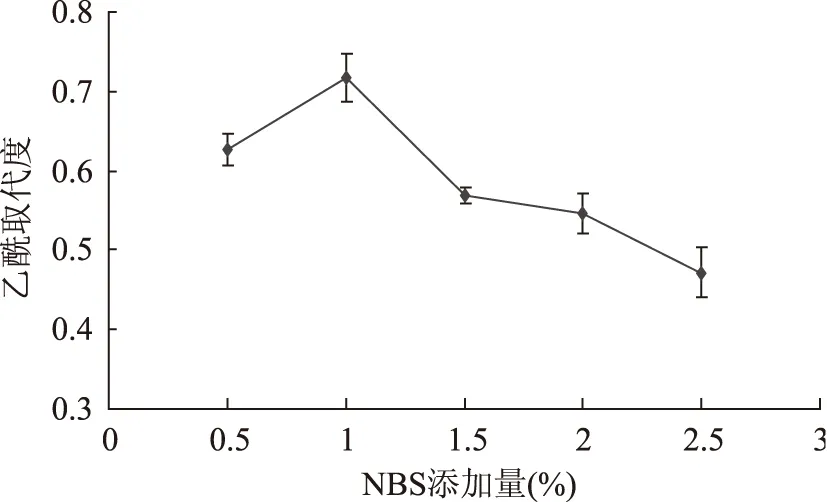
图7 NBS添加量对黑木耳多糖乙酰化的影响Fig.7 Effect of NBS addition on polysaccharide acetylated of Auricular auricularia
2.3.5 二次回归组合正交实验设计及结果 在单因素的基础上,选择乙酰取代度较高的反应时间,反应温度,乙酰化试剂用量,NBS添加量四个因素进行二次回归组合正交实验。二次回归组合正交设计与结果见表2。方差分析结果如表3和表4。其中y是乙酰化取代度,乙酰化取代度值越大,说明参加反应的乙酸酐的量越多[21-22]。

表2 乙酰化黑木耳多糖制备二次回归组合正交实验设计及结果
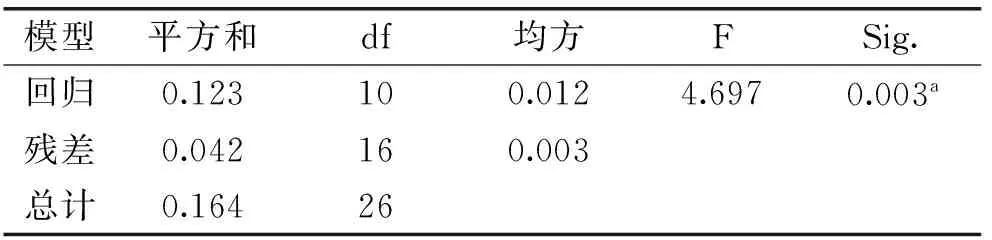
表3 方差分析

表4 系数α
对实验数据进行处理[23-24],乙酰化试剂用量和NBS添加量对黑木耳多糖乙酰化有显著影响(p<0.05)。得到回归方程,Y=0.430+0.018x1+0.017x2+0.033x3+0.044x4+0.037x1x2-0.013x1x3+0.012x1x4+0.05x2x3-0.07x2x4+0.014x3x4。
对x1、x2、x3、x4求导,Z1=x1Δ1+Z01;Z2=x2Δ2+Z02;Z3=x3Δ3+Z03;得到最优方案为温度80.223 ℃、时间3.571 h、乙酸化试剂32.532 mL、NBS添加量为1.031%。为检验二次回归正交法所得结果的可靠性采用上述优化提取条件进行乙酰化黑木耳多糖的制备,考虑到实际操作的便利,将提取工艺参数修正为温度80.0 ℃、时间3.5 h、乙酸化试剂32.5 mL、NBS添加量为1.0%。以上述条件进行实验结果的验证,重复3次实际测得的乙酰化黑木耳多糖取代度为分别得到0.57、0.49、0.58,三次实验平均取代度为0.55。说明通过二次回归正交优化后得出的回归方程具有一定的实践指导意义。然后对乙酰化黑木耳多糖进行红外光谱分析与原多糖红外光谱进行对比。
2.4 乙酰化黑木耳多糖与原多糖的红外光谱分析结果
黑木耳多糖的红外光谱,如图8,在1620~1630 cm-1附近显示出多糖的特征吸收。表明所得物即为黑木耳多糖。不难看出,乙酰化黑木耳多糖在1732. 81 cm-1处出现了一个吸收峰,为酯基C=O双键的伸缩振动,1260.80 cm-1处有一个酯基C—O的伸缩振动,说明乙酰化衍生物中已成功加入了乙酰基。乙酰化黑木耳多糖和原料多糖的IR谱图相比,表明样品的乙酰化是成功的[25]。

图8 乙酰化黑木耳多糖和原料黑木耳多糖的红外光谱图Fig.8 IR spectrum of Auricularia auricula acetylated polysaccharide and Auricularia auricula polysaccharide
2.5 样品对羟自由基(·OH)的清除作用
由图9可知,乙酰化黑木耳多糖清除羟自由基的能力均大于原料多糖,当浓度为1.5 mg·mL-1和3.5 mg·mL-1时清除率大于50%。可见,当黑木耳多糖乙酰化后其清除羟自由基的能力得到了很大的提高。
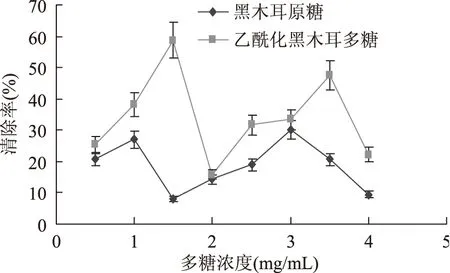
图9 乙酰化黑木耳多糖清除羟自由基的能力Fig.9 Acetylated Auricularia auricula polysaccharide removing hydroxyl free radical ability
由图10可见,不同浓度下黑木耳多糖与乙酰化黑木耳多糖均有清除超氧阴离子自由基的能力,乙酰化黑木耳多糖浓度在0~3 mg·mL-1随样品浓度的增加,清除率显著提高,且一直高于原料的清除能力。当浓度达到3 mg·mL-1时,增长趋势变缓。
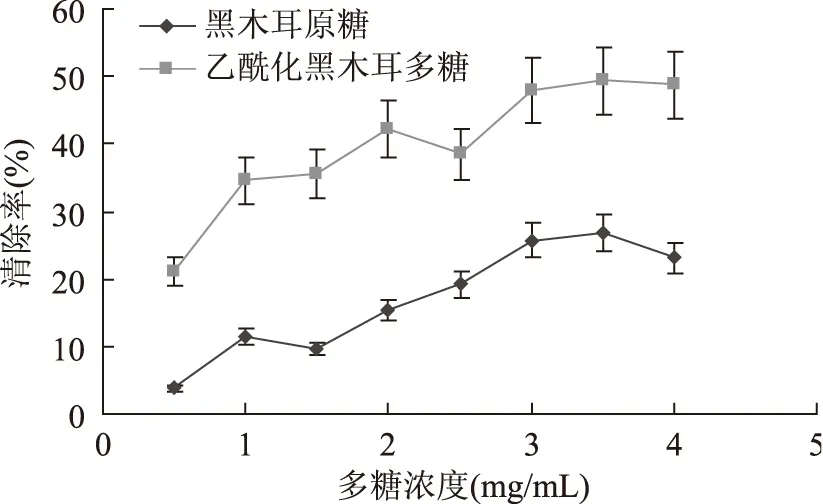
图10 乙酰化黑木耳多糖清除超氧阴离子自由基的能力Fig.10 Acetylated Auricularia auricula polysaccharide removal of superoxide anion free radical ability
2.7 还原能力
不同浓度样品的还原能力如图11所示,不同浓度样品的还原能力都大于相同浓度下原料多糖,且随着浓度的增加有所增加,显示乙酰化可以提高黑木耳多糖的还原能力。

图11 乙酰化黑木耳多糖的还原能力Fig.11 Acetylated Auricularia auricula polysaccharide of reducing power
3 结论
实验表明,酰化试剂用量和催化剂NBS添加量对黑木耳多糖乙酰化有显著影响。通过SPSS软件对数据进行处理,进一步得到制备乙酰化黑木耳多糖的最优实验条件为,反应时间为3.5 h,反应温度为80.0 ℃,乙酰化试剂用量为32.5 mL,NBS添加量为1.0%,在此实验条件下,得到的乙酰化取代度平均值为0.55。为以后研究乙酰化黑木耳多糖的性质提供了一定的实验基础。对乙酰化黑木耳多糖的抗氧化活性研究表明,乙酰化在对黑木耳多糖改性中体现出乙酰化黑木耳具有抗氧化活性。其对清除羟自由基的能力和清除超氧阴离子自由基的能力也有所增加;同时,还原能力也要比原料多糖有所提高。
[1]Ma Jiangwei,Qiao Zengyong,Xiang Xia. Optimization of extraction procedure for black fungus polysaccharides and effect of the polysaccharides on blood lipid and myocardium antioxidant enzymes activities[J]. Carbohydrate Polymers,2011(3):843-847.
[2]王兆梅,李琳,郭祀远,等. 活性多糖构效关系研究评述[J]. 现代化工,2002(8):18-21.
[3]Dace R,McBride E,Brooks K,et al. Comparison of the anticoagulant action of sulfated and phosphorylated polysaccharides.[J]. Thrombosis research,1997(1):871-876.
[4]梁忠岩,苗春艳,张翼伸. 化学修饰对斜顶菌多糖抑瘤活性影响的研究[J]. 中国药学杂志,1996(10):37-39.
[5]I. A. Ronova,A. Yu. Alentiev,S. Chisca,et al. Change of microstructure of polyimide thin films under the action of supercritical carbon dioxide and its influence on the transport properties[J]. Structural Chemistry,2014(1):251-256.
[6]殷殷. 白及多糖的可控乙酰化改性研究[D].苏州:苏州大学,2010
[7]谷娟. 抗氧化剂对动物免疫功能发育影响及其分子机理研究[D].上海:上海交通大学,2013.
[8]李婷婷,王振宇,尹红丽,等. 不同溶剂提取黑木耳多糖体外抗氧化活性的研究[J]. 安徽农业科学,2014(18):5951-5953.
[9]杨春瑜,姜启兴,夏文水,等. 黑木耳超微粉多糖相对分子质量分布及降血脂功能研究[J]. 中国食品学报,2008(6):23-32.
[10]薛海晶. 黑木耳超微粉多糖分离纯化和降血脂功能性研究[D].哈尔滨:东北林业大学,2008.
[11]何沂飞,刘平怀,黄良果,等. 库拉索芦荟凝胶多糖脱蛋白方法研究[J]. 食品工业科技,2014(17):190-192.
[12]X.F Sun,R.C Sun,J.X Sun. Acetylation of sugarcane bagasse using NBS as a catalyst under mild reaction conditions for the production of oil sorption-active materials[J]. Bioresource Technology,2004(3):953-957.
[13]宋逍,张丽华,赵鹏,等. 响应面法优选款冬花多糖的乙酰化工艺研究[J]. 中成药,2013(9):2030-2033.
[14]郭晓强,何钢,姚倩,等. 乙酰化银耳多糖的制备及其取代度测定[J]. 食品工业科技,2013,(12):255-257.
[15]Wu Sheng-Jun,Wu Jin-Hua,Xia Ling-Zhu,et al. Preparation of xanthan-derived oligosaccharides and their hydroxyl radical scavenging activity.[J]. Carbohydrate Polymers,2013(2):922-930.
[16]薛丁萍,魏玉西,刘淇,等. 浒苔多糖对羟自由基的清除作用研究[J]. 海洋科学,2010(1):44-47.
[17]Aleksandra Kadna,PaweBerczyński,Irena Kruk,et al. Superoxide anion radical scavenging property of catecholamines[J].Luminescence,2013(4):284-290.
[18]郭巧玲,谢建华,杨学敏,等. 菠萝多糖抗氧化功能的研究[J]. 农学学报,2012(3):50-53.
[19]Marutani Yoko,Yamauchi Yasuo,Kimura Yukihiro,et al. Damage to photosystem II due to heat stress without light-driven electron flow:involvement of enhanced introduction of reducing power into thylakoid membranes.[J]. Planta,2012(2):236:247.
[20]金迪,梁英,郑文凤,等. 黄芩多糖体外抗氧化活性研究[J]. 中兽医医药杂志,2012,(3):33-37.
[21]王晶,张全斌,张忠山,等. 乙酰化海带褐藻多糖硫酸酯的制备及其抗氧化活性研究[J]. 中国海洋药物,2008,(1):50-54.
[22]宋逍,辛亚洲,赵鹏,等. 响应面法优化金银花多糖乙酰化工艺[J]. 食品工业科技,2014,(17):262-265.
[23]杜瑞卿,吕文平,王丽. 二次回归正交组合设计与综合相关系数法对耐热纤维素酶基因工程菌发酵条件的优化与分析[J]. 食品科学,2010(3):160-164.
[24]张宇,周素敏,李雪英,等. 二次回归正交组合设计优化对乙酰氨基酚糖浆处方[J]. 中国药业,2008,(24):40-41.
[25]Young-Choon Kim,Tae-Wuk Bae,Hyuk-Ju Kwon,et al. Infrared(IR)image synthesis method of IR real background and modeled IR target[J]. Infrared Physics and Technology,2014(3):63-68.
Study on the Acetylated polysaccharide preparation and oxidation resistance ofAuriculariaauricular
YANG Chun-yu1,YANG Chun-li2,LIU Hai-ling1,JING Zhi-gang1,XU Xiao-xin3,WANG Tian-hui1
(1.Key Laboratory for Food Science & Engineering,Harbin University of Commerce,Harbin 150076,China;2.College of Light Industry,Harbin University of Commerce,Harbin 150028,China;3.Heilongjiang Phoenix Bio Technology Co.,Ltd,Harbin 150000,China)
The preparation conditions of acetylatedAuriculariaauricularpolysaccharide were optimized by combination design of quadratic regression orthogonal,and the antioxidant activity were studied at the same time. In this experiment,amide was used as solvent,acetic anhydride was used as acetylated reagent and N-Bromo succinimide(NBS)was used as catalyst. Indicators for acetylated degree of substitution,and the reaction time,reaction temperature,acetylated reagents and NBS addition were used for investigation of variable factors and by quadratic regression orthogonal combination design method. The final data was analyzed by SPSS software. The results showed that reagent dosage of acetylated and NBS addition of polysaccharide fromAuriculariaauricularhad a significant effect(p<0.05)on the acetylated polysaccharide preparation.After equation calculations,the preparation optimal acetylated conditions forAuriculariaauricularpolysaccharide were as:reaction time 3.5 h,reaction temperature 80.0 ℃,acetylating reagent dosage 32.5 mL,NBS addition was 1.0%. Under the experimental conditions,the acetylating of substitution degree average was 0.55. The results of original polysaccharide and acetylating of infrared spectrum detection showed acetylatedAuriculariaauricularpolysaccharide preparation was prepared. Using the optimal conditions for preparation of acetylatedAuriculariaauricularpolysaccharide,the oxidation resistance research showed that the ability of removal hydroxyl free radicals and remove super oxide anion free radical ability were a little improved,and reducing power was also increased
Auriculariauricularpolysaccharide;acetylated;infrared spectrum(IR);oxidation
2015-01-28
杨春瑜(1975-),女,博士, 教授,研究方向:生物分离纯化技术,E-mail:catherineyang88@126.com。
省教育厅青年骨干教师项目(G1155G24)。
TS201.2
A
1002-0306(2015)23-0105-07
10.13386/j.issn1002-0306.2015.23.013
