几种体外评价乳酸菌无细胞提取物抗氧化活性方法的比较研究
2015-05-05顾品品邢家溧张秋香印伯星房东升
顾品品,邢家溧,王 刚,*,张秋香,印伯星,房东升,张 灏,陈 卫,2,*
(1.江南大学食品学院,江苏无锡 214122;2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;3.扬州市扬大康源乳业有限公司,江苏扬州 225004)
几种体外评价乳酸菌无细胞提取物抗氧化活性方法的比较研究
顾品品1,邢家溧1,王 刚1,*,张秋香1,印伯星3,房东升3,张 灏1,陈 卫1,2,*
(1.江南大学食品学院,江苏无锡 214122;2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;3.扬州市扬大康源乳业有限公司,江苏扬州 225004)
乳酸菌的抗氧化活性与其对人体的健康促进作用密切相关。本研究以DPPH自由基清除能力、羟自由基清除能力、还原活性等为体外抗氧化能力评价指标,对17株不同来源乳酸菌的无细胞提取物抗氧化能力进行评价,并对评价结果进行了比较和筛选,然后进一步研究了抗氧化活性强和低的菌株的抗氧化酶活性。结果显示不同来源乳酸菌的无细胞提取物抗氧化活性存在种间和种内差异,而3种体外化学方法具有显著相关性(p<0.01)。3种评价指标均显示嗜酸乳杆菌CCFM8具有很强的抗氧化活性,发酵乳杆菌CCFM381抗氧化活性最弱。进一步乳酸菌无细胞提取物抗氧化酶活性的测定结果也与上述3种体外抗氧化能力评价指标的综合结果具有很好的一致性。该研究为综合评价乳酸菌抗氧化能力以及体外筛选具有高抗氧化活性的乳酸菌提供了可靠的参考依据。
乳酸菌,抗氧化,自由基,抗氧化酶
氧化应激是机体自由基的产生和内在抗氧化系统消减之间不平衡造成的,可引发癌症、关节炎、心血管等疾病[1]。因此,补充抗氧化物质增强机体抗氧化能力是十分必要的。然而许多化学合成的抗氧化物存在安全隐患,因此找到天然的抗氧化物是解决此类问题最为有效的途径[2-3]。目前,乳酸菌由于其健康保健作用,能够降低ROS的生成,受到越来越多的关注。大量研究表明乳酸菌可以缓解氧化应激从而阻止疾病的发生[4]。因此,无论从营养保健还是安全性考虑,乳酸菌作为天然抗氧化物质吸引了众多学者的研究兴趣,成为近年来抗氧化研究的新热点。目前对乳酸菌抗氧化能力的研究和利用多是针对活菌和无细胞提取物,很多体内与体外实验研究证明,乳酸菌细胞和无细胞提取物在体外具有类似抗氧化剂的活性[5]。张天博等[6]测定了52株菌株的细胞和无细胞提取物DPPH清除能力,研究发现菌株无细胞提取物的清除率均高于细胞。Lin和Yen[7]在对19株乳酸菌无细胞提取物进行抗氧化实验发现,所有菌株对抗坏血酸的自动氧化均具有抑制作用。
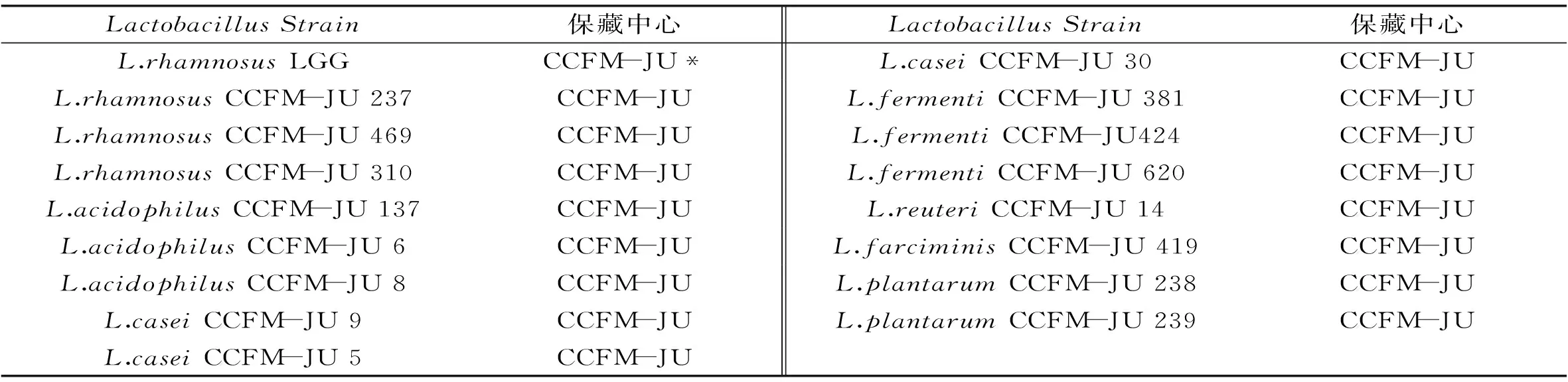
表1 本实验所用的菌株
注:CCFM-JU*:江南大学微生物菌种保藏中心。
本文通过DPPH自由基清除能力,羟自由基清除能力和还原能力3种化学方法,对来源于自然发酵食品中的17株乳酸菌的无细胞提取物抗氧化活性进行了分析和比较,并且比较了该3种化学方法所得结果的相关性。此外,本研究进一步对抗氧化活性较高和较低菌株中的SOD、GSH-PX以及CAT的含量进行了测定,并分析抗氧化活性与抗氧化物酶之间的关系,为全面分析乳酸菌的抗氧化能力提供了可靠的依据。
1 材料与方法
1.1 材料与仪器
本实验所用的菌株均为乳酸菌,由江南大学微生物菌种保藏中心提供,均分离自发酵泡菜,青海老酸奶,海南的酸豆角等自然发酵食品[8]。
二苯代苦味肼基(DPPH) 美国Sigma 公司;SOD和GSH检测试剂盒南京建成科技有限公司;硫代巴比妥酸(TBA),三氯乙酸(TCA),1,10-菲啰啉,FeSO4均为国产分析纯。
MRS培养基:蛋白胨10 g、牛肉膏10 g、酵母5 g、柠檬酸氢二铵2 g、葡萄糖20 g,吐温8~10 mL、乙酸钠5 g、磷酸氢二钾2 g、硫酸镁0.58 g、硫酸锰0.25 g,蒸馏水1000 mL,pH6.2~pH6.6,121 ℃灭菌15min[9]。
H.H.S21-4电热恒温水浴锅 上海医疗器械五厂;101-1型干燥箱 中国上海市实验仪厂;Delta320-S型pH计 梅特勒-托利多仪器(上海)有限公司;PYX-DHS隔水式恒温培养箱 上海跃进医疗器械厂;LS-B50L立式压力蒸汽灭菌器 上海三申医疗器械有限公司;WFJ 2000型可见光分光光度计尤尼柯 上海仪器有限公司;Multiskan MK3酶标仪 美国Thermo公司;TGL-16C离心机 上海安婷科学仪器厂。
1.2 实验方法
1.2.1 菌株的活化与无细胞提取物的制备 (1)菌株的活化17株乳酸菌菌株来源于7个种属(L.rhamnosus,L.acidophilus,L.casei,L.fermenti,L.reuteri,L.farciminis,L.plantarum)保存于含30%(v/v)甘油的MRS培养基中,-80 ℃冻存。使用前按1%(v/v)接种量接于MRS液体培养基,37 ℃培养18 h,连续活化2次。
(2)无细胞提取物的制备乳酸菌无细胞提取物的制备参考Liu和Pan的方法[4],收集活化后的乳酸菌(4 ℃,6000 r/min,10 min),用PBS清洗2次后,重悬于PBS中(1×109CFU/mL)超声破碎。超声破碎条件设置为:功率60 W,工作3 s停8 s,共15 min。将超声后的破碎液以12000 r/min离心20 min后取其上清,经过0.22 μm的滤膜过滤后得到无细胞提取物。
1.2.2 乳酸菌无细胞提取物DPPH清除率的测定 参考Lin和Chang的方法[10],取乳酸菌无细胞提取物1 mL加入试管中,再加入1 mL 0.2 mmol/L的DPPH-无水乙醇溶液,充分混匀后,避光反应30 min,然后取上清液,于517 nm处测定吸光值,以等体积的PBS代替样品溶液作为对照组。
按照以下公式计算:
DPPH自由基清除率(%)=(1-A517样品/A517对照)×100
式中:A517样品和A517对照分别为样品组和对照组在517 nm处测得的吸光值。
1.2.3 乳酸菌无细胞提取物清除羟自由基能力的测定 参考相关文献[11-12],将2.5 mmol/L的1,10-菲啰啉溶液、PBS(pH7.4)和样品溶液各1 mL混匀,再加入1 mL 2.5 mmol/L的FeSO4溶液,充分混匀后加入1 mL 20 mmol/L的H2O2溶液。将混合液放入37 ℃水浴中恒温反应1.5 h。6000 r/min离心10 min收集上清,于536 nm波长处测定其吸光值。同时按照上述方法,以1 mL PBS替代混合液中1 mL待测样品溶液作为空白对照组,测定在536 nm处的吸光值。
按照以下公式计算:
羟自由基清除率(%)=(1-A536样品/A536对照)×100
式中:A536样品和A536对照分别为样品组和对照组在波长536nm处测得的吸光值。
1.2.4 乳酸菌无细胞提取物还原能力的测定 参照Lin等人的方法[7]略有改进:取0.5 mL待测无细胞提取物,向其中加入0.5 mL 1% 铁氰化钾溶液及0.5 mL PBS(pH6.6),混匀后置于50 ℃水浴恒温反应20 min。从水浴中取出后放入冰浴中急速冷却,再加入0.5 mL10%的三氯乙酸溶液,混匀后离心收集上清(3000 r/min,10 min)。取上清液1 mL,再加入1 mL 0.1%的三氯化铁溶液,混合均匀。10 min后在700 nm处测定其吸光值,其中以L-半胱氨酸盐酸盐作为标品。同时,将上述混合液中的样品换成蒸馏水作为对照组,于700 nm波长处测定其吸光值。吸光值越大表示待测样品的还原能力越强[7]。
1.2.5 乳酸菌无细胞提取物GSH-Px,SOD,CAT活性的测定 按照试剂盒说明操作。
1.2.6 数据处理 采用Excel 2003和SPSS 13.0数据统计软件处理实验数据,每个实验重复3次。采用SPSS的单因素方差分析(ANOVA)样品的显著性差异,相关性分析采用Pearson测试。
2 结果与分析
2.1 DPPH自由基清除率
DPPH自由基清除率的测定是一种广泛使用的筛选和评价抗氧化剂抗氧化能力的方法[5]。DPPH清除率越大表明抗氧化能力越强。本研究测定了17株乳酸菌的无细胞提取物对DPPH自由基的清除情况,实验结果如图1所示。17株菌株都表现出一定的DPPH清除能力,所有菌株的DPPH清除率都在70%以上。其中,CCFM137、CCFM8、CCFM620具有较强的清除能力,而CCFM237、CCFM381表现出较低的DPPH清除率。同时,研究也发现在菌株种间和种内也存在着一定的差异。其中,CCFM381、CCFM424、CCFM620都属于发酵乳杆菌,但存在明显的种内差异(p<0.05);CCFM137、CCFM6、CCFM8这3株嗜酸乳杆菌的DPPH自由基清除率明显高于CCFM469,CCFM237和CCFM310这3株鼠李糖乳杆菌,表现出一定的种间差异。此研究结果与Sharma,P. K[13]等的研究结果是一致的,Sharma,P. K等发现4种乳酸菌菌株LB06,LBS3,LB02 和 LBS1的DPPH清除率均有差异,这种差异可能是由不同菌株中起到抗氧化作用的活性物质种类或浓度不同造成的。

图1 乳酸菌无细胞提取物的DPPH清除率Fig.1 DPPH radical scavenging activity of cell free extracts of lactobacilli注:图中 a,b,c,d,e 表示不同编号菌株具有显著性差异(p<0.05),含有相同字母表示没有显著差异(p>0.05),图2、图3同。
2.2 清除羟自由基能力
羟自由基是体内氧化性很强的自由基,会造成大分子损伤,因此清除羟自由基的能力也是反映抗氧化能力的重要指标。测定乳酸菌无细胞提取物的清除羟自由基能力的实验原理是芬顿反应[14-15]。目前芬顿反应体系已经成为评价抗氧化能力高低的一种方法[5]。
本研究测定了不同乳酸菌无细胞提取物对芬顿反应形成的羟自由基的清除能力,实验结果如图2所示。所有菌株都表现出一定的羟自由基清除能力,清除能力在16.48%±0.15%~48.30%±0.83%范围内。其中CCFM137、CCFM8、CCFM620表现出较强的羟自由基清除能力,而CCFM381表现出最低的还原能力。类似于DPPH清除率,菌株的羟自由基清除能力也表现出了种间和种内差异。CCFM238、CCFM239均属于植物乳杆菌,CCFM381、CCFM424、CCFM620均属于发酵乳杆菌,羟自由基清除能力存在明显的种内差异;而干酪乳杆菌CCFM9、CCFM5、CCFM30与植物乳杆菌CCFM238、CCFM239相比,羟自由基清除能力有显著的种间差异。干酪乳杆菌CCFM9、CCFM5、CCFM30与嗜酸乳杆菌CCFM469、CCFM237、CCFM310又存在明显的种间差异。
本研究与刘洋等[16]进行的实验结果相比较,17株乳酸菌无细胞提取物的羟自由基清除率都高于发酵乳杆菌、乳酸乳球菌、嗜酸乳杆菌、瑞士乳杆菌这4 株乳酸菌的无细胞提取物,即这17株乳酸菌无细胞提取物清除羟自由基方面体现出来的抗氧化能力均优于以上4株乳酸菌。
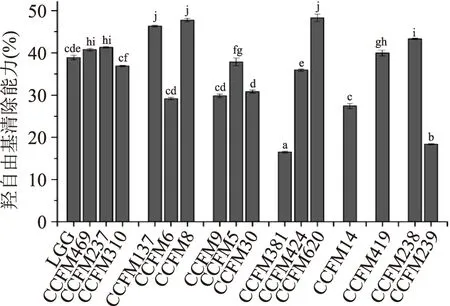
图2 乳酸菌无细胞提取物的羟自由基清除能力Fig.2 Hydroxyl radical scavenging activity of cell free extracts of lactobacilli

表2 3种抗氧化活性测定方法之间的相关性
注:*p<0.05;**p<0.01。
2.3 还原能力
前人研究表明抗氧化能力与还原能力是直接相关的[17-18]。如图3所示,17株菌的无细胞提取物的还原能力的测定结果均显示乳酸菌均具有一定的还原能力。其中CCFM8表现出较强的还原能力;而CCFM381表现出最低的还原能力。除了阳性对照LGG所在的鼠李糖乳杆菌之外,其余6个种属均表现出种内差异;干酪乳杆菌CCFM 9、CCFM5、CCFM30与嗜酸乳杆菌CCFM137、CCFM6、CCFM8又存在明显的种间差异。这个结果与LiuC等[4]的研究是一致的,该研究指出12株菌株有不同的还原能力,其中L.acidophilusBCRC 14079是B.infantisBCRC 14602还原能力的6倍。
刘洋[14]等对4株乳酸菌的细胞提取物进行了研究,均未发现具有还原能力,而刘宏宇[19]等研究发现,测定的25株乳酸菌均表现出一定的还原能力,活性范围在4.3~322.58 μmol/L之间。本研究测定的17株菌株的无细胞提取物还原力范围在(12.31±0.69)~(134.19±0.45)μmol/L之间,表明本研究采用的乳酸菌菌株有一定的还原能力。

图3 乳酸菌无细胞提取物的还原能力Fig.3 Reducing power of cell free extracts of lactobacilli
2.4 相关性分析
3种不同的化学方法测定结果表明本研究中的不同乳酸菌无细胞提取物有一定的抗氧化能力,其中CCFM8表现出最强的抗氧化能力,CCFM381抗氧化水平最低。Zhu[17]等研究发现豆渣和豆腐的水提物通过不同的化学方法检测,表现出了不同的抗氧化水平。本研究通过比较3种化学方法的相关性,发现3种体外方法具有显著的相关性。这与王妍等[20]的研究结果是一致的,王妍等用DPPH羟自由基清除率、超氧自由基清除率和还原能力测定了3种浆果花色苷的抗氧化活性,研究发现3种化学方法具有显著相关性。因此,通过体外测定乳酸菌无细胞提取物的抗氧化活性,可以首选这3种方法,但是考虑到这3种化学方法的机理不同[21],因此,使用单一的化学方法来筛选高抗氧化活性的乳酸菌菌株有一定局限性。
2.5 SOD,POD,GSH-PX活性
研究表明SOD,CAT和GSH-Px是机体抵御氧化损伤的第一道屏障[21]。基于3种化学方法综合评价CCFM8的抗氧化活性最强,CCFM381的抗氧化能力最弱。本研究进一步比较这2株菌株无细胞提取物的抗氧化物酶SOD,CAT和GSH-Px水平。由表3可见,2株菌株均含有SOD、CAT和GSH-Px活性,2株菌株的SOD活性高于GSH-PX活性,2株菌株的CAT活性最低,且CCFM8的3个指标均高于CCFM381的3个指标,该结果与之前3种化学方法得到的抗氧化能力综合评价具有较好的相关性。

表3 2株菌株的抗氧化酶活性
注:图中a,b表示不同编号菌株具有显著性差异(p<0.05),含有相同字母表示没有显著差异(p>0.05),显著性分析是同行之间比较。
3 结论
乳酸菌抗氧化活性一直是乳酸菌研究的热点,以往的研究更多关注某一类或者几株菌株的抗氧化活性[16,22],而本研究中使用了来自于7个种属(L.rhamnosus,L.acidophilus,L.casei,L.fermenti,L.reuteri,L.farciminis,L.plantarum)的17株乳酸菌,通过3种化学方法系统的评价了乳酸菌无细胞提取物的抗氧化活性,并且分析了3种体外化学方法的相关性。结果显示,17株乳酸菌无细胞提取物均具有抗氧化活性,CCFM8表现出最强的抗氧化活性,CCFM381的抗氧化活性最低。进一步检测了以上2株菌株无细胞提取物的抗氧化物酶SOD、GSH-PX和CAT的活性。与3种化学方法综合评价的结果一致,CCFM8的3种抗氧化物酶活性显著高于CCFM381的抗氧化物酶活性。本研究结果表明,DPPH清除率、羟自由基清除率以及还原力这3种化学测定方法所得结果之间具备较高的相关性。但是鉴于不同化学测定方法的原理有所不同,为了能够更客观更全面的分析乳酸菌的抗氧化活性,在通过化学方法筛选高抗氧化活性的乳酸菌方面,还需要以多种化学测定方法进行综合评价。
[1]Halliwell B,Gutteridge J(1985)Free radicals in biology and medicine:Oxford Clarendon Press. 23-30..
[2]Sies H. Strategies of Antioxidant Defense[J]. European Journal of Biochemistry,1993,215(2):213-219.
[3]Velioglu YS,Mazza G,Gao L,et al. Antioxidant activity and total phenolics in selected fruits,vegetables,and grain products[J]. Journal of Agricultural and Food Chemistry,1998,46(10):4113-4117.
[4]Liu C,Pan T.InVitroEffects of Lactic Acid Bacteria on Cancer Cell Viability and Antioxidant Activity[J]. Journal of Food and Drug Analysis,2010,18(2):77-86.
[5]王刚,田丰伟,刘小鸣,等. 2株具有优良体外抗氧化能力乳酸菌的筛选与鉴定[J]. 食品工业科技,2013,(15):149-153,157.
[6]张天博,宁喜斌. 乳酸菌对自由基清除能力的研究[J]. 中国乳品工业,2007(4):10-12,19.
[7]Lin M-Y,Yen C-L. Antioxidative Ability of Lactic Acid Bacteria[J]. Journal of Agricultural and Food Chemistry,1999,47:1460-1466.
[8]Xing J,Wang G,Zhang Q,et al. Determining antioxidant activities of lactobacilli cell-free supernatants by cellular antioxidant assay:A comparison with traditional methods[J]. Plos One,2015,10(3).
[9]王玉华,高晶,陈萍,等. 鼠李糖乳杆菌不同组分抗氧化活性的研究[J]. 食品科技,2011(9):27-31.
[10]Lin M,Chang F. Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 and Lactobacillus acidophilus ATCC 4356[J]. Digestive diseases and sciences,2000,45(8):1617-1622.
[11]Zhang S,Liu L,Su Y,et al. Antioxidative activity of lactic acid bacteria in yogurt[J]. African Journal of Microbiology Research,2011,5(29):5194-5201.
[12]Shen Q,Shang N,Li P.Invitroandinvivoantioxidant activity of Bifidobacterium animalis 01 isolated from centenarians[J]. Current Microbiology,2011,62(4):1097-1103.
[13]Sharma PK,Rajdeep R,Mythili S,et al. Study of probiotic and antioxidant activity of Lactobacillus spp[J]. Research Journal of Pharmaceutical,Biological and Chemical Sciences,2013,4(4):809-819.
[14]李志英,张海容,梁会艳. 5种葡萄酒清除羟自由基的比较[J]. 酿酒科技,2006(4):26-28.
[15]Teismann P,Ferger B. The salicylate hydroxylation assay to measure hydroxyl free radicals induced by local application of glutamateinvivoor induced by the Fenton reactioninvitro[J]. Brain Research Protocols,2000,5:204-210.
[16]刘洋,郭宇星,潘道东. 4种乳酸菌体外抗氧化能力的比较研究[J]. 食品科学,2012,(11):25-29.
[17]Zhu YP,Fan JF,Cheng YQ,et al. Improvement of the antioxidant activity of Chinese traditional fermented okara(Meitauza)using Bacillus subtilis B2[J]. Food Control,2008,19(7):654-661.
[18]Meir S,Kanner J,Akiri B,et al. Determination and Involvement of Aqueous Reducing Compounds in Oxidative Defense Systems of Various Senescing Leaves[J]. Journal of Agricultural and Food Chemistry,1995,43(7):1813-1819.
[19]刘宏宇,汪立平,艾连中,等. 乳酸菌的抗氧化活性和耐酸耐胆盐性能的研究[J]. 食品工业科技,2014(2):92-96,99.
[20]王妍. 3种野生浆果花色苷体外抗氧化活性的相关性研究[J]. 防护林科技,2013(2):23-26,29.

[22]韩伟,刘文群,黄丽婵,等. 5株微生物抗氧化作用的初步研究[J]. 食品与机械,2008(5):45-47,51.
A comparison of severalinvitroevaluation methods of lactobacillus cell-free extract antioxidant activity
GU Pin-pin1,XING Jia-li1,WANG Gang1,*,ZHANG Qiu-xiang1,YIN Bo-xing3,FANG Dong-sheng3,ZHANG Hao1,CHEN Wei1,2,*
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;3.Kangyuan Dairy Co.,Ltd.,Yangzhou University,Yangzhou 225004,China)
The antioxidant activity of lactic acid bacteria and their role in promoting human health are closely related. In this study,3 classic chemical antioxidant capacity evaluation indicatorsinvitrosuch as DPPH radical scavenging activity,hydroxyl radical scavenging activity and reduction activity were engaged to evaluate the antioxidant capacity of cell-free extract of 17 lactic acid bacteria from different sources. The results showed the presence of interspecific and intraspecific differences among the cell-free extract antioxidant activity of lactic acid bacteria from different sources. Significant correlation was found among the results got with 3 chemical evaluation indicators. All 3 chemical evaluation showedLactobacillusacidophilusCCFM 8 had the highest antioxidant activity,whileL.fermentumCCFM381 had the weakest antioxidant activity. Further evaluation results of antioxidase activity of lactobacillus cell-free extract showed perfect consistency with that got with comprehensive evaluation of 3 chemical evaluation indicators. This study provided a reliable reference for comprehensive evaluation of the anti-oxidation ability of lactic acid bacteria andinvitroscreening of lactic acid bacteria with high antioxidant activity.
lactobacilli;antioxidant;free radical;antioxidase
2015-03-23
顾品品(1994-),女,本科,研究方向:食品科学,E-mail:583695062@qq.com。
*通讯作者:王刚(1980-),男,博士,副教授,研究方向:食品生物技术,E-mail:wanggang@jiangnan.edu.cn。 陈卫(1966-),男,博士,教授,研究方向:食品生物技术,E-mail:chenwei66@jiangnan.edu.cn。
国家自然科学基金-青年科学基金项目(31301407)。
TS201.3
A
1002-0306(2015)23-0084-05
10.13386/j.issn1002-0306.2015.23.009
