采后蓝莓果实表面病原菌的分离鉴定及PCR检测
2015-05-05姜爱丽胡文忠何煜波
白 雪,姜爱丽,*,胡文忠,何煜波,冯 可
(1.大连民族大学生命科学学院,辽宁大连 116600;2.大连理工大学生命科学与技术学院,辽宁大连 116024)
采后蓝莓果实表面病原菌的分离鉴定及PCR检测
白 雪1,姜爱丽1,*,胡文忠1,何煜波1,冯 可2
(1.大连民族大学生命科学学院,辽宁大连 116600;2.大连理工大学生命科学与技术学院,辽宁大连 116024)
以采后贮藏过程中自然腐败变质的蓝莓果实为材料,采用传统纯培养法和平板划线法对蓝莓果实表面致腐优势菌进行了分离与形态学鉴定,最终确定葡萄孢霉(Botrytiscinema)为主要病原菌。采用基因组DNA提取试剂盒法提取葡萄孢霉的DNA,并筛选具有特异性的引物,通过聚合酶链式反应(PCR)对葡萄孢霉特定的DNA片段进行扩增,得到具有特异性的目的基因,对其进行分子生物学的特异性鉴定,并对其检测条件进行优化。最终得到具有特异性的引物序列为BcF-TGTAATTTCAATGTGCAGAATCC;BcR-TTGAAATGCGATTAATTGTTGC,最适的扩增引物浓度为0.25 μmol/L,PCR扩增的最适退火温度为 60 ℃。该方法可有效提高蓝莓病原菌的检测效率,可将其应用于实践中,为蓝莓的贮藏保鲜提供理论依据和技术指导。
蓝莓,病原菌,葡萄孢霉,PCR检测,分离鉴定
蓝莓甜酸适口,营养成分丰富,是世界粮农组织推荐的五大健康水果之一,其富含熊果甙、花青素等其他果品中少有的营养成分,果实制品具有延缓老化[1]提高抵御DNA损伤[2],解除眼睛疲劳并提高视力,增强心脏功能[3]等多方面的功效。
蓝莓贮藏过程中的腐烂现象一直是制约蓝莓产业发展的主要问题,而蓝莓果实病原菌的侵染又是导致其腐烂的最主要原因。目前,相关蓝莓病原菌的研究大都是对其主要病原菌进行了形态学的初步分类与鉴定,而对其病原菌进行特异性分子生物学鉴定的研究很少。葡萄孢霉(Botrytis cinema)又称灰霉菌[4],是危害花卉、水果、蔬菜等多种经济作物的优势病原菌,经Hahn等[5]和陈长卿等[6]研究发现引起采后蓝莓腐败变质的主要病原菌是葡萄孢霉,冯璐等[7]和Sanzani等[8]也采用传统的方法对葡萄孢霉进行了形态学的初步分离与鉴定,但并未对其进行分子生物学层面的鉴定。
大连地区是栽培蓝莓的主产区,近年来鲜食蓝莓的产量逐年上升。尽管Hahn等[5]和陈长卿等[6]研究发现引起采后蓝莓腐败变质的主要病原菌是葡萄孢霉,但大连地区主栽蓝莓品种的病原菌种类和防治方法未见相关报道。鉴于此,本研究不仅对引起大连地区鲜食蓝莓主栽品种腐败变质的病原菌进行了分离,还对其进行初步的形态学鉴定,分离到葡萄孢霉为主要病原菌。而且对葡萄孢霉的特异性进行鉴定,并进一步对其PCR鉴定条件进行优化,确保得到更清晰快速的检测结果,为蓝莓采后保鲜及病原菌的检测提供依据。
1 材料与方法
1.1 材料与仪器
蓝莓果实 大连南北蓝莓科技发展有限公司蓝莓园,500 g为一个样本,取10个样本。采后立即运到实验室,4 ℃贮藏备用。葡萄糖,琼脂粉 国产分析纯;DNA植物kit基因组织提取试剂盒 宝生物工程(大连)有限公司。
DYY-11型电泳仪电源、DYCP-31F型电泳仪 北京市六一仪器厂;TC-512型PCR仪 Techne公司;BioSpectrum 310凝胶成像系统 美国UVP公司;BR4i型台式高速冷冻离心机 法国Jouan公司;超净工作台2HJH-C2112B 上海智城分析仪器制造有限公司。
依据Celik M[9]、Gachon C[10]的研究,实验所需两对引物由宝生物工程(大连)有限公司设计合成,配对引物序列:BcF-TGTAATTTCAATGTGCAGAATCC;BcR-TTGAAATGCGATTAATTGTTGC;FHel81-AC AGACTTTGGGCACATTCC,RHel82-TGTAATTTCAA TGTGCAGAATCC。
1.2 实验方法
1.2.1 病原菌分离纯化 用混菌法分离病原菌,制成10-1、10-2、10-3、10-4、10-5CFU/mL各个梯度稀释的菌液,放置恒温培养箱中培养。待菌落长出,用平板划线法,连续培养3~5次,使其在培养基上出现单菌落,从而达到对蓝莓表面病原菌进行分离纯化的目的[11]。
1.2.2 回接实验 将分离纯化得到的病原菌回接到无病虫害的新鲜蓝莓上,参照范青等[12]的方法:将新鲜、无病害、无机械伤的蓝莓用酒精消毒,晾干后,用灭菌铁钉在每个果实腰部刺孔(3 mm深×3 mm宽),在孔内接种一定浓度(3×106CFU/mL,0.1 mL)的菌液,将接种后果实放入经紫外灯照射30 min的塑料托盘中,薄膜包装后放在25 ℃下保湿培养,定期观察发病状态。
1.2.3 病原菌DNA的提取 用宝生物工程(大连)有限公司提取试剂盒提取。
1.2.4 引物筛选 在体系中分别加入两种引物,在各自所需条件下进行PCR反应,观察结果。
1.2.5 PCR反应体系中引物浓度优化 选取已经筛选成功的PCR反应的特异性引物,作为工作液。PCR体系主要包括:每50 μL PCR反应液中Ex Taq酶(5 U/μL)0.3 μL,10×Ex Taq Buffer(Mg2+Free)5 μL,MgCl2(25 mmol/L)的加入量为4 μL,dNTP Mixture(2.5 mmol/L)的加入量是4 μL,模板DNA溶液的加入量是3 μL,筛选出的具有特异性的上下游引物,依据先前致腐菌PCR实验的研究比对,采用较为合适的实验方法[13],引物浓度分别为1,0.4,0.25,0.2,0.15 μmol/L。上下游引物添加量分别为1 μL,将剩余体系体积用双蒸水补足。反应条件为:预变性温度95 ℃,时间持续2 min;变性的温度是94 ℃,时间15 s,60 ℃退火15 s,整个过程重复35次,延伸温度是72 ℃,时间10 min,产物4 ℃保存[14-15]。
1.2.6 PCR反应体系中退火温度的优化 选取已经筛选成功的PCR反应特异性引物,按照优化后的引物浓度,每50 μL PCR反应体系中加入 Ex Taq 酶(5 U/uL)0.3 μL,10×Ex Taq Buffer(Mg2+Free)5 μL,MgCl2(25 mmol/L)的加入量为4 μL,dNTP Mixture(2.5 mmol/L)的加入量是4 μL,模板DNA溶液的加入量是3 μL,上下游引物各1 μL,将剩余体积用双蒸水补足。反应条件为:预变性温度95 ℃,时间持续2 min;变性的温度是94 ℃,时间15 s,退火温度53 ℃[16-17],并设置梯度退火实验,55、60、65 ℃进行退火温度优化实验,退火时间15 s,整个过程重复35个循环,延伸温度是72 ℃,时间10 min,产物4 ℃保存[18]。
1.2.7 PCR产物电泳分析 PCR体系反应结束后,从获得的体系中分别取出体积为10 μL的PCR产物,并将0.5 g琼脂糖粉末倒入50 mL的TAE缓冲液中,同时加入GelRed染料,煮开两次,得到浓度为1%的胶版,将电泳条件设定为电压U=95 V,电流I=400 mA,时间T=1 h,整个电泳过程结束后,经凝胶成像分析系统成像。
2 结果与分析
2.1 菌落分离纯化结果
按梯度稀释法获得的结果,通过平板划线法得到单菌落,培养后仅得到一种优势菌株,依据其培养基状态特征,判断其类别,并采用插片鉴定法[19]进行形态鉴定。
分离到的病原菌在PDA培养基上的菌落形态(图1):菌落呈绒状,菌丝体初为白色,后形成灰色霉层,而显微镜下观察到孢子梗顶端不膨大,排列成帚状的间枝,分生孢子串呈不分枝的链状(图2)。

图1 病原菌在培养基状态Fig.1 Pathogens on PDA

图2 病原菌在显微镜下状态Fig.2 Pathogens in the microscope
通过与真菌鉴定手册[20]所描述的形态比对,发现此真菌菌落特征与葡萄孢霉的特点相符,初步判定是葡萄孢霉。
2.2 回接实验结果
回接实验证明,病原菌对蓝莓果实具有很强的致病性,基本确定其为葡萄孢霉。

图3 病原菌回接实验Fig.3 Pathogen infection experiment
2.3 PCR引物筛选结果
由图4反应结果可知,特异性引物BcF-TGTAA TTTCAATGTGCAGAATCC;BcR-TGAAATGCGATTAA TTGTTGC扩增出特定的大小为90 bp的目的基因;FHel81-ACAGACTTTGGGCACATTCC,RHel82-TGTAATTTCAATGTGCAGAATCC未获得特异性的PCR产物,所以引物BcR/BcF具有特异性,BcR/BcF这一对特异性引物可以作为进一步实验的反应引物。
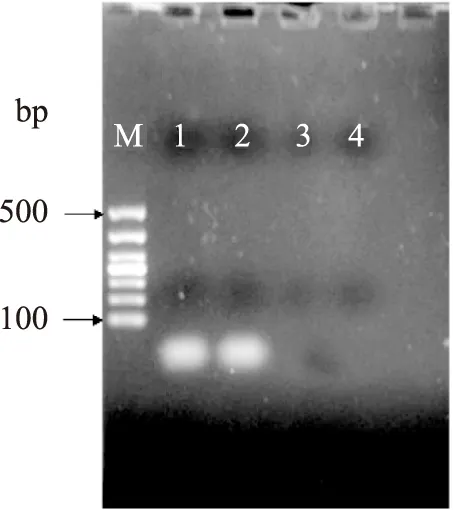
图4 PCR引物筛选结果Fig.4 The different primer of PCR amplification products注:M:Maker500;1~2:BcR/BcF引物扩增产物结果;3~4:FHel81/FHel82引物扩增产物结果。

图5 相对迁移率与目的基因对数相关性关系Fig.5 Relationship between relative mobility and genes size
由于目的基因太小,没有小于100 bp的maker与之匹配,所以通过相对迁移率标准曲线来验证所获得的目的基因的大小。通过标准曲线的对比,得到目的基因的大小为90 bp。
2.4 PCR引物浓度优化结果
引物浓度为1 μmol/L和0.4 μmol/L的PCR反应结果类似,几乎看不到目的基因,引物浓度为0.2 μmol/L和0.15 μmol/L的PCR反应结果类似,目的基因不太清晰。实验中引物浓度为0.25 μmol/L的PCR反应结果较为清晰,特异性更强,这一体系添加标准可以被用于继续的实验中。
图6~图8分别是引物浓度为0.4,0.2,0.25 μmol/L的PCR反应结果。

图6 PCR引物浓度为0.4 μmol/L的结果Fig.6 PCR results of Primer diluted to 1 μmol/L注:M:Marker500;1~3:扩增结果,图7、图8同。

图7 PCR引物浓度稀释为0.2 μmol/L的结果Fig.7 PCR results of Primer diluted to 0.2 μmol/L

图8 PCR引物浓度稀释为0.25 μmol/L的结果Fig.8 PCR results of Primer diluted to 0.25 μmol/L
2.5 PCR退火温度优化结果
图9是退火温度为53 ℃的PCR反应结果,图10是退火温度为55、60、65 ℃的梯度退火PCR反应结果,图9几乎看不到特异性引物BcR/BcF扩增出的目的基因。图10中可以看出最合适的退火温度为60 ℃。

图9 PCR退火温度为53 ℃的结果Fig.9 Annealing temperature 53 ℃ results注:M:Maker500;1~3:53 ℃结果。

图10 PCR梯度退火的结果Fig.10 Annealing temperature result注:M:Maker500;1~3:60 ℃,4~6:65 ℃,7~9:55 ℃。
3 结论与讨论
果实成熟后感染葡萄孢霉会导致其在运输和贮藏过程中大量腐烂,严重影响其采后保鲜。对于蓝莓而言,从源头发现染病果实并及时挑选处理对减少其贮藏损失尤为重要。本实验分离筛选出的引起采后蓝莓腐败变质的主要病原菌为葡萄孢霉,采用PCR技术对葡萄孢霉进行了特异性分子生物学鉴定,并对其鉴定条件及操作方法进行了优化实验,得到最具特异性的引物序列为BcF-TGTAATTTC AATGTGCAGAATCC;BcR-TTGAAATGCGATTAA TTGTTGC,最合适的引物浓度为0.25 μmol/L,最合适的退火温度为60 ℃。
本研究利用了PCR技术,建立了一种敏感准确的检测方法,利用PCR技术对蓝莓表面病原菌进行检测,可以使其病原菌DNA得以迅速扩增,灵敏度高、省时有针对性,利用在实际中可以大大提高检测的效率及准确率,本方法为今后蓝莓采后贮藏提供技术支持和理论基础,具有较好的应用前景。
[1]Krikorian R,Shidler M D,Nash T A,et al. Blueberry Supplementation Improves Memory in Older Adults[J]. Journal of agricultural and food chemistry,2010,58(7):3996-4000.
[2]Del Bo C,Riso P,Campolo J,et al. A single portion of blueberry(Vaccinium corymbosum L)improves protection against DNA damage but not vascular function in healthy male volunteers[J].Nutrition Research,2013,33(3):220-227.
[3]王姗姗,孙爱东,李淑燕. 蓝莓的保健功能及其开发应用[J].中国食物与营养,2010(6):17-20.
[4]Leroch M,Plesken C,Weber R W S,et al. Gray mold populations in German strawberry fields are resistant to multiple fungicides and dominated by a novel clade closely related to Botrytis cinerea[J]. Applied and Environmental Microbiology,2013,79(1):159-167.
[5]Hahn M,Viaud M,van Kan J. The genome of Botrytis cinerea,a ubiquitous broad host range necrotroph[M]. Genomics of Plant-Associated Fungi and Oomycetes:Dicot Pathogens[J]. Springer Berlin Heidelberg,2014:19-44.
[6]陈长卿,张博,杨丽娜,等.越橘灰霉病病原菌鉴定及其生物学特性研究[J].吉林农业大学学报,2012,34(5):511-516.
[7]冯璐,栾雨时,范永强,等. 越橘叶斑病病原菌的鉴定[J]. 东北农业大学学报,2007,38(5):614-618.
[8]Sanzani S M,Schena L,De Cicco V,et al. Early detection of Botrytis cinerea latent infections as a tool to improve postharvest quality of table grapes[J]. Postharvest Biology and Technology,2012,68(6):64-71.
[9]Celik M,Kalpulov T,Zutahy Y,et al. Quantitative and qualitative analysis of Botrytis inoculated on table grapes by qPCR and antibodies[J]. Postharvest biology and technology,2009,52(2):235-239.
[10]Gachon C,Saindrenan P. Real-time PCR monitoring of fungal development in Arabidopsis thaliana infected by Alternaria brassicicola and Botrytis cinerea[J]. Plant Physiology and Biochemistry,2004,42(5):367-371.
[11]杨文博. 微生物学实验[C]. 北京:化学工业出版,2004.
[12]范青,田世平,徐勇,等.季也蒙假丝酵母(Candida guilliermondii)对采后桃果实软腐病(Rhizopus stolonifer)的抑制效果[J].植物学报,2000,42(10):1033-1038.
[13]Le Drean G,Mounier J,Vasseur V,et al. Quantification of Penicillium camemberti and P.roqueforti mycelium by real-time PCR to assess their growth dynamics during ripening cheese[J]. International Journal of Food Microbiology,2010,138(1):100-107.
[14]Song J Y,Lim J H,Nam M H,et al. Development of PCR Primers for Specific Identification and Detection of Botrytis cinerea on Tomato[J]. The Korean Journal of Mycology,2008(2):138-143.
[15]周晓云,游春平.红掌根腐病病原鉴定及其PCR检测方法[J].园艺学报,2013,40(5):989-996.
[16]Dunne K J,Evans K J,et al. Optimization of techniques for quantification of Botrytis cinerea in grape berries and receptacles by quantitative polymerase chain reaction[J]. Australian Journal of Grape and Wine Research,2013,19(1):68-73.
[17]Suarez M B,Walsh K,Boonham N,et al. Development of real-time PCR(TaqMan®)assays for the detection and quantification of Botrytis cinerea in planta[J]. Plant Physiology and Biochemistry,2005,43(9):890-899.
[18]Ahmed Z. Optimization of PCR conditionsinvitrofor maximum amplification of DNA from xanthomonas campestris 13551[J]. Journal of Applied Sciences Research,2006,2(3):112-122.
[19]陈辉,沈广宇,毛雄英.PCR热循环模式的一个重要改进慢退火PCR[C].中国的遗传学研究-中国遗传学会第七次代表大会暨学术讨论会论文摘要汇编,2003.
[20]魏景超. 真菌鉴定手册[M].上海:科学技术出版社,1995.
Study on the optimization of PCR detection conditions for pathogen isolated from the postharvest blueberry surface
BAI Xue1,JIANG Ai-li1,*,HU Wen-zhong1,HE Yu-bo1,FENG Ke2
(1.College of Life Science,Dalian Nationalities University,Dalian 116600,China;2.College of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024,China)
The main pathogens were separated and identified from the rotting postharvest blueberry fruits using traditional pure culture method and plate streaking method. The results showed that the main pathogen wasBotrytiscinerea. In order to identifyBotrytiscinereawith PCR method and found its best experimental conditions,the Genomic DNA was extracted and the target gene was screened with specific primers. The optimum PCR experimental condition was as following:the primer sequences were BcF-TGTAATTTCAATGTGCAGAATCC and BcR-TTGAAATGCGATTAATT GTTGC,the best amplification primer concentration was 0.25 μmol/L,the optimal annealing temperature was 60 ℃. This PCR method could effectively improve the detection efficiency of blueberry pathogens. Moreover,it helped to set up a theoretical basis and technical guidance for the preservation of blueberries in production.
blueberry;pathogen;Botrytiscinerea;PCR detection;isolation and identification
2015-03-27
白雪(1991-),女,本科,研究方向:食品科学,E-mail:597764245@qq.com。
*通讯作者:姜爱丽(1971-),女,博士,副教授,研究方向:食品科学,E-mail:jal@dlnu.edu.cn。
国家国际科技合作项目(2013DFA31450);国家科技支撑计划项目(2012BAD38B05)。
TS201.7
A
1002-0306(2015)23-0297-05
10.13386/j.issn1002-0306.2015.23.053
