紫山药粗多糖提取工艺的优化及其抗氧化性的研究
2015-05-05刘杭达马千苏程永强
刘杭达,马千苏,王 傑,周 韵,孙 璐,程永强
(植物源功能食品北京市重点实验室,中国农业大学食品科学与营养工程学院,北京 100083)
紫山药粗多糖提取工艺的优化及其抗氧化性的研究
刘杭达,马千苏,王 傑,周 韵,孙 璐,程永强*
(植物源功能食品北京市重点实验室,中国农业大学食品科学与营养工程学院,北京 100083)
本文紫山药粗多糖提取工艺的优化及抗氧化性的研究,以紫山药为研究材料,在单因素实验基础上,利用正交实验优化了紫山药粗多糖提取工艺,确定在料液比1∶15(mg/mL)、提取温度55 ℃、提取时间为2 h的条件下紫山药粗多糖得率最高达到2.58%±0.03%。分别利用DPPH,超氧自由基,EDTA,ABTS四种方法对提取的紫山药粗多糖进行了抗氧化实验。结果表明,在DPPH和ABTS实验中紫山药粗多糖对自由基有明显的清除效果,在DPPH实验中紫山药多糖浓度为2 mg/mL时清除率到达66.24%,在ABTS实验中紫山药浓度为24 mg/mL时清除率到达 69.50%,优于普通山药多糖。
紫山药,粗多糖,提取,抗氧化性能
山药是一种多年生缠绕草质藤本植物,含有多种保健功能及成分,现代研究表明山药具有降低血糖[1]、提高胃肠功能[2]、调节免疫系统[3]以及抗衰老[4]的作用。紫山药是近年来发现的一种药食同源的薯蓣科植物,属于紫红肉山药品种,研究表明紫山药中主要的活性成分多糖含量高于其他品种[5-6],具有较好的开发应用前景。经研究表明,因为多糖具有较高的抗氧化能力,使其具备卓越的医疗和保健功能,得到了广大科研人员关注及研究。目前大量的多糖产品已经逐步应用到医疗和保健领域,在保障人们健康上发挥着重要的作用。目前,关于山药多糖的研究较多,主要集中在提取分离技术[7],组成结构及其生物活性,部分研究发现粗多糖比纯多糖更具活性[8-9]。但是关于紫山药多糖的提取和抗氧化特性研究的报道还较少。因此,本文考察了在生产上常用的多糖的提取方法对紫山药粗多糖的提取得率的影响,利用正交实验对影响因素进行优化,并利用ABTS自由基清除活性、DPPH自由基清除、超氧自由基清除能力等实验对提取的粗多糖的抗氧化性进行评价,为紫山药多糖提取的工业化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜紫山药(紫玉淮山) 购于广州市方缘贸易有限公司,紫山药洗净后去皮、切片、真空冷冻干燥并粉碎[10],制备成粉在干燥箱内常温储存备用。
氯仿,正丁醇,活性炭,无水乙醇,3,5-二硝基水杨酸,三羟甲基氨基甲烷(Tris),焦性没食子酸,蕃红,十二水合磷酸氢二钠,二水合磷酸二氢钠,乙二胺四乙酸(EDTA),七水合硫酸亚铁,还原性铁粉,30%双氧水,盐酸,乙腈等(分析纯) 均购于中国国药集团;ABTS,Trolox等 购于Sigma 2 Aldrich公司。
电热恒温水浴锅(DZKW-D-2) 常州国华电器有限公司;CPA26P电子天平 赛多利斯;AdVantagePro台式冻干机 美国VirTis;TDL-5000B型离心机 上海安亭科学仪器厂;DHG-9030电热鼓风干燥箱 上海一恒科技有限公司;7200型可见分光光度计 尤尼柯(上海)有限公司。
1.2 实验方法
1.2.1 多糖提取工艺实验

1.2.1.2 多糖含量的测定 使用苯酚-硫酸法[10],用葡萄糖为标准物,在恒温25 ℃,在490 nm处测定标准物浓度与吸光度的对应关系,制备标准曲线。
1.2.1.3 换算因素及多糖质量分数测定 实验室精制紫山药多糖在60 ℃下干燥至恒重,精确称取多糖50 mg,用水溶解后定容到100 mL,摇匀做为多糖储备液。精确量取多糖储备液0.2 mL,加水至1 mL,按测定标准曲线同样的方法测其吸光度值。
查标准曲线得葡萄糖质量浓度,多糖质量分数(%)=W/m
其中:W为多糖质量(g),m为样品质量(g)。
1.2.2 单因素实验设计
1.2.2.1 提取温度对紫山药粗多糖提取率的影响 精确称取15 g紫山药粉,置于250 mL烧杯中,料液比为1∶10(mg/mL),分别在40、45、50、55、60 ℃五种情况下,提取3 h,每组实验3个平行,提取步骤同1.2.1.1。吸取1 mL提取的多糖溶液,将其装入10 mL的刻度试管中,用水定容至10 mL。再吸取1 mL进行苯酚-硫酸法比色测定。
1.2.2.2 提取时间对紫山药粗多糖提取率的影响 精确称取15 g紫山药粉,置于250 mL烧杯中,料液比为1∶10(mg/mL),在提取温度50 ℃下分别浸提1、2、3、4、5 h,每组实验3个平行,提取步骤同1.2.1.1。吸取1 mL提取的多糖溶液,将其装入10 mL的刻度试管中,用水定容至10 mL。再吸取1 mL进行苯酚-硫酸法比色测定。
1.2.2.3 料液比对紫山药粗多糖提取率的影响 精确称取15 g紫山药粉,置于不同大小中,在提取温度50 ℃、提取时间2 h条件下,分别采用料液比1∶5、1∶10、1∶15、1∶20、1∶25(mg/mL)五种不同浓度进行提取。每组实验3个平行,提取步骤同1.2.1.1。吸取1 mL提取的多糖溶液,将其装入10 mL的刻度试管中,用水定容至10 mL。再吸取1 mL进行苯酚-硫酸法比色测定。
1.2.2.4 提取次数对紫山药粗多糖得率的影响 精确称取15 g紫山药粉,置于250 mL 烧杯中,在提取温度50 ℃、提取时间2 h、料液比为1∶10(mg/mL)条件下,分别提取1次、2次、3次,每组实验3个平行,提取步骤同1.2.1.1。吸取1 mL提取的多糖溶液,将其装入10 mL的刻度试管中,用水定容至10 mL。再吸取1 mL进行苯酚-硫酸法比色测定。
1.2.2.5 紫山药粗多糖提取工艺优化 在单因素实验的基础上,进行L9(33)正交实验,优化提取工艺。L9(33)因素水平表如表1。

表1 因素水平表
1.3 紫山药粗多糖的抗氧化性实验
1.3.1 紫山药粗多糖对DPPH自由基的清除作用测定 用连续加液器快速在不同样品浓度1、2、3、4(mg/mL)中加入2.5 mL DPPH溶液,避光反应30 min后,用在517 nm下测定吸光值,并计算不同样品浓度下相应的抑制率大小。每种样品做3个平行,空白用5 mL蒸馏水代替样品溶液[8,11]。

式中:A空白为空白组的吸光值;A样品为样品组的吸光值;A对照为样品组的吸光值。
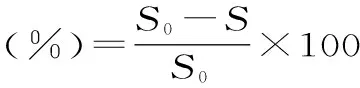
式中:S0-空白组的线性曲线斜率;S-样品组的线性曲线斜率。
1.3.3 测定紫山药粗多糖对羟自由基(·OH)的清除作用 按照表2数据制作反应体系,充分混匀,在37 ℃水浴锅中水浴30 min,在波长520 nm下测定吸光值,计算样品清除率。
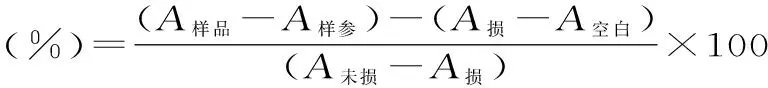
式中:A样品-样品管的吸光值;A样参-样品参照管的吸光值;A损-损伤管的吸光值;A未损-未损伤管的吸光值;A空白-空白管的吸光值[8,11]。
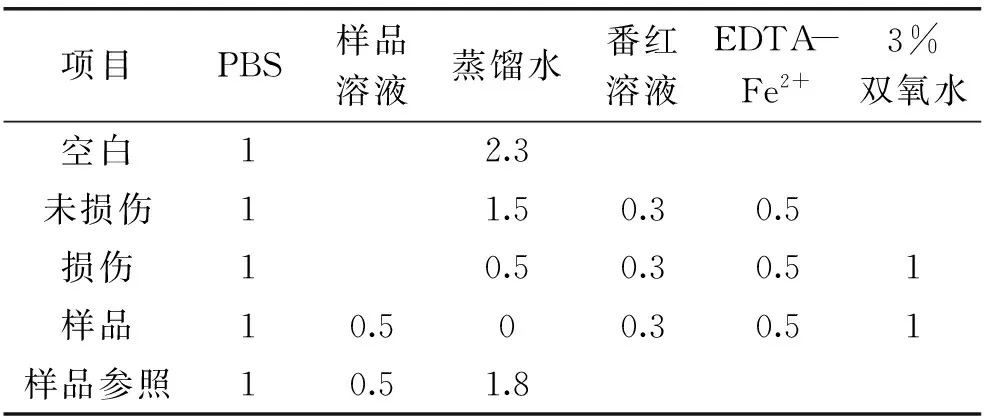
表2 反应体系
注:表中加样量均为mL。
1.3.4 用ABTS法测定紫山药粗多糖抗氧化性 取ABTS+自由基工作液4 mL置于10 mL具塞比色管中,分别加入80 μL的Trolox或样品溶液。均匀振荡10 s,30℃水浴反应6 min,测定其各自吸光度值,平行3组,取平均值计算清除能力[11-13]。
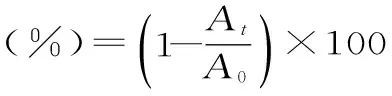
式中:At是水浴反应6 min后,测定反应混合液的吸光度;A0是ABTS+自由基工作液的吸光度值。
1.4 数据处理
实验数据利用Excel2003、Origin 8.0软件进行处理,所有实验都重复3次以上,结果以平均值表示。
2 结果与讨论
2.1 葡萄糖标准曲线与换算因素
实验制备葡萄糖标准曲线,得到回归曲线和直线方程,详见图1,A=0.164+5.270C(C:葡萄糖溶液浓度)相关系数r=0.9961。
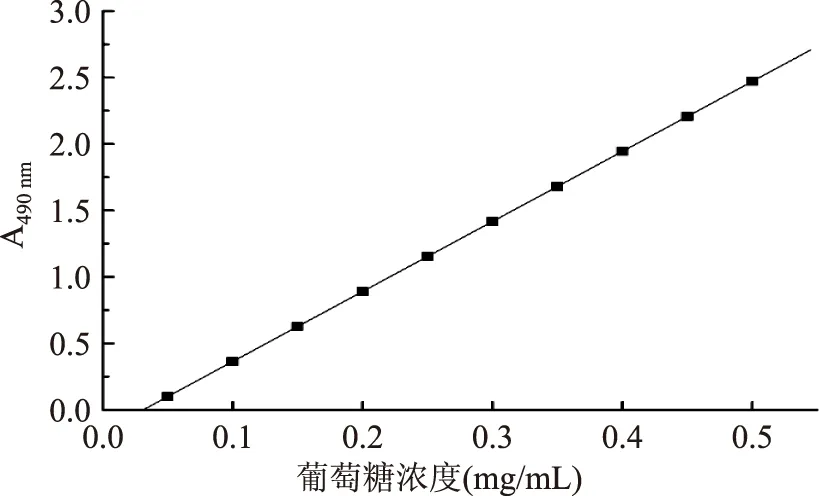
图1 葡萄糖标准曲线Fig.1 The standard curve of glucose determination
回归分析表明,在0.05~0.5 mg/L范围内葡萄糖的含量与吸收度值呈良好线性关系。
2.2 单因素实验分析
2.2.1 提取温度对紫山药粗多糖得率的影响 由图2可见,随着提取温度的升高,多糖得率逐渐增大。在50 ℃后,多糖得率变化不大。在55 ℃下,多糖得率略有下降。可能是随着提取温度的升高,紫山药多糖开始降解以及蛋白质逐渐溶出。考虑到经济成本和防止多糖在高温下遭受破坏丧失活性,提取温度不宜过高。
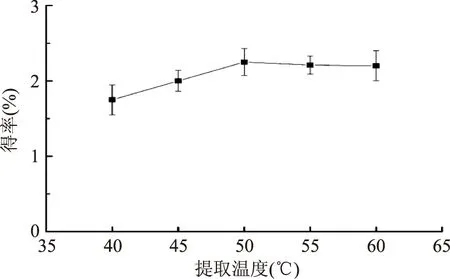
图2 提取温度对粗多糖得率的影响Fig.2 Effect of temperature on polysaccharide yield
2.2.2 提取时间对紫山药粗多糖提取量的影响 由图3可知,随着提取时间的延长,多糖得率不断上升,但在2 h后逐渐趋于平稳,上升趋势不明显。这可能是紫山药中大多数多糖已溶出达到平衡。考虑到经济成本和提取效果,选择提取时间为2 h较为合适。
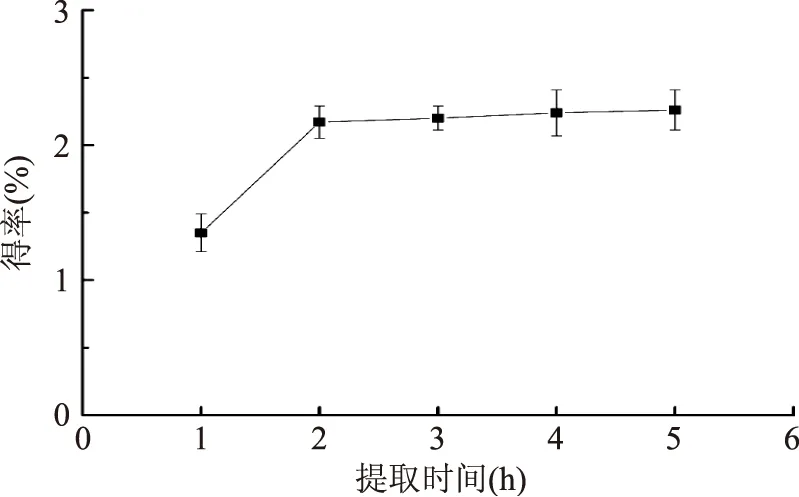
图3 提取时间对粗多糖得率的影响Fig.3 Effect of time on polysaccharide yield
2.2.3 料液比对紫山药粗多糖得率的影响 从图4可以看出,料液比的提高会增加多糖的得率,在料液比为1∶10以后上升趋于平稳;考虑到提高料液比会对后续的工艺增加能耗,所以选择料液比1∶10(g∶mL)较为合适。

图4 料液比对粗多糖得率的影响Fig.4 Effect of water-material ratio on polysaccharide yield
2.2.4 提取次数对紫山药粗多糖得率的影响 由图5可以看出,随提取次数的增加,多糖的得率也有所增加,但增加效果并不显著。故后续实验不再以提取次数作为正交实验的研究因素。
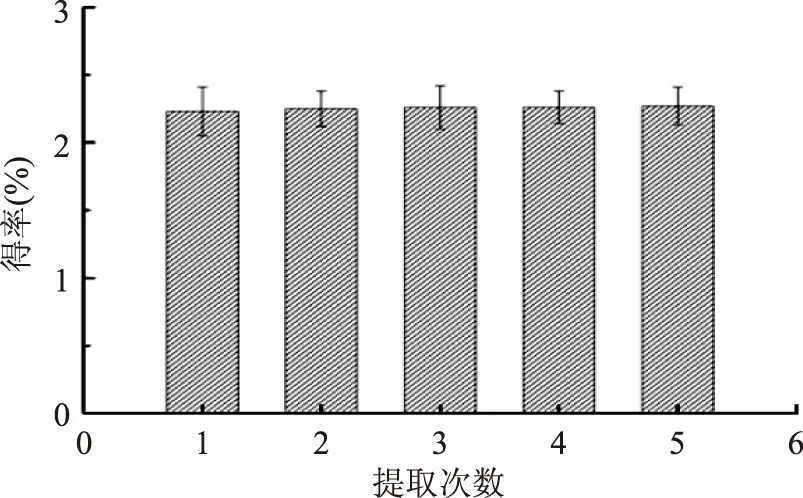
图5 提取次数对粗多糖得率的影响Fig.5 Effect of times on polysaccharide yield
2.3 紫山药粗多糖提取工艺条件的优化
在单因素实验的基础上,通过L9(33)正交实验对紫山药粗多糖提取工艺条件进行优化。实验结果和极差分析见表3。根据表3的极差R的大小,影响多糖得率的因素主次顺序为提取温度>料液比>提取时间。

表3 L9(33)正交实验表
通过正交实验数据方差分析(表4)表明:提取温度与料液比的差异较显著,通过F比数值表明提取温度、料液比对多糖提取得率影响显著,说明提取温度和料液比对紫山药粗多糖提取起主要作用,提取温度的影响要高于料液比。提取时间和提取次数对结果影响不显著。通过实验优化的最优提取工艺为为A3B3C3,即料液比1∶15、提取温度55 ℃、提取时间3 h。通过实验验证在此条件下紫山药多糖的得率为2.58%±0.03%。
2.4 紫山药粗多糖抗氧化性的研究
2.4.1 紫山药粗多糖浓度与清除DPPH自由基能力之间的关系 由图6可知,随着各个样品的浓度不断增加,各样品清除DPPH自由基的能力逐渐增强。在1 mg/mL的浓度时,去除花青素组清除率为34.48%,未去花青素组为41.46%。在浓度达到2 mg/mL后,所有样品的清除能力都趋于平稳且清除率达到峰值66.24%。从图上可以明显看出,去花青素组与未去花青素组的清除自由基的能力都低于Trolox,但由于花青素也是一种天然抗氧化剂[14],使得未去花青素组的自由基清除率要高于去除花青素组,进而提高了未去花青素组的抗氧化效果。
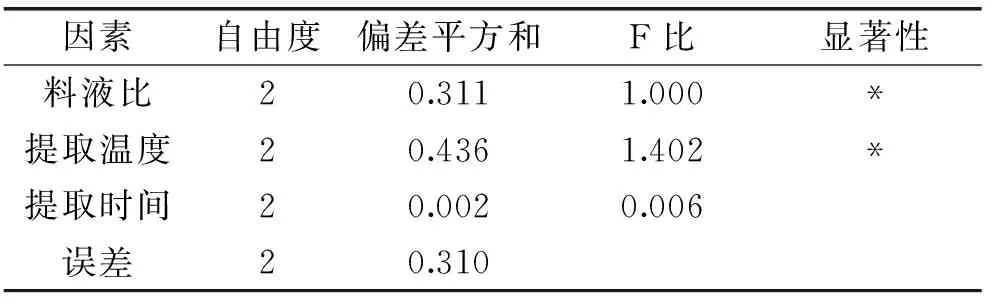
表4 正交实验方差分析表
注:*表示差异显著。

图6 紫山药粗多糖浓度对DPPH自由基清除能力的影响Fig.6 Effect of polysaccharide concentration on DPPH free radical scavenging
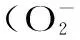
2.4.3 紫山药粗多糖与清除羟自由基能力之间的关系 由表6可以看出,在羟自由基清除实验中,紫山药粗多糖的浓度对羟自由基清除效果无显著影响,说明在实验条件下,紫山药粗多糖中的多糖成分无法与实验中的(·OH)有良好的反应,对其实验中所存的反应体系影响不大,在520 nm波长处吸光值无明显的变化,没有明显的清除作用。
2.4.4 ABTS法测定紫山药粗多糖的抗氧化性 由图7可知,相比于Trolox,在浓度达到6 mg/mL后,抗氧化能力趋于平稳。未去花青素组与去花青素组随着样品的浓度不断增加,样品的抗氧化能力逐渐增强,并在浓度达到24 mg/mL时清除率达到峰值69.50%。从图上也可以明显看出,在ABTS实验中,去花青素组与未去花青素组的清除自由基的能力都低于Trolox,但由于未去花青素组含有花青素成分,使其抗氧化效果要高于去除花青素组。
表5 紫山药粗多糖浓度对超氧自由基清除能力的影响
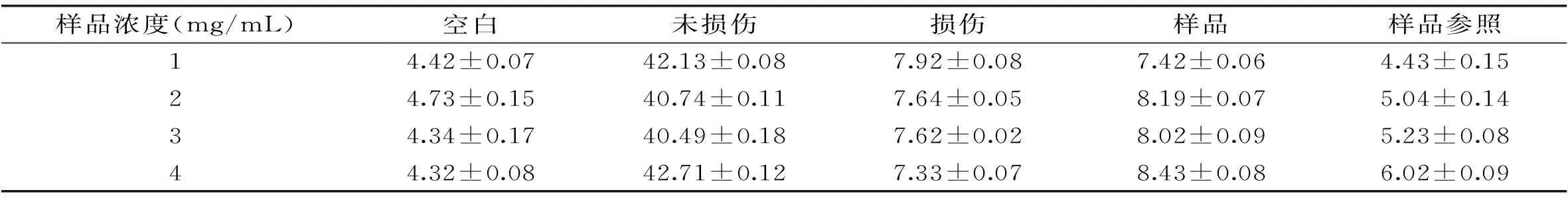
表6 紫山药粗多糖浓度对羟自由基清除能力的影响

图7 ABTS法测定紫山药粗多糖抗氧化性Fig.7 The antioxidations of purple yam polysaccharide by ABTS method
3 结论与讨论
本实验通过对紫山药粗多糖提取方法进行改进,提高了紫山药粗多糖的得率,综合考虑实验及未来工业化生产情况,最终确定提取紫山药粗多糖优化后的工艺为:料液比1∶15、提取温度55 ℃、提取时间为3 h,在此条件下粗多糖得率达到2.58%±0.03%。未来可以考虑用酶法、超声波的辅助手段进一步提高紫山药多糖的得率。
分别利用DPPH,超氧自由基,EDTA,ABTS四种方法对提取的紫山药粗多糖进行了抗氧化实验。经过实验结果的对比分析,紫山药粗多糖对DPPH和ABTS有明显的清除效果,并且在DPPH实验中多糖浓度在4 mg/mL、在ABTS实验中多糖浓度在25 mg/mL条件下对自由基的清除率在75.76%左右。未去花青素组由于含有花青素成分,使其抗氧化效果要高于去除花青素组。由于在多糖提取过程中大部分花青素被除去,所以未去花青素组中残留的花青素成分对紫山药粗多糖自由基清除能力的贡献有限,与去花青素组相比没有明显提高粗多糖的抗氧化能力,说明在粗多糖中起主要抗氧化作用的成分是紫山药多糖。在紫山药多糖对超氧自由基和羟自由基清除实验中并没有体现出多糖对自由基的良好清除效果。这可能说明DPPH和ABTS法能更好的检验紫山药多糖的抗氧化效果,同时应进一步从多糖的结构角度进行研究,探讨多糖结构对自由基清除作用的影响。在DPPH自由基清除实验中反应时间、光照强度、pH等因素会对实验结果有一些影响,造成粗多糖在不同实验条件下有不同的抗氧化活性[15]。若条件允许,未来可用高效液相色谱法、化学发光法等效率高且准确的实验方法研究紫山药多糖对抗氧化剂DPPH自由基清除的效果[16]。ABTS法操作简便、快捷,且结果重复性好,适合本实验紫山药多糖体外抗氧化性测定[13]。但是该方法TEAC值在反应条件不同时会产生不同的变动,只有待测物浓度达到一定范围值时才可以保持TEAC值相对稳定[17]。所以需要对实验进行预处理,找到相对稳定的样品实验浓度。
[1]朱明磊,唐微,官守涛.山药多糖对糖尿病小鼠降血糖作用的实验研究[J].现代预防医学,2010,37(8):1524-1527.
[2]傅紫琴,蔡宝昌,卞长霞,等.山药及其麸炒品的多糖成分对脾虚小鼠胃肠功能的影响[J].药学与临床研究,2008,16(3):181-183.
[3]赵国华,李志孝,陈宗道,等.山药多糖的免疫调节作用[J].营养学报,2002,24(4):187-188.
[4]詹彤,陶靖,王淑如.水溶性山药多糖对小鼠的抗衰老作用[J].药学进展,1999,23(6):356-360.
[5]于东,林跃伟,陈桂星,等.紫山药营养成分分析研究[J].营养学报,2010(2):190-192.
[6]王洪新,王远辉.山药多糖研究进展[J].食品与生物技术学报,2011,30(3):321-327.
[7]梁亦龙,阎光凡,舒坤贤,等.山药水溶性多糖的提取及抗氧化性研究[J].食品研究与开发,2007,28(11):1-3.
[8]何书英,詹彤,王淑如.山药水溶性多糖的化学及体外抗氧化活性[J].中国药科大学学报,1994,25(6):369-372.
[9]聂莹.酸降解法制备褐藻寡糖的功能性研究[D].北京:中国农业大学,2012.
[10]徐世忱,李广全,孙莹.北五味子粗多糖的提取与成分分析[J].吉林医药工业,1992(4):15-18.
[11]刘小兵,朴建华.几种生物活性物质体外抗氧化能力评价技术的研究[J].卫生研究,2009,38(3):280-283.
[12]檀子贞,王红育,吴雅静.山药喷雾干燥粉的加工工艺研究[J].食品工程,2010,1(3):31-33.
[13]Williamsong,Plumb G W,Garcia-Conesamt. Glycosylation,esteri cation and polymerization of avonoids and hydroxycinnamates:effects on antioxidant properties[J]. Basic Life Sci,1999,66:483-494.
[14]李颖畅,孟宪军,孙靖靖,等.蓝莓花色苷的降血脂和抗氧化作用[J].食品与发酵工业,2008,34(10):44-47.
[15]Chandrasekar D,Madhusudhana K,Ramakrishna S,et al. Determination of DPPH free radical scavenging activity by reversed-phase HPLC:A sensitive screening method for polyherbal formulations[J]. Journal of Pharmaceutical and Biomedical Analysis,2006,40(2):460-464.
[16]Scalzozo R L. Organic acids influence on DPPH scavenging by ascorbic acid[J]. Food chemistry,2008,107(1):40-43.
[17]Mariken J T J Arts,J Sebastiaan Dallinga,Hans-Peter Voss,et al. A new approach to assess the total antioxidant cap a city using the TEAC assays[J]. Food Chem,2004,88:567-570.
Optimization of extraction conditions and investigation of antioxidant activity of polysaccharides from purple yam
LIU Hang-da,MA Qian-su,WANG Jie,ZHOU Yun,SUN Lu,CHENG Yong-qiang*
(College of Food Science & Nutritional Engineering,Beijing Key Laboratory of Functional Food from Plant Resources,China Agricultural University,Beijing 100083,China)
The polysaccharide extraction from purple yam was optimized based on single factor experiment combined with orthogonal design. The optimum extraction conditions were achieved when the ratio of solid to liquid was 1∶15(mg/mL)at 55 ℃ for 2 h. Under such conditions,the yield ratio of purple yam polysaccharide reached as high as 2.58%±0.03%. The antioxidant activity of crude polysaccharide from purple yam was extensively investigated by antioxidant experiments tests based on DPPH,superoxide radical,ABTS and EDTA. The experimental results showed that the polysaccharides from purple yam exhibited significant antioxidant activity in the DPPH and ABTS tests with free radical scavenging rates being 66.24% at 2 mg/mL and 69.50% at 24 mg/mL,respectively,which was better than the polysaccharides from Yam.
purple yam;crude polysaccharide;extraction;antioxidant activity
2015-03-23
刘杭达(1993-),男,本科,研究方向:紫山药多糖,E-mail:liuhangda93@163.com。
*通讯作者:程永强(1972-),男,博士,教授,研究方向:食品物性评价;天然产物提取,功能食品的评价与开发;粮食加工;酶在农产品综合加工利用中的应用,E-mail:chengyq@cau.edu.cn。
国家大学生创新计划支持项目(201310019054);国家自然科学基金支持项目(31171739)。
TS255.1
B
1002-0306(2015)23-0208-06
10.13386/j.issn1002-0306.2015.23.035
