贝酵母耐硫相关基因FZF1的克隆与分析
2015-05-05张先昂刘小珍李升星张汉尧
贺 笑,张先昂,刘小珍,李升星,张汉尧
(西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南昆明 650224)
贝酵母耐硫相关基因FZF1的克隆与分析
贺 笑,张先昂,刘小珍,李升星,张汉尧*
(西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南昆明 650224)
FZF1基因在酿酒酵母中对亚硫酸盐转运蛋白编码基因SSU1具有正向调节作用,但在贝酵母中尚无相关报道,本研究拟通过对该基因进行克隆和生物信息学分析为后续研究做出参考。首先对贝酵母FZF1基因进行克隆,并利用在线分析工具ProtParam、ProtScale、TMHMM、PredictProtein、Swiss-Model等软件对其编码蛋白质的基本理化性质进行分析,同时预测了该基因所编码蛋白质的二级结构和三级结构。结果表明:该核苷酸序列含有一个长900 bp的开放阅读框,可编码299个氨基酸;编码的蛋白质为在细胞核中行使调控功能的亲水蛋白,含有18个丝氨酸(S)激酶潜在磷酸化位点、一个Coil区和4个锌指结构域,与酿酒酵母FZF1基因所编码的蛋白质结构和性质极为相似。可初步认为贝酵母FZF1基因与细胞的耐硫性相关;而贝酵母FZF1基因所编码的蛋白质中仅有4个锌指,则可能是贝酵母硫耐受能力比酿酒酵母弱的重要原因。
贝酵母,FZF1,序列分析,耐硫基因
葡萄酒生产过程中,需要多种抗氧化剂的作用,抑制细菌的生长,从而保证葡萄酒的品质与风味,亚硫酸作为最常见的一种抗氧化剂,广泛用于酿酒工艺[1-2]。然而,过高浓度的亚硫酸会对细胞产生不同程度的毒害作用[3]。亚硫酸盐会直接破坏细胞的组织结构,它能与膜受体结合,阻碍细胞膜正常活动[4],导致细胞内容物外流[5];与ATP酶结合,影响细胞中ATP的合成[6];与葡萄糖、丙酮酸等代谢产物结合,阻碍细胞的正常代谢活动[7-8]。所以在酿酒工艺中,亚硫酸盐的耐受能力也成为筛选酿酒菌株的重要指标之一。
酿酒酵母中,SSU1编码的蛋白SSU1p可以调节细胞的硫代谢[9-10],而在硫代谢过程中,酵母菌会产生亚硫酸盐,这是一种具有潜在毒性的中间代谢产物[11-12],与耐硫相关的基因SSU1(Sulfite sensitivity protein,SSU1)在细胞调节中可作为“硫泵”,将对细胞具有毒害作用的亚硫酸盐泵出细胞外,在保证细胞正常生命活动的同时,也形成了酿酒过程中酒品的特殊风味,从而提高了葡萄酒的品质。而与酿酒酵母耐硫相关的另一个基因FZF1(Five zine finger,FZF1)在“泵硫”过程中也发挥至关重要的作用。FZF1被发现在SSU1的转录过程中起着正向调节的作用。即在酿酒酵母硫代谢过程中,SSU1基因编码的亚硫酸盐转运蛋白会调节酵母细胞的亚硫酸盐代谢,过量的亚硫酸盐可以通过亚硫酸盐转运蛋白运输到细胞外,而正向调节基因FZF1可加强细胞内亚硫酸盐的输出量[13],从而提高酵母的硫耐受性,进而也可提高酿造葡萄酒中芳香物质硫醇的含量,最终达到提高葡萄酒品质的目的。

表1 进行蛋白质分析的软件、网址及内容
贝酵母与酿酒酵母同属于狭义酿酒酵母属,二者在各性状上都极为相似,但在“长相思”等酒种酿造工艺后期,贝酵母在无氧呼吸产生酒精方面具有更为重要的作用[14-16]。在贝酵母中,张太奎等[17]对耐硫相关基因SSU1进行了初步的分析。作为亚硫酸盐转运蛋白编码基因SSU1转录过程中的正向调节基因FZF1,更具有分析研究的重要意义。
本实验通过对贝酵母FZF1基因进行克隆,测序分析,再借助多种在线分析工具对该基因的结构和功能进行了详细的分析及预测,从而探讨贝酵母的FZF1基因在“泵硫”的过程中是否具有酿酒酵母FZF1基因对SSU1基因转录进行正向调节的相同作用。为后期进一步研究贝酵母硫代谢的详细途径奠定了基础。
1 材料与方法
1.1 材料与仪器
菌株 香格里拉县奔子栏乡葡萄分离得到的贝酵母菌株BZL5;酵母膏、蛋白胨、琼脂、葡萄糖、TIANamp Yeast DNA Kit、RNase A、Lyticase、山梨醇 TIANGEN公司;Loading Buffer、核酸染料 Bioteke Corporation;DNA Marker Ⅶ 庄盟生物有限公司;100 bp Ladder DNA Marker Biomed公司;Taq 酶(5000U)、dNTP(10 mM) NEB北京分公司;引物 生工生物工程(上海)股份有限公司。
DK98-1数显恒温水浴 天津泰斯特仪器有限公司;Centrifuge 5810R离心机 德国Eppendorf公司;PYX-DHG-9023-A干燥箱 上海新诺仪器设备有限公司;TP650 PCR仪 日本TaKaRa公司;Pico17 小型离心机 美国Thermo公司;DYY-10C电泳仪 北京百晶生物技术有限公司;GBOXHR 凝胶成像分析系统 美国Syngene公司;温控摇床 德国Sartorius;YXQ-LS-75SII灭菌锅 上海博讯实业有限公司;SW-CJ-2FD超净工作台 苏州净化工程公司;移液枪 德国Eppendorf公司。
1.2 实验方法
1.2.1 贝酵母基因组DNA的获得 利用酵母基因组DNA提取试剂盒提取高质量的样品DNA。用琼脂糖凝胶电泳检测。
1.2.2 贝酵母FZF1基因的扩增 利用Primer Premier5,确定了上游引物Primer FZF1L1:5′ TACGGGTTGACCACTCCAAT 3′、下游引物Primer FZF1R1:5′ CTCAAGTTGGTACCACCCAA 3′。
进行PCR扩增:25 μL体系为:5 μL高质量DNA,1 μL Primer FZF1L1,1 μL Primer FZF1R1,2.5 μL 10×PCR Buffer,0.3 μL Taq酶,0.4 μL dNTP,14.8 μL ddH2O。
PCR反应程序:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,进行35个循环,72 ℃最后延伸7 min,4 ℃forever。PCR产物于-20 ℃保存。
1.2.3 贝酵母FZF1基因的测序与分析 PCR产物经过琼脂糖凝胶电泳检测后,委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交到NCBI,利用Open Reading Fame Finder工具查找这条核苷酸序列中的开放阅读框。预测该核苷酸序列所翻译的蛋白质,然后利用在线分析工具对所预测蛋白质的基本理化性质、亲疏水性、跨膜区、信号肽、Coil区、结构域、亚细胞定位等进行分析,最后预测该蛋白质的二级结构和三级结构。具体分析内容如表1。
2 结果与分析
2.1 贝酵母基因组DNA及PCR产物的检测
将提取获得的贝酵母基因组DNA通过琼脂糖凝胶电泳检测,结果见图1。1、2、3、4、5、6号菌株均提出质量较好的基因组DNA。

图1 贝酵母基因组DNA电泳图谱Fig.1 Electrophoretogram of genomic DNA from S. bayanus
确定提取得到贝酵母基因组DNA后,扩增贝酵母FZF1基因,PCR检测结果见图2。3号、5号菌株扩增出了FZF1基因片段。

图2 FZF1基因扩增结果Fig.2 Amplification results of FZF1 gene

表2 贝酵母FZF1基因编码蛋白质的氨基酸组成及亲疏水性
2.2 贝酵母FZF1基因编码蛋白质的一级结构分析
将PCR结果测序后得到一条长为1603 bp的核苷酸序列。利用NCBI中的BLAST工具进行序列比对,只有两条巴斯德酵母的序列与之同源性比例为5%和4%,说明该序列是一条新基因序列。然后再利用Open Reading Fame Finder工具查找这条核苷酸序列中的开放阅读框。根据六种不同的编码方式得到的结果显示,该基因序列中含有一个长度为900 bp的开放阅读框,位于基因的563~1462 bp之间,可能与遗传信息的表达密切相关。该段CDS区可以翻译成一条含有299个氨基酸的蛋白质,继而得到其氨基酸序列,见图3。

图3 贝酵母FZF1基因编码的蛋白质序列Fig.3 The protein sequence encoded by the FZF1 gene of S.bayanus
2.2.1 理化性质分析 将氨基酸序列提交到在线分析工具ExPASy ProtParam中,对该蛋白质序列的组分及基本理化性质进行分析。结果显示:该蛋白质的分子式为C1520H2345N431O468S13,分子质量为34561.7,理论pI值为6.80,氨基酸组成和每个氨基酸的亲疏水性分值见表2。氨基酸组成上Ser有33个,所占比例为11%,Leu有32个,所占比例为10.7%,这两种氨基酸含量相对较高,其他氨基酸比例相差不大。不稳定系数为48.05,所以该蛋白质属于不稳定蛋白。脂肪系数为69.46,总平均亲水性为-0.812,为亲水蛋白。
2.2.2 疏水性分析 利用ProtScale进行蛋白质亲疏水性分析,见图4。根据20种氨基酸疏水特性的参数,较高正值的氨基酸具有较强的疏水性,而较低负值的氨基酸具有较强的亲水性[18]。由图可知,根据正负分值比例,此预测蛋白质属于亲水蛋白。ProtScale图形输出显示该蛋白质最高分值峰为1.344,最低分值峰为-3.100,不存在高分值(Scare>1.5)峰,所以该蛋白质可能没有潜在的跨膜区。在36、99、120、140、193、243、248氨基酸位点附近的分值分别为-2.578、-2.678、-2.056、-1.456、-1.778、-2.233、-2.311,这些区域属于高亲水性,可能在这些位点存在折叠情况。

图4 贝酵母FZF1基因编码的蛋白质的亲疏水性Fig.4 Hydrophobicty of protein encoded by the FZF1 gene of S.bayanus
2.2.3 蛋白质信号肽和亚细胞定位预测 组成生物体的蛋白质大多数是在细胞质中的核糖体上合成的,各种蛋白质合成之后要分别运送到细胞中的不同部位,以保证细胞生命活动的正常进行。有些蛋白质要通过内质网膜进入到内质网腔内,最终成为分泌蛋白;有的蛋白质则需要穿过各种细胞器的膜,进入细胞器内,构成细胞器蛋白。分泌蛋白的N端都有一段约15~35个氨基酸的疏水性肽端,其功能是引导蛋白质多肽链穿过内质网膜进入腔内,称为信号肽[19]。由前文蛋白质的亲疏水性分析显示,该蛋白质为水溶性蛋白,应无信号肽,SignalP 3.0 server 分析结果与预测一致。
亚细胞定位与蛋白质的功能存在着非常密切的联系。通过TargetP在线软件分析该蛋白质的亚细胞定位,结果如图5(a)。该蛋白质在线粒体存在的可能性为0.136,在分泌通路存在的可能为0.064,而在其他位置的可能性为0.908,即该蛋白质很有可能存在于除线粒体和分泌通路以外的位置。进一步用SPORT软件进行亚细胞定位分析,使用k-NN近邻算法,结果如图5(b),该蛋白质主要分布在细胞核中,可能性为95.7%,也有可能在线粒体中出现,可能性仅为4.3%。由此可知,该蛋白质很有可能为一种在细胞核中进行代谢调控的转录因子。
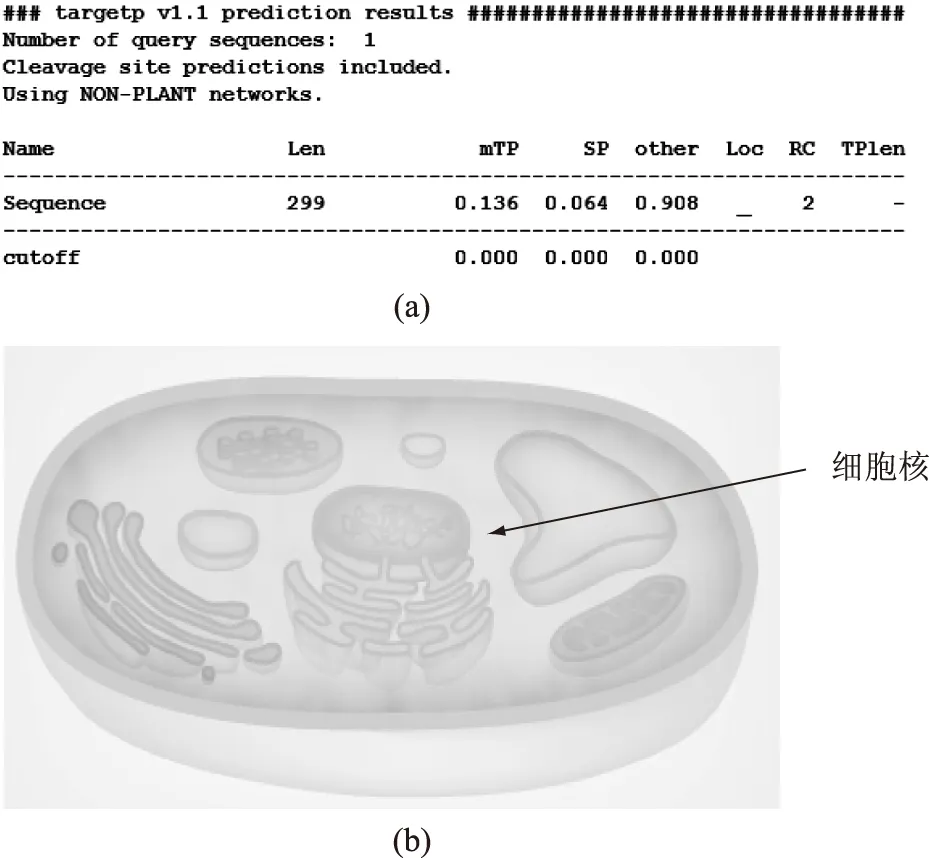
图5 FZF1编码蛋白质的亚细胞定位Fig.5 Subcellular localization of protein encoded by the FZF1 gene注:a图为TargetP预测结果;b图为PSORT预测结果。
2.2.4 激酶磷酸化修饰位点预测 氨基酸翻译后通常会加入一些生物化学官能团,使其在化学性质或者结构上发生变化,被称为蛋白质翻译后修饰。其中磷酸化是将一个磷酸基团导入一个有机分子。此作用在生物化学中占有重要地位。蛋白质的磷酸化可发生在许多种类的氨基酸上,其中以丝氨酸为多,接着是苏氨酸。而酪氨酸和组氨酸则相对较少的磷酸化发生。通过KinasePhos在线分析工具来预测此蛋白质的磷酸化位点和修饰激酶,为了减少假阳性率,当限定值为90%时,在线提交蛋白质序列,对四种蛋白质进行勾选,预测结果如表3,含有18个丝氨酸(S)激酶潜在磷酸化位点。这些激酶磷酸化位点对蛋白质修饰加工后的功能行使具有重要的意义。

表3 FZF1编码蛋白质的激酶磷酸化位点预测
注:S指激酶磷酸化位点。
2.3 贝酵母FZF1基因编码蛋白质的二级结构预测
2.3.1 Coil区分析 卷曲螺旋是蛋白质中由2~7条α螺旋链互相缠绕形成类似麻花状结构的总称。目前已发现的天然卷曲螺旋的主要存在形式为由2~5条α螺旋链相互缠绕而形成的平行或反平行同寡聚体或异寡聚体[20]。卷曲螺旋式控制蛋白质寡聚化的元件,含有卷曲结构的蛋白质主要是一些转录因子、骨架蛋白、动力蛋白等,在机体内执行这分子识别、代谢调控、细胞分化等生物学功能。利用COILS在线分析工具,基于Lupas算法,预测该蛋白质的卷曲螺旋,如图6所示,该蛋白质残基在3个不同窗口(Window 14、21、28)均显示卷曲螺旋区域,文本数值(未列出)结果显示,卷曲螺旋序列位于104~117区域框内。

图6 FZF1基因编码蛋白质的Coil区分析Fig.6 Coil area analysis of protein encoded by the FZF1 gene
2.3.2 跨膜区分析 通过TMPRED、TMHMM在线软件分析该蛋白质的跨膜螺旋区,未发现可能的跨膜螺旋区,即该蛋白质不跨膜。通常蛋白质含有跨膜区,即可能作为膜受体、锚定蛋白或离子通道蛋白,均不溶于水,所以该预测蛋白质为水溶性蛋白。这与蛋白质的亲疏水性性质一致。TMHMM预测结果如图7,没有跨膜区信号。

图7 FZF1基因编码蛋白质的跨膜区分析Fig.7 Transmembrane domains of protein encoded by the FZF1 gene
2.3.3 蛋白质二级结构预测 利用PredictProtein在线分析平台预测该蛋白质的二级结构,结构表明,FZF1的二级结构主要以环(loop)为主,高达67.22%,其次是螺旋(helix),占有31.77%,仅含有1%的折叠(sheet)。
2.4 贝酵母FZF1基因编码蛋白质的结构域
2.4.1 结构域分析 结构域是在蛋白质三级结构中介于二级和三级结构之间的可以明显区分但又相对独立的折叠单元,每个结构域自身形成紧实的三维结构,可以独立存在或折叠。使用SMART在线服务器分析该蛋白质的结构功能域,结果如图8。整个氨基酸序列中,在第12~36位、第42~66位、第72~94位、第246~273位氨基酸位点出分别存在一个C2H2型锌指结构域。在第216~213位氨基酸位点处存在一个组成低复杂序列区。
锌指结构域是一种相当小的蛋白模体,通过许多类似手指状的突出物与靶分子相联系,这些区域大多数情况下会结合锌离子,但时常也会与其他的金属离子相结合。许多情况下,一些家族成员会通过构成盐桥使类似手指状的折叠更加坚固。锌指结构域能够与DNA、RNA和蛋白质等相结合,绑定特征依氨基酸序列的不同而有所差异。在不断的进化过程中,锌指结构域已经形成了稳固的支架结构。不仅在形成蛋白质的折叠等方面发挥作用,而且对于基因的转录调控方面具有重要意义。C2H2型锌指结构域作为这个家族中最经典的结构类型,由一个短的β折叠和一个α螺旋形成四面体结构,在真核生物中,它作为转录因子,与DNA或RNA特异性结合,从而对基因的表达起着抑制或增强的作用。在预测蛋白质的二级结构时,含有31.77%的螺旋结构,可能就是构成锌指结构域的重要结构。

图8 FZF1基因编码蛋白质的结构域分析Fig.8 Structure domain analysis of protein by the FZF1 gene
2.4.2 motif搜索 模体是序列中局部的保守区域,或者是一组序列中共有的一小段序列模式。一般指构成任何一种特征序列的基本结构,但多数情况下是指可能具有分子功能、结构性质或家族成员相关的任何序列模式。模体作为结构中的亚单元,表现结构域的各种生物学功能。
利用PROSITE数据库对该蛋白质进行motif搜索,结果如图9。该蛋白质中有3处与指定的模板相匹配,具体为第12~36位、第42~66位、第72~94位的氨基酸序列分别存在一个锌指结构域,这与SMART在线服务器分析结果相一致。FZF1基因编码的蛋白质可能是通过这3个C2H2型锌指结构域与SSU1基因特异性结合,从而增强了SSU1基因的表达。
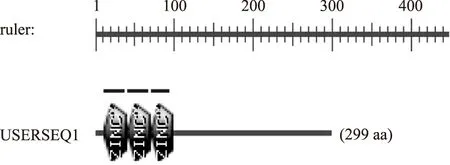
图9 FZF1基因编码蛋白质的motif分析Fig.9 Motif analysis of protein encoded encoded by the FZF1 gene

图10 FZF1基因编码蛋白质的三级结构预测Fig.10 Three-dimensional structure prediction of protein encoded by the FZF1 gene
2.5 贝酵母FZF1基因编码蛋白质的三级结构预测
利用同源建模的网络综合服务器Swiss-Model Workspace对贝酵母FZF1基因编码的蛋白质进行三级结构的预测。预测的三级结构模型见图10,由在线分析的结果可知:贝酵母FZF1基因编码的蛋白质基于数据库中搜索到的模型,比对建模,一致性达到42.62%。由模型评估结果可知,基于QMEANscore4记分值估算,可信度为0.54,表示模型质量中等偏高,较可信。下载PDB图片,利用蛋白质结构可视化工具Swiss-PdbViewer对预测的三级结构模型图进行修饰分析,见图11,预测的三级结构中含有两个锌指结构域,与前文结构域的预测基本一致。该预测蛋白质主要由无规则卷曲和螺旋结构组成,与前文二级结构的预测相呼应。

图11 Swiss-Pdb Viewer修饰下的三级结构Fig.11 The three-dimensional structure modified by Swiss-Pdb Viewer
2.6 贝酵母与酿酒酵母所编码蛋白质序列的比对
将贝酵母预测编码的蛋白质序列和酿酒酵母预测编码的蛋白质利用MEGA 5.05进行序列比对,结果如图12。分别比对了含有299个氨基酸的序列,其中保守氨基酸有192个,差异氨基酸107个,一致率为64.21%。

图12 贝酵母与酿酒酵母所编码蛋白质序列的比对结果Fig.12 Alignment results of protein sequence coded by S. cerevisiae and S.bayanus
3 讨论
本研究首次对贝酵母FZF1基因进行了克隆分析,结果显示该核酸序列可以编码一条含有299个氨基酸的蛋白质,分子式为C1520H2345N431O468S13,结构不稳定,属于亲水性蛋白,没有信号肽和跨膜结构域,亚细胞定位在细胞核中发挥作用,含有典型的C2H2锌指结构域,二级结构中以环(loop)为主,其次是螺旋结构,预测的三级结构也基本与二级结构相符。
贝酵母FZF1基因所编码的蛋白质序列虽然与酿酒酵母FZF1基因所编码的蛋白质序列比对后一致率为64.21%,但是两者蛋白质结构性质差异不甚明显。酿酒酵母FZF1基因所编码的蛋白质也是典型的亲水性蛋白,没有信号肽和跨膜结构域,主要在细胞核中发挥作用,氨基酸序列中有一处Coil区,唯一有差异的是,酿酒酵母FZF1基因所编码的蛋白质中含有五个C2H2型锌指结构域,而贝酵母FZF1基因所编码的蛋白质中仅有4个。锌指结构域的主要作用是与DNA结合而行使基因调控的作用,酿酒酵母FZF1基因与SSU1基因结合,从而可调节酵母亚硫酸盐的耐受能力[3]。锌指结构域的多少可能与酵母对亚硫酸盐耐受能力的强弱相关。而贝酵母FZF1基因所编码的蛋白质中仅有4个锌指,则可能是贝酵母硫耐受能力比酿酒酵母弱的重要原因。蛋白质的特殊结构决定了蛋白质的特殊功能,在具有相似结构的前提下分析推测,贝酵母FZF1基因与酿酒酵母FZF1基因可能具有相似的功能,与酵母亚硫酸盐的耐受能力相关。Tomoko[21]和Iijima[22]等先前就认为贝酵母SSU1基因编码的蛋白质可能具有亚硫酸盐“盐泵”的功能,进而可以推测与之相关的FZF1基因也与亚硫酸盐“盐泵”相关,而有关贝酵母FZF1基因则还没有相关的报道。当然,本文推测结论还需要后续进行功能确证等进一步验证。
4 结论
本研究通过对贝酵母FAF1基因的克隆与分析,得出该基因包含一条长度为900 bp的开放阅读框,编码一条含有299个氨基酸亲水蛋白,该蛋白主要以无规则卷曲为主,含有四个锌指结构域,在细胞核中行使功能。与酿酒酵母FZF1基因所编码的蛋白质序列比对结果一致性达64.21%,结构上主要区别在于,比酿酒酵母FZF1基因所编码的蛋白质少一个锌指结构域,这可能是贝酵母耐硫性稍逊色的重要原因。
亚硫酸在葡萄酒的酿造和品质形成过程中,起着至关重要的作用。但是由于亚硫酸盐对细胞的毒害作用,所以对硫的耐受能力成为筛选酿酒菌株的重要指标之一。本研究通过生物信息学分析的知识初步预测了贝酵母FZF1基因所编码的蛋白质,并对该蛋白质的基本理化性质和结构做出了详细的预测,为贝酵母FZF1基因的进一步研究和贝酵母硫耐受性的更深层次探索做出了一定的参考。
[1]陈叶福,沈世超,王艳,等. SSU1多拷贝表达对酿酒酵母二氧化硫生成量的影响[J]. 微生物学报,2008,48(12):1609-1615.
[2]Taylor S L,Higley N A,Bush R. Sulfites in food:uses,analytical methods,residues,fate,exposure assessment,metabolism,toxicity,and hypersensitivity[J]. Adv. Food Res,1986,30:1-7.
[3]Avram D,Leid M,Bakalinsky A T. Fzflp ofSaccharomycescerevisiaeis a positive regulator of SSU1 transcription and its first zinc finger region is required for DNA binding[J]. Yeast,1999,15:473-480.
[4]Divol B,du Toit M,Duckitt E. Surviving in presence of sulphur dioxide:strategies developed by wine yeasts[J]. Appl Microbiol Biotechnol,2012,95(3):601-613.
[5]Hinze H,Holzer H. Analysis of the energy metabolism after incubation ofSaccharomycescerevisiaewith sulfite or nitrite[J]. Arch Microbiol,1986,145(1):27-31.
[6]Hinze H,Holzer H. Effect of sulfite or nitrite on the ATP content and the carbohydrate metabolism in yeast[J]. Z Lebensm Unters Forsch,1985,181(2):87-91.
[7]Schimz KL,Holzer H. Rapid decrease of ATP content in intact cells ofSaccharomycescerevisiaeafter incubation with low concentrations of sulfite[J]. Arch Microbiol,1979,121(3):225-229.
[8]Rankine B C,Pocock K F. Influence of yeast strain on binding of sulphur dioxide in wines,and on its formation during fermentation[J]. J Sci Food Agric,1962,20(2):104-109.
[9]Park H,Bakalinsky. SSU1 mediates sulphite efflus in Sacharomyces cerevisiae[J]. Yeast,2000(16):881-888.
[10]Tiziana N,Viviana C,Alessio G,et al. A sulphite-inducible
form of the sulphite efflux gene SSU1 in aSaccharomycescerevisiaewine yeast[J]. Microbiology,2010,156(6):1686-1696.
[11]Avram D,Bakalinsky A T. SSU1 encodes a plasma membrane protein with a central role in a network of proteins conferring sulfite tolerance in Saccharomyces cerevisiae[J]. Bacteriol,1997,179(18):5971-5974.
[12]Donalies U E B,Stahl U. Increasing sulphite formation inSaccharomycescerevisiaeby overexpression of MET14 and SSU1[J]. Yeast,2002,19:475-484.
[13]Breitwieser W,Price C,Schuster T. Identification of a gene encoding a novel zinc finger protein inSaccharomycescereviaiae[J]. Yeast,1993(9):551-556.
[14]王庆国,刘天明. 酵母菌分类学方法研究进展[J]. 微生物学杂志,2007,27(3):96-101.
[15]Ciani M E,Kerala(India),Sipiczki M. Taxonomic and physiological diversity of saccharomyces bayanus,in biodiversity and biotechnology of wine yeasts[M]. Research Signpost,2002,53-69.
[16]Naumov G I,Naumova E S,Martynenko N N and Masneuf-Pomaréde I. Taxonomy,ecology,and genetics of the yeast saccharomyces bayanus:a new object for science and practice[J].Mikrobiologiya,2011,80(6):723-730.
[17]张太奎,朱方明,刘小珍,等. 贝酵母SSU1基因的克隆与分析[J]. 中国食品学报,2014,14(9):195-199.
[18]阎隆飞,孙之荣. 蛋白质分子结构[M]. 北京:清华大学出版社,1999:17-18.
[19]刘雅婷,李正跃,朱有勇,等. 植物病原菌Pseudomonas syringae pv. tomato基因组中的信号肽分析[J]. 遗传,2005,27(6):959-964.
[20]魏香,曾宪纲,周海梦. 蛋白质结构中卷曲螺旋的研究进展[J]. 中国生物化学与分子生物学报,2004,20(5):565-571.
[21]Tomoko F. Functional analysis of SSU1 genes in lager brewing yeast[J]. Bioscience & Industry,2003,61(12):809-810.
[22]Iijima K,Ogata T. Construction and evaluation of self-cloning bottom-fermenting yeast with high SSU1 expression[J]. Journal of Appl Microbiology,2010,109(6):1906-1913.
Cloning and sequence analysis of theFZF1 gene concerning sulfur tolerance fromSaccharomycesbayanus
HE Xiao,ZHANG Xian-ang,LIU Xiao-zhen,LI Sheng-xing,ZHANG Han-yao*
(Key Laboratory for Forest Genetic and Tree Improvement & Propagation in Universities of Yunnan Province,Southwest Forestry University,kunming 650224,China)
TheFZF1 gene ofSaccharomycescerevisiaewas found to be a positive regulator ofSSU1 transcription,but there was no report about theFZF1 gene ofSaccharomycesbayanus. In this study,the genes were cloned and the content of bioinformatics was analyzed by online tools for setting the foundation of the further research. Here theFZF1 gene ofS.bayanuswas cloned and the physical and chemical properties ofFZF1 protein were analyzed by online analytical tools,such as ProtParam,ProtScale,TMHMM,PredictProtein and Swiss-Model. At the same time,the protein secondary structure and tertiary structures were predicted. The results indicated that theFZF1 gene contained an opening reading frame(ORF)of 900 bp encoding a 299 predicted amino acids. The protein was a hydrophilic protein exercising their control functions in the nucleus. It contained 18 serine kinase potential phosphorylation sites,a coil domain and 4 zinc finger domains. The protein encoded byFZF1 gene ofS.cerevisiaewas very similar with the predicted protein. So theFZF1 gene ofS.bayanuswas inferred to be associated with the sulfur resistance. And the protein encoded by theFZF1 gene ofS.bayanusonly contains 4 zinc finger domains. It was one of the most important reasons that the sulfur tolerance of mostS.bayanuswas weaker than mostS.cerevisiae.
Saccharomycesbayanus;FZF1;sequencing analysis;sulfur tolerance gene
2015-02-12
贺笑(1991-),女,在读硕士,研究方向:林业生物技术,E-mail:smile1165279688@sina.com。
*通讯作者:张汉尧(1975-),男,博士,教授,研究方向:植物和微生物分子遗传,E-mail:hanyaoz@163.com。
国家自然科学基金项目(31360404);教育部归国人员启动基金项目(212209)。
TS201.3
A
1002-0306(2015)23-0166-07
10.13386/j.issn1002-0306.2015.23.026
