谷氨酰胺转氨酶对鸡蛋蛋白热凝固性的影响
2015-05-05雷明辉叶劲松张铭容张子丽李昕阳郑伯红
雷明辉,叶劲松,张铭容,李 智,李 睿,肖 梦,张子丽,李昕阳,郑伯红
(四川农业大学食品学院,四川雅安 625014)
谷氨酰胺转氨酶对鸡蛋蛋白热凝固性的影响
雷明辉,叶劲松*,张铭容,李 智,李 睿,肖 梦,张子丽,李昕阳,郑伯红
(四川农业大学食品学院,四川雅安 625014)
本实验研究了NaCl浓度、pH、酶作用温度、酶作用时间和酶量对谷氨酰胺转氨酶(TGase)处理鸡蛋蛋白后其热凝固所得凝胶的硬度和保水性的影响。并通过SDS-PAGE电泳对酶作用后鸡蛋清样品中蛋白质进行分析,以初步探究TGase对鸡蛋蛋白热凝固性的影响机理。结果表明:TGase处理鸡蛋蛋清液后其凝胶的硬度和保水性都有极显著提高(p<0.01)。当NaCl浓度为0.4mol/L、pH6.0、温度35℃、酶作用时间3.5h、酶量为10U/g蛋白质时,鸡蛋蛋白凝胶硬度和保水性最大,分别为(134.73±1.79)g和93.83%±0.58%,相比空白组分别提高了58.87%和29.38%。经SDS-PAGE电泳分析表明:一定条件下,TGase可促进鸡蛋清中的蛋白质分子交联,从而可改善其热凝固性。
谷氨酰胺转氨酶,鸡蛋蛋白,热凝固性
鸡蛋蛋清价格低廉,营养丰富,是重要的食品加工原料。它具有热凝固性、持水性、起泡性和乳化性等多种功能,其中热凝固性在食品的生产加工中有重要作用[1],蛋清的热凝固性有利于蛋白质变性形成凝胶,而蛋清凝胶可促进蛋制品干燥,改善产品质地和持水力等[2-7]。因此,研究鸡蛋蛋白的热凝固性对增强其在食品工业中的加工性能有非常重要的意义。
谷氨酰胺转氨酶(Transglutaminase,EC 2.3.2.13),简称TGase,具有良好热稳定性和亲水性,被作为新型的食品添加剂应用在食品加工中[8]。TGase可催化蛋白质中的酰基发生转移,促使蛋白质分子内、分子间以及蛋白质与氨基酸之间发生交联[9]。Bellido等[10]提出蛋白质之间发生交联后可以改善食品凝胶特性、起泡性、溶解性、乳化性等。目前,TGase已广泛应用于各类食品中以改善其凝胶硬度和保水性等品质[11]。然而,TGase应用于鸡蛋中的研究报道还很少[12-13],尤其以鲜鸡蛋蛋清为对象研究TGase对其热凝固性的影响还未见报道。
本实验以鲜鸡蛋蛋清为研究对象,研究TGase对鸡蛋蛋白凝胶硬度和保水性的影响。并通过SDS-PAGE电泳对TGase处理的鸡蛋清中蛋白质进行分析,以初步探究TGase对鸡蛋蛋白热凝固性的影响机理。
1 材料与方法
1.1 材料与仪器
鲜鸡蛋 四川雅安市雨城区黄家鲜鸡蛋供应商提供;谷氨酰胺转氨酶 酶活100U/g,南京庞博生物有限公司;标准牛血清蛋白、十二烷基磺酸钠(SDS)、盐酸羟胺(hydroxylamine) Sigma公司;考马斯亮蓝R250 成都市科龙化工试剂厂;丙烯酰胺(超纯)、巯基乙醇 Amresco公司。其它试剂均为分析纯。
TA-XTplus2型物性测定仪 英国Stable Micro Systems公司;Millipore Milli-Q型优普超纯水系统 四川优普超纯科技有限公司;DYCZ-240型电泳仪及电源 北京市六一仪器厂;UV-2102PCS型紫外-可见分光光度计 尤尼柯上海仪器有限公司。
1.2 蛋清样品的制备
1.2.1 实验流程
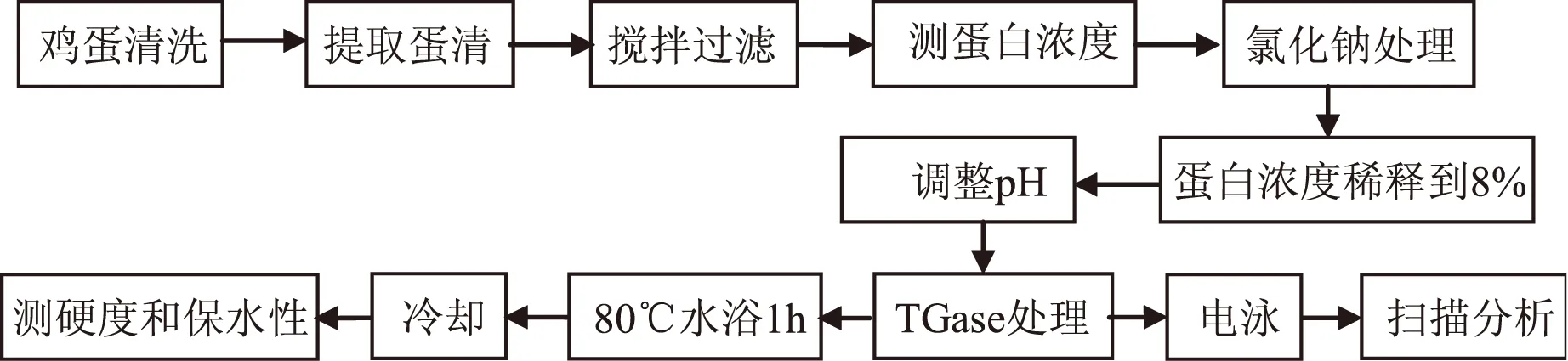
图1 实验流程图Fig.1 The experimental flow chart
1.2.2 鲜蛋清的提取 挑选完好洁净度高的鲜鸡蛋在温水(30℃)中洗净,用0.4% NaOH液浸泡5min后晾干。用分蛋器使蛋清与蛋黄分离提取出蛋清,除去系带,用双层纱布两次过滤,经磁力搅拌器搅拌10min,并再次过滤除去气泡得到均匀鲜蛋清。
1.2.3 鲜蛋清蛋白质浓度的测定 采用考马斯亮蓝G-250染色法[14],将蛋清稀释100倍后用考马斯亮蓝G-250稀释液染色处理,于可见分光光度计中595nm处进行测定,经计算得出蛋清中蛋白浓度。
1.2.4 鲜蛋清的预处理 将上述所得鲜蛋清用一定浓度的NaCl溶液稀释至蛋白浓度为8%,控制蛋清稀释液中NaCl浓度并调节pH,从而得到NaCl浓度和pH一定的蛋清液。
1.2.5 TGase处理蛋清液 将1.2.4所得蛋清液加入即配的TGase溶液,混匀密封于恒温水浴锅中处理一定时间得到TGase处理后的蛋清样品,并进行指标测定。
1.3 单因素实验
本实验以鸡蛋蛋白热凝固后凝胶的硬度、保水性以及电泳分析为考察指标,以NaCl浓度、酶作用温度、pH、酶作用时间、TGase添加量为影响因素进行单因素实验。
1.3.1 NaCl浓度对TGase处理的鸡蛋蛋白热凝固性的影响 取六组蛋清液,调整每组样品pH为6.0,TGase量12U/g蛋白质,酶作用温度40℃,酶作用时间4h,调整每组NaCl浓度分别为0.1、0.2、0.3、0.4、0.5、0.6mol/L,进行NaCl浓度的单因素实验。
1.3.2 酶作用温度对TGase处理的鸡蛋蛋白热凝固性的影响 取六组蛋清,调整每组样品pH为6.0,TGase量为12U/g蛋白质,酶作用时间4h,NaCl浓度0.4mol/L,调整每组酶作用温度分别为25、30、35、40、45、50℃,然后进行TGase作用温度单因素的实验。
1.3.3 pH对TGase处理的鸡蛋蛋白热凝固性的影响 取六组蛋清液,调整每组样品TGase量为12U/g蛋白质,酶作用时间4h,NaCl浓度0.4mol/L,酶作用温度40℃,调整每组pH分别为5.0、5.5、6.0、6.5、7.0、7.5,进行pH的单因素实验。
1.3.4 酶作用时间对TGase处理的鸡蛋蛋白热凝固性的影响 取六组蛋清液,调整每组样品TGase量为12U/g蛋白质,NaCl浓度0.4mol/L,pH6.0,酶作用温度40℃,调整每组酶作用时间为0、1、2、3、4、5h,进行酶作用时间的单因素实验。
1.3.5 TGase添加量对TGase处理的鸡蛋蛋白热凝固性的影响 取六组蛋清液,调整每组样品NaCl浓度为0.4mol/L,pH为6.0,酶作用温度为40℃,酶作用时间为4h,调整每组TGase量为0、4、8、12、16、20U/g蛋白质,进行TGase添加量的单因素实验。
1.4 正交实验
在单因素实验的前提下优化TGase对鸡蛋蛋白热凝固性作用的各因素水平。以鸡蛋蛋白热凝固后凝胶的硬度和保水性为考察指标,采用L16(45)正交实验设计(见表1),每个样品设定三个重复进行正交实验,并得出各因素水平的最佳组合。
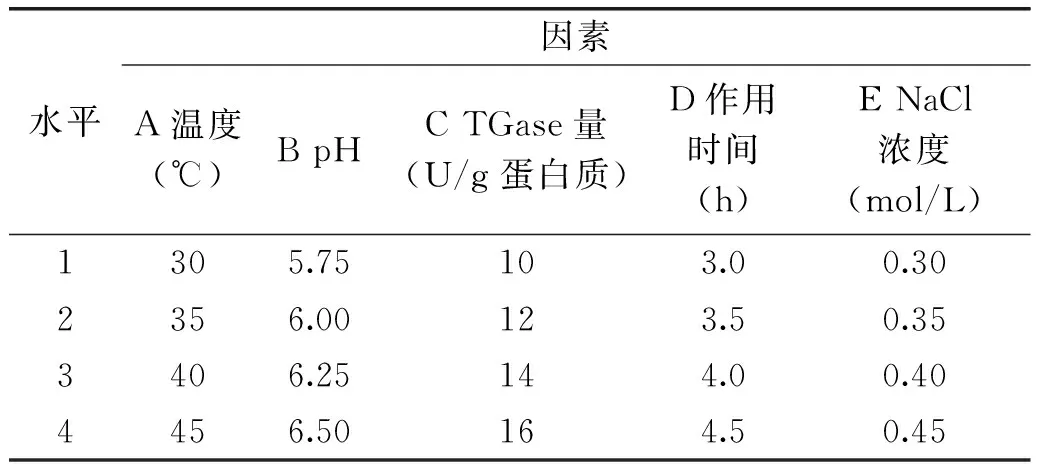
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiment
1.5 指标测定
1.5.1 硬度测定 参照李利鑫[15]的研究方法并改进,将TGase处理的样品经热凝固所得的凝胶于常温(25℃)下用TA-XTplus2物性测定仪在TPA模式下测定凝胶硬度(Hardness)。测定参数:探头型号P/0.5圆柱型探头,测前速度为1.0mm/s,测中采用5.0mm/s的速度,测后速度为5.0mm/s,测试位移10mm,触发力5g。
1.5.2 保水性测定 根据贾丹[16]的研究方法并改进,样品80℃水浴处理1h后冷却至室温(25℃)形成凝胶称重m1,然后于3000r/min条件下离心10min,除去水分后称干物重m2,并计算保水性(WHC)。
WHC(%)=[(m2-m)/(m1-m)]×100
式中:m-离心管质量(g);m1-离心前总质量(g);m2-离心后总质量(g)。
1.5.3 SDS-PAGE电泳分析 参照Panozzo[17]的方法采用聚丙烯酰胺凝胶电泳(SDS-PAGE)进行电泳分析。分离胶和浓缩胶的浓度分别为12%和5%。将不同TGase添加量、NaCl浓度、酶作用温度、pH、酶作用时间处理后的样品用超纯水稀释后加入样品上样缓冲液终止酶的作用,然后在一定条件下进行SDS-PAGE电泳,经扫描仪扫描成像后分析蛋白质的条带变化。
1.6 数据分析
实验数据采用SPSS软件进行统计学分析,p<0.01为差异极显著,p<0.05为差异显著。数据结果用平均值±标准差形式。折线图均采用制图软件Origin8.1绘制。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 NaCl浓度对TGase处理的鸡蛋蛋白热凝固性的影响 由图2知,随NaCl浓度的增加,样品的凝胶硬度和保水性呈先升高然后缓慢下降的趋势(NaCl为0.4mol/L时最大),可能由于NaCl浓度为0.1~0.4mol/L时能促进TGase对鸡蛋蛋白的交联作用形成分子量较大的蛋白;而当NaCl浓度超过0.4mol/L时,可能因样品离子强度过高促使蛋白质变性降低了TGase的活性[18],不利于TGase对鸡蛋蛋白的作用,使样品凝胶硬度和保水性缓慢下降。

图2 NaCl浓度对TGase处理的鸡蛋蛋白凝胶的硬度和保水性的影响Fig.2 Effect of sodium chloride concentration on the gel hardness and water holding capacity of egg white after TGase treatment
2.1.2 酶作用温度对TGase处理的鸡蛋蛋白热凝固性的影响 由图3可知,随TGase作用温度的增加,样品的凝胶硬度和保水性呈先升后降的趋势(温度为40℃时达到最大),这可能是温度为25~50℃均有利于TGase对鸡蛋蛋白的交联作用形成分子量相对较大的蛋白,其中TGase对鸡蛋蛋白作用的最适温度为40℃,此时酶活性最大,对鸡蛋蛋白交联作用最佳;而温度高于40℃时可能会使蛋白质活性降低[19],影响TGase对鸡蛋蛋白的交联作用,因此样品凝胶硬度和保水性下降。
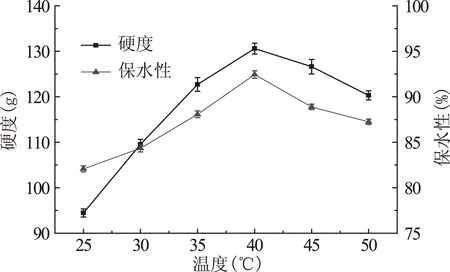
图3 温度对TGase处理的鸡蛋蛋白凝胶的硬度和保水性的影响Fig.3 Effect of acting temperature on the gel hardness and water holding capacity of egg white after TGase treatment
2.1.3 pH对TGase处理的鸡蛋蛋白热凝固性的影响 由图4可知,样品的凝胶硬度和保水性在pH为5.0~7.0时呈先升高后降低的趋势(pH为6.0时达到最大),当pH为7.0~7.5时呈增加趋势,这可能是由于pH在一定范围内有利于TGase对鸡蛋蛋白的交联作用形成分子量较大的蛋白,当pH为6.0时,TGase对鸡蛋蛋白的作用最佳;当pH为7.0时,可能此时的pH本身有利于蛋白质分散促进交联[13],而TGase使蛋白质进一步发生交联,不利于形成较好的凝胶结构;当pH超过7.0时,可能是蛋白质电荷增强[20],使热凝结延缓了,在聚集前蛋白质可完全舒展开,也可能是此时二硫键的作用开始凸显,且此时TGase的酶活虽然有所下降但依然可以促使鸡蛋蛋白交联,使样品凝胶硬度和保水性增加。
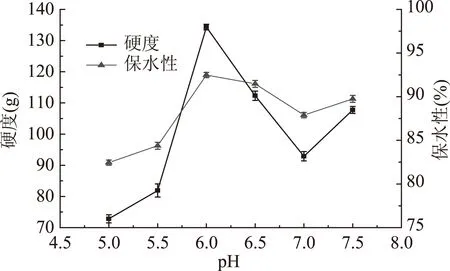
图4 pH对TGase处理的鸡蛋蛋白凝胶的硬度和保水性的影响Fig.4 Effect of pH value on the gel hardness and water holding capacity of egg white after TGase treatment
2.1.4 酶作用时间对TGase处理的鸡蛋蛋白热凝固性的影响 由图5可知,鸡蛋蛋白凝胶硬度和保水性随作用时间的增加呈先升高后趋于平缓的趋势(时间为4h时达到最强)。可能是由于TGase在一定时间内可促进鸡蛋蛋白交联形成分子量相对较大的蛋白质,使样品凝胶硬度和保水性显著增强;当作用时间为4h时交联作用达到饱和,继续增加酶作用时间对其凝胶硬度和保水性影响不显著。
2.1.5 TGase添加量对TGase处理的鸡蛋蛋白热凝固性的影响 由图6可知,鸡蛋蛋白凝胶硬度和保水性随TGase添加量的增加呈先升高后降低的趋势(TGase添加量为12U/g蛋白质时达到最大)。可能是由于适量TGase能促使鸡蛋蛋白交联形成分子量相对较大的蛋白使样品凝胶硬度和保水性显著增强;酶量为12U/g蛋白质时TGase对鸡蛋蛋白交联作用最佳,但继续添加TGase,可能会使蛋白质发生交联过度[13],降低了凝胶硬度和保水性。
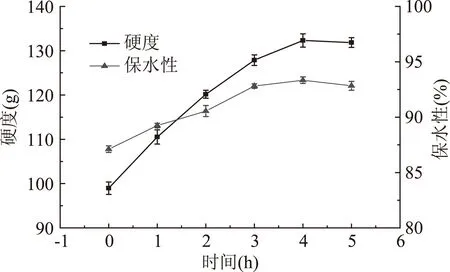
图5 酶作用时间对TGase处理的鸡蛋蛋白凝胶的硬度和保水性的影响Fig.5 Effect of acting time on the gel hardness and water holding capacity of egg white after TGase treatment
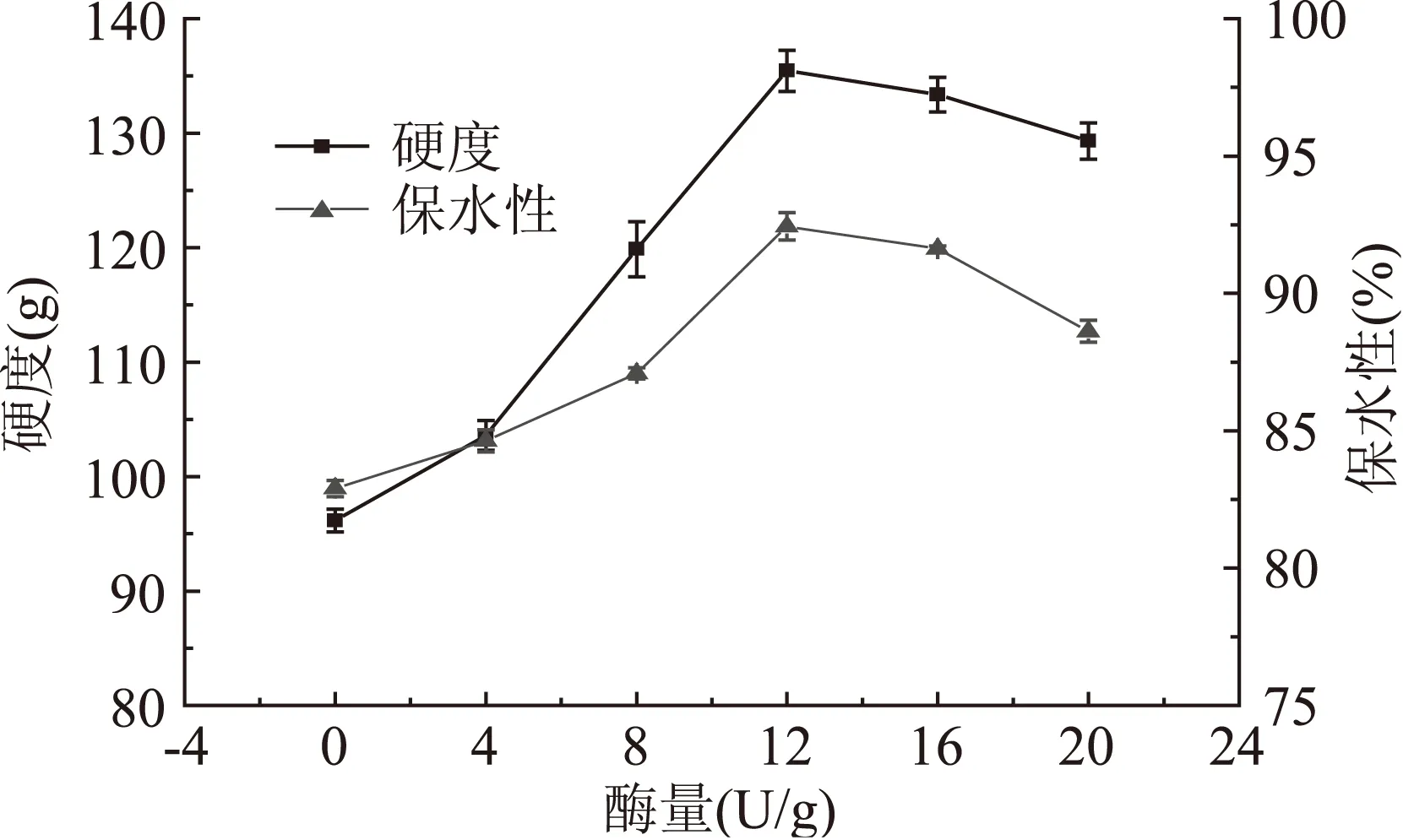
图6 TGase添加量对鸡蛋蛋白凝胶的硬度和保水性的影响Fig.6 Effect of adding quantity of TGase on the gel hardness and water holding capacity of egg white after TGase treatment
2.2 TGase对鸡蛋蛋白作用的SDS-PAGE电泳分析
2.2.1 不同TGase添加量处理的鸡蛋蛋白SDS-PAGE电泳分析 由图7可知,随TGase量的增加,蛋白质a、c、d均由清晰逐渐变得模糊或消失,可能是蛋白质a、c、d均发生了分子间的交联形成了分子量更大的蛋白质分子团;当TGase量为12U/g蛋白质时,蛋白质a几乎消失,蛋白质c和蛋白质d清晰度基本达到最低,可能是蛋白质a已基本完全交联,蛋白质c和d的交联程度基本达到饱和。而随TGase的增加,蛋白质b由模糊逐渐变得清晰,可能是部分小分子蛋白交联后形成了蛋白质b,在酶量为12U/g蛋白质时最清晰,表明此时小分子蛋白质交联程度达到饱和,继续增加TGase量,蛋白质b也逐渐变得模糊甚至消失,可能是由于蛋白质b也因TGase的作用发生了交联,这与王然等[13]在TGase的研究中所得结果相似。
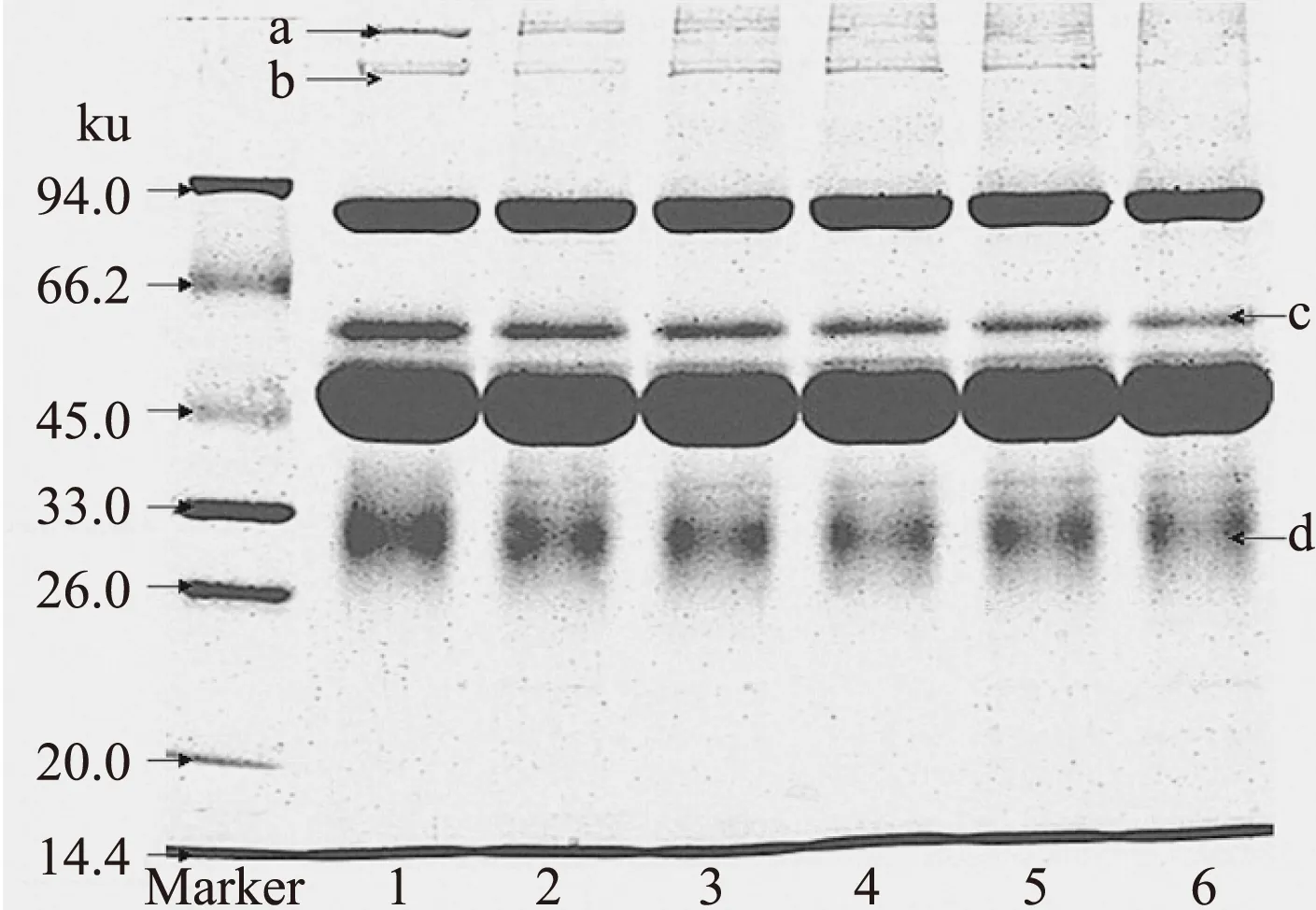
图7 不同TGase添加量处理的鸡蛋蛋白SDS-PAGE电泳图Fig.7 The SDS-PAGE electrophoretogram of egg white treated by TGase in different TGase additive amount注:泳道1~6分别为TGase添加量是0、4、8、12、16、20U/g蛋白质。
2.2.2 不同NaCl浓度下SDS-PAGE电泳分析 由图8可知,随着NaCl浓度的增加,蛋白质a在NaCl浓度为0.2mol/L时消失;蛋白质b条带模糊几乎不可见;而蛋白质c由清晰变得模糊在NaCl浓度为0.3mol/L时最模糊,随后又略微增强;蛋白质d由模糊变得清晰,在NaCl浓度为0.4mol/L时清晰度最高,随后又变模糊。可能是由于在低浓度NaCl存在下,TGase能使蛋白质a、c、d发生交联形成大分子蛋白基团,而蛋白质b可能是由于一些其它小分子蛋白在TGase作用下聚合而形成;当NaCl浓度超过 0.4mol/L时,可能是由于高离子强度条件下蛋白质的变性[18],会影响TGase的活性,使TGase对蛋清中蛋白质的作用减弱。
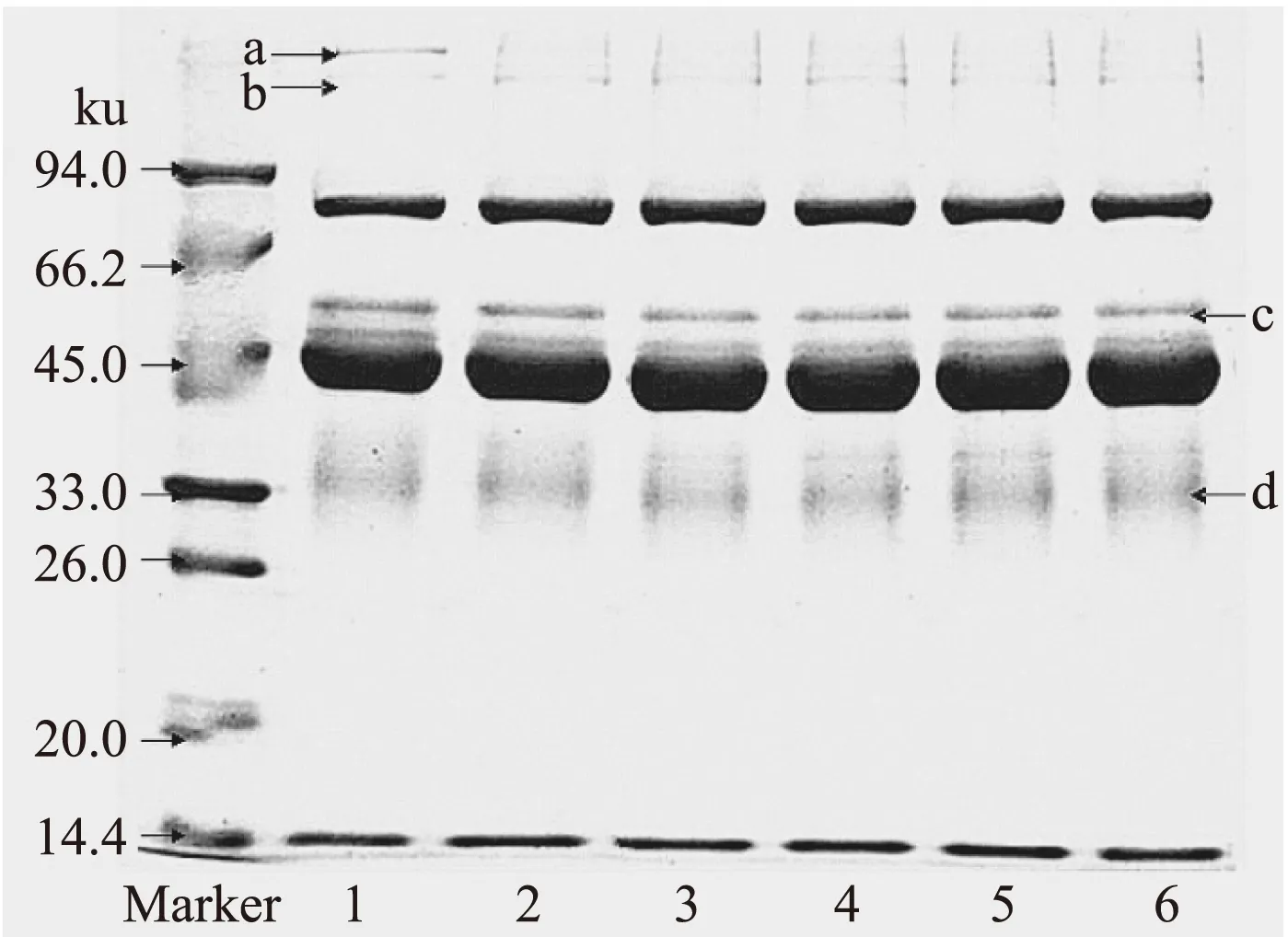
图8 不同NaCl浓度下TGase处理的鸡蛋蛋白SDS-PAGE电泳图Fig.8 The SDS-PAGE electrophoretogram of egg white treated by TGase in different sodium chloride concentration注:泳道1~6分别为NaCl浓度0.1、0.2、0.3、0.4、0.5、0.6mol/L。
2.2.3 不同作用温度条件下SDS-PAGE电泳分析 由图9可知,蛋白质a在温度为25℃时条带最清晰,而在30~50℃时条带逐渐模糊,其中45℃时最不清晰;蛋白质b在温度为25℃时条带最不清晰,而随温度的增加其条带逐渐变得清晰,在温度为40℃时条带最清晰,而温度继续增加其条带又开始模糊;蛋白质c在温度为25℃时条带最清晰,而随温度的增加其条带逐渐减弱,在温度为45℃时条带清晰度最低;蛋白质d在温度为25~40℃时由模糊变得清晰,45~50℃时又逐渐模糊。可能是由于TGase作用的最适温度为40℃;而当温度高于40℃时,可能是由于样品中分子热运动加剧[19],蛋白质本身发生了聚合,因此在TGase的作用下出现了交联过度。
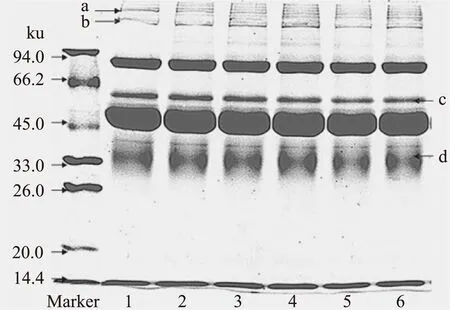
图9 不同作用温度下TGase处理的鸡蛋蛋白SDS-PAGE电泳图Fig.9 The SDS-PAGE electrophoretogram of egg white treated by TGase in different acting temperature注:泳道1~6分别为作用温度是25、30、35、40、45、50℃。
2.2.4 不同pH条件下SDS-PAGE电泳分析 由图10可知,蛋白质a在pH为5时条带最清晰,pH5.5时条带开始变得模糊,在pH为6.0~7.5时条带均不明显;蛋白质b在pH为5.0~6.0时条带逐渐变得清晰,pH6.0~7.0时其条带逐渐模糊,pH7.0时最不清晰,在pH为7.0~7.5时条带有增强。蛋白质c在pH为5.0时条带最清晰,而pH为5.0~7.0时条带逐渐模糊,7.0时最模糊,pH为7.0~7.5时条带增强;蛋白质d在pH为5.0~7.0时条带逐渐变得模糊,7.0时最模糊,7.0~7.5时条带增强。可能是由于TGase对鸡蛋蛋白作用的最适pH为6.0,此时TGase对鸡蛋蛋白的作用最佳;而在pH为7.0时,有利于蛋白质分散,且此时酶活受pH影响而降低,不利于TGase对鸡蛋蛋白的交联作用;当pH超过7.0时,可能由于静电作用[20],抑制了蛋白质分子的随机聚集从而使得分子量相对较小的蛋白数量增加。
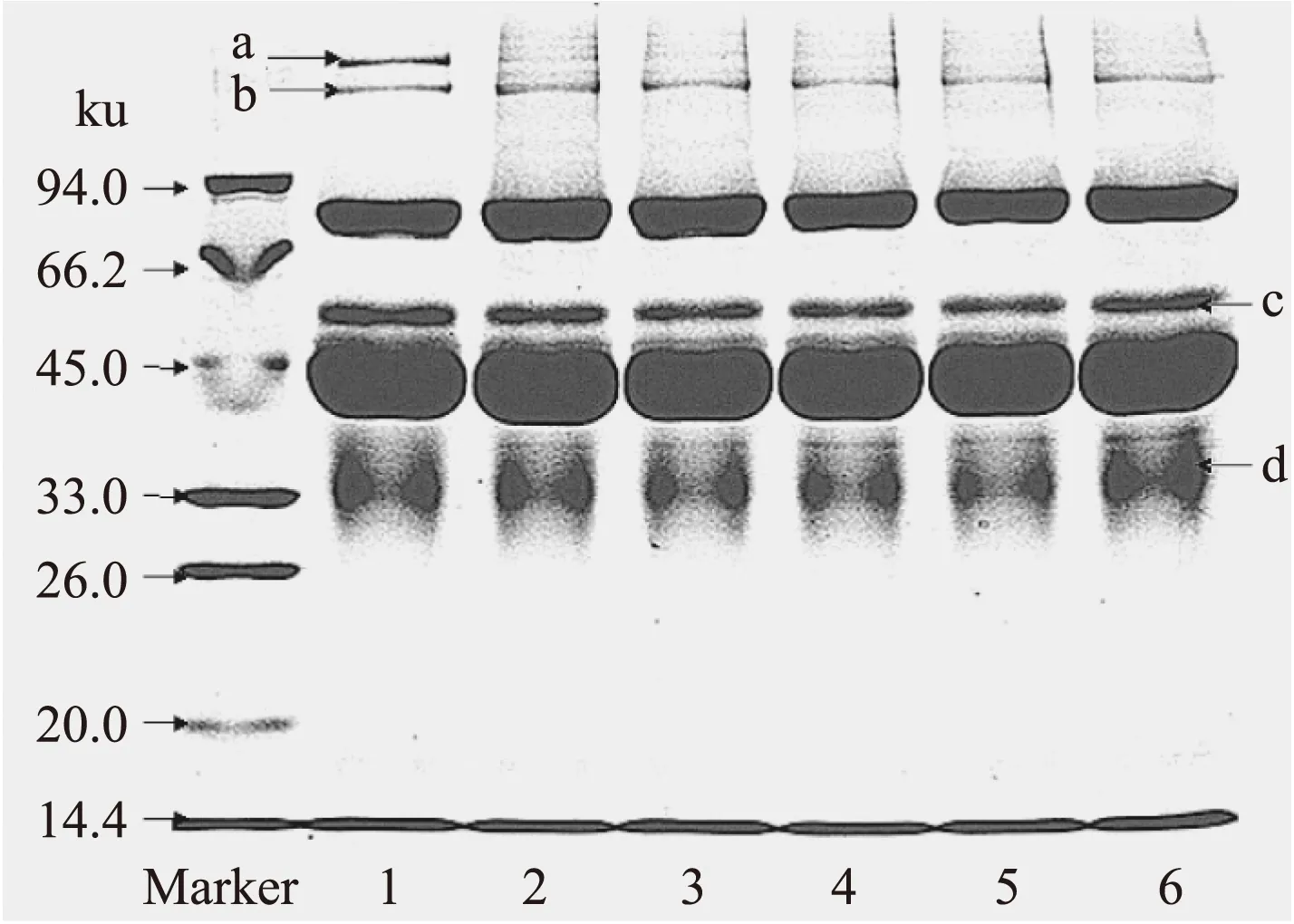
图10 不同pH条件下TGase处理的鸡蛋蛋白SDS-PAGE电泳图Fig.10 The SDS-PAGE electrophoretogram of egg white treated by TGase in different pH value注:泳道1~6分别为pH是5、5.5、6、6.5、7.0、7.5。
2.2.5 不同TGase作用时间下SDS-PAGE电泳分析 由图11可知,蛋白质a在TGase作用时间为0h时条带最明显,而之后条带逐渐变得不明显;蛋白质b在TGase作用时间为0h时条带最不明显,而时间的增加其条带逐渐变得明显,在作用时间为4h时条带最明显,而继续增加作用时间其条带又开始逐渐减弱。蛋白质c在TGase作用时间为0h时条带最明显,随时间的增加其条带逐渐减弱,在作用时间为4h时条带清晰度明显降低,继续增加时间条带仍有减弱但不显著;蛋白质d在TGase作用时间为0~3h时条带变化不显著,而在4~6h时其条带开始减弱,在6h时最弱。可能是由于TGase在一定时间内可使鸡蛋蛋白交联形成分子量相对较大的蛋白质,当作用时间为4h时交联作用达到最大;但随着作用时间的继续增加,样品可能会进一步发生交联[13],使分子量相对较小的蛋白质进一步减少。
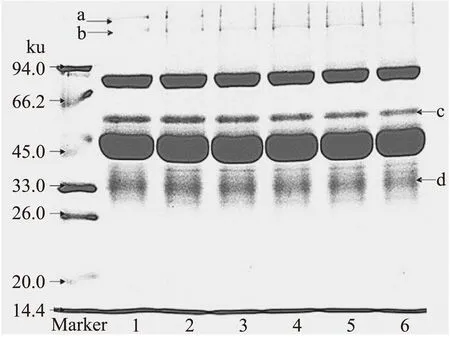
图11 不同酶作用时间作用后TGase处理的鸡蛋蛋白SDS-PAGE电泳图Fig.11 The SDS-PAGE electrophoretogram of egg white treated by TGase in different time注:泳道1~6分别为酶作用时间是0、1、2、3、4、5h。
因此,由以上SDS-PAGE电泳结果表明,TGase添加量、NaCl浓度、酶作用温度、pH、酶作用时间这五个因素都会影响TGase对蛋清中蛋白质的作用。在一定的条件范围内可促进TGase对鸡蛋蛋白的交联作用形成分子量相对较大的分子基团,而在一定条件下不利于TGase对鸡蛋蛋白的交联作用。
2.3 正交实验
在单因素实验的基础上,采用L16(45)正交实验设计(见表1),每个样品设定三个重复,以蛋白凝胶的硬度和保水性作为分析指标,实验结果见表2,方差分析见表3和表4。
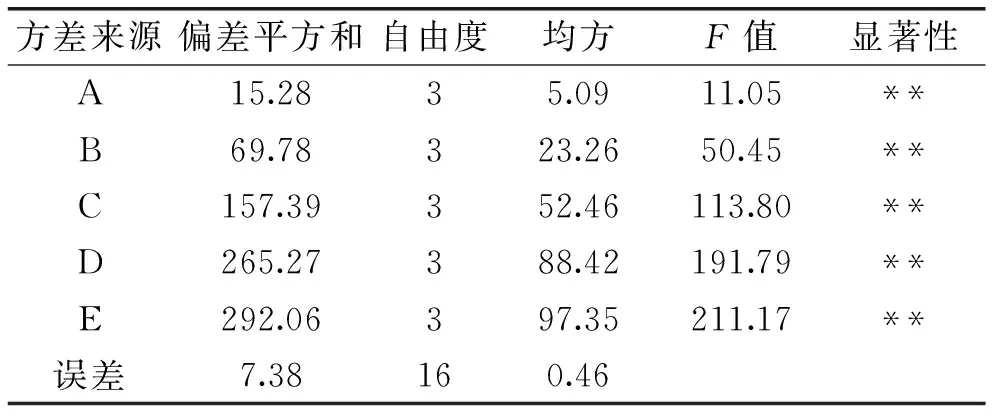
表3 硬度方差分析表Table 3 Variance analysis of gel hardness
注:**表示极显著(p<0.01)。
通过表2中极差分析可知,TGase对鸡蛋蛋白凝胶硬度影响的各因素先后顺序为:E>D>C>B>A,对蛋白凝胶保水性影响的顺序为E>D>C>A>B,且由表3和表4可知,各因素对TGase处理后蛋白凝胶的硬度和保水性影响极显著(p<0.01)。由表2中K和K′值可知,硬度和保水性最佳的组合均为A2B2C1D2E3,此结果与单因素实验所得最佳硬度和保水性组合均为A3B2C2D3E3的结果不一致,可能是由于各因素水平之间的相互影响导致结果有一定的差异。且正交实验组中硬度和保水性最大组均为A2B2C1D4E3,因此有必要对正交实验进行验证实验,实验结果见表5和表6。
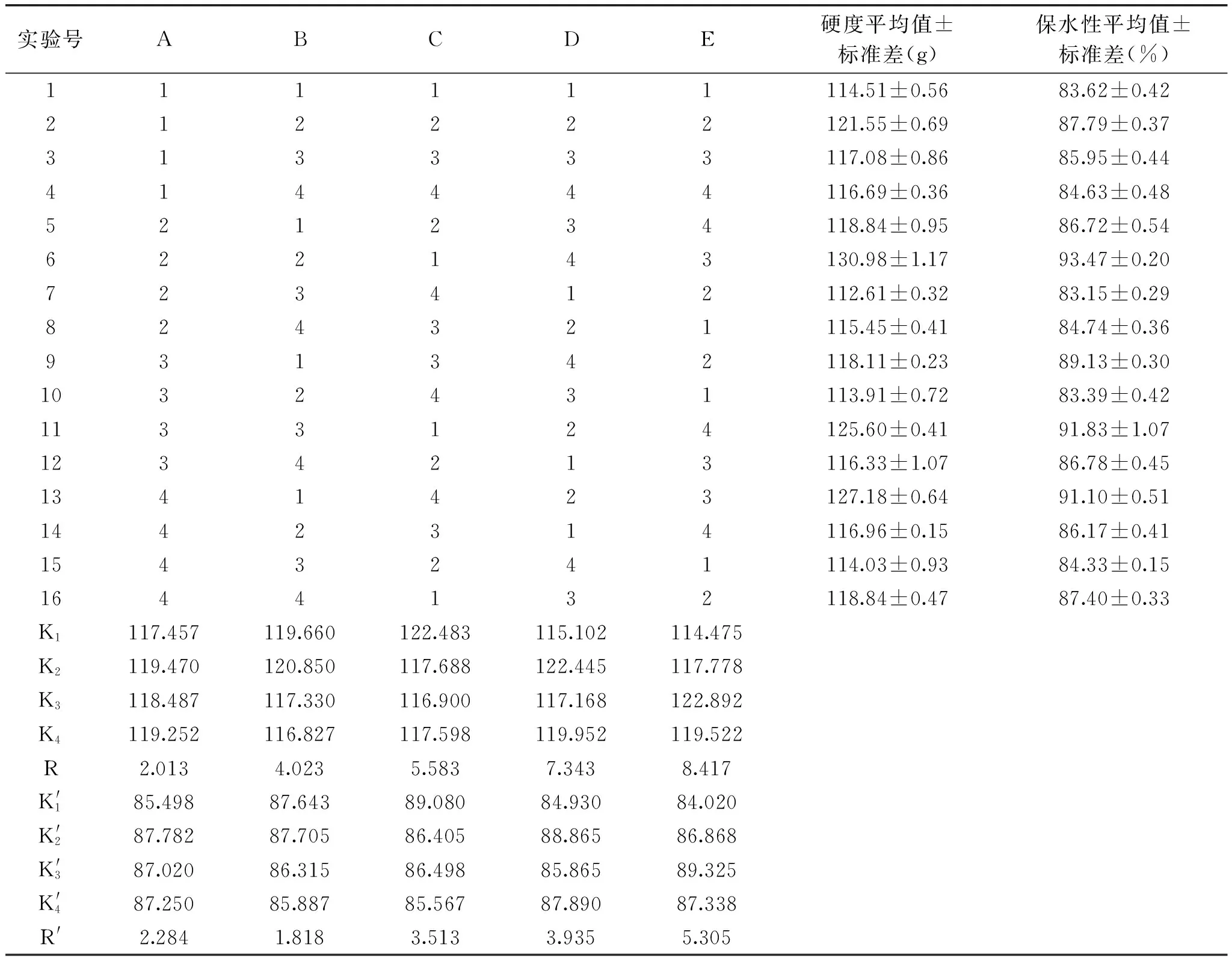
表2 正交实验方案及结果分析Table 2 Results analysis of orthogonal experiment
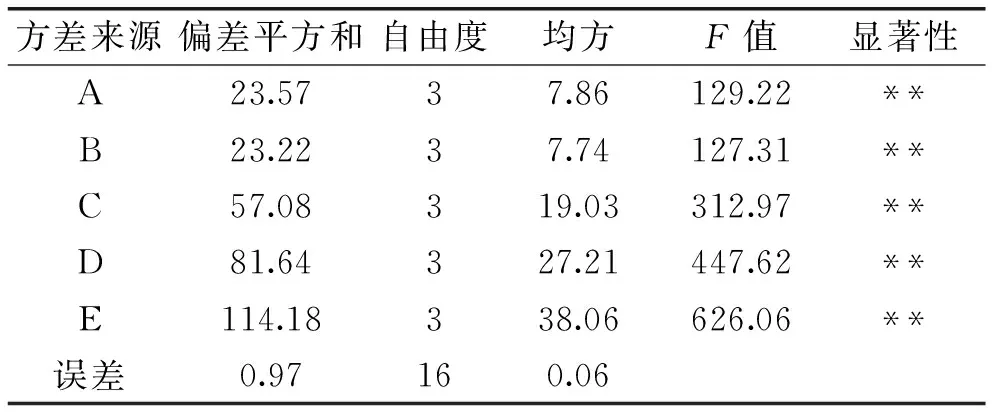
表4 保水性方差分析表Table 4 Variance analysis of water holding capacity
注:**表示极显著(p<0.01)。

表5 硬度验证实验结果(n=3)Table 5 Results of gel hardness confirmatory experiment(n=3)

表6 保水性验证实验结果(n=3)Table 6 Results of water holding capacity confirmatory experiment(n=3)
由表5和表6验证实验结果可知,TGase对鸡蛋蛋白作用使其热诱导形成凝胶硬度最佳的组合为A2B2C1D2E3,即酶作用温度35℃,pH为6.00,TGase添加量为10U/g蛋白质,作用时间为3.5h,NaCl浓度为0.4mol/L,受热凝固所得凝胶硬度最大约为(134.73±1.79)g,保水性最高约为93.83%±0.58%,RSD分别为1.33%和0.62%,表明该优化条件稳定性好,正交实验得以验证。
3 结论
3.1 TGase可使鸡蛋蛋白发生交联,改善鸡蛋蛋白的热凝固性,从而显著提高其凝胶的硬度和保水性。
3.2 TGase对鸡蛋蛋白热凝固性影响的最佳条件为:酶作用温度35℃,pH为6.00,TGase添加量为10U/g蛋白质,酶作用时间为3.5h,NaCl浓度为0.4mol/L。该条件下鸡蛋蛋白凝胶的硬度最大达到(134.73±1.79)g,保水性为93.83±0.58%,比空白组分别提高了58.87%和29.38%。
3.3 通过SDS-PAGE电泳分析得出:TGase添加量、NaCl浓度、酶作用温度、pH、酶作用时间这五个因素都会影响TGase对蛋清中蛋白质的交联作用,从而影响鸡蛋蛋白的热凝固性;TGase对蛋清中蛋白质作用的最适TGase添加量为12U/g蛋白质、最适NaCl浓度为0.4mol/L、最适酶作用温度为40℃、最适pH为6.00以及最适酶作用时间为4h,而这与正交实验所得结论(酶作用温度35℃,TGase添加量为10U/g蛋白质,作用时间为3.5h)存在一定差异,这可能是由于TGase作用于鸡蛋蛋白时受到酶作用温度、酶作用时间和酶添加量之间的交互作用,从而导致SDS-PAGE电泳所得结果与正交实验所得结果存在一定差异。
[1]周长旭,靳红果,辛营营,等. 蛋白质量浓度对鸡蛋热诱导凝胶特性的影响[J]. 食品科学,2012,33(9):118-121.
[2]杨万根,王璋,徐玉娟,等. 蛋清利用研究进展[J]. 食品科学,2009,30(23):456-459.
[3]于志鹏,林松毅,刘静波,等. 优化蛋清粉蛋白热变性条件的研究[J]. 食品科学,2007,28(10):229-232.
[4]赵金平. 蛋清蛋白的干燥加热硒酸化及其功能特性的研究[D]. 昆明:云南大学,2012.
[5]余秀芳. 卤蛋加工技术与品质变化研究[D]. 武汉:华中农业大学,2011.
[6]刘海梅,鲍军军,熊善柏,等. 鸡蛋清蛋白对微生物转谷氨酰胺酶诱导鲢鱼鱼糜凝胶形成的影响[J]. 食品科学,2010,31(11):102-104.
[7]Wang F,Huang W,Kim Y,et al. Effects of transglutaminase on the rheological and noodle-making characteristics of oat dough containing vital wheat gluten or egg albumin[J]. Journal of Cereal Science,2011,54(1):53-59.
[8]邵虎,陶红军,黄亚东,等. 谷氨酰胺转氨酶的研究进展[J]. 中国酿造,2010,29(6):9-12.
[9]张念荣,党传玉,王全杰. 谷氨酰胺转胺酶的特性及其应用研究进展[J]. 西部皮革,2012,34(14):36-40.
[10]Bellido G G,Hatcher D W. Effects of a cross-linking enzyme on the protein composition,mechanical properties,and microstructure of Chinese-style noodles[J]. Food Chemistry,2011,125(3):813-822.
[11]胡春霞,叶梦情,易明花. 新型食品添加剂谷氨酰胺转胺酶的生产及应用研究进展[J]. 安徽农业科学,2013,41(12):5498-5501.
[12]徐幸莲,程巧芬,周光宏. 转谷氨酰胺酶对蛋白质凝胶性能的影响[J]. 食品科学,2003,24(10):38-43.
[13]王然,迟玉杰. 转谷氨酰胺酶提高蛋清粉凝胶性能的研究[J]. 食品与发酵工业,2010,36(2):109-113.
[14]王孝平,邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J].天津化工,2009,23(3):40-42.
[15]李俐鑫,迟玉杰,孙波. 蛋清蛋白质凝胶质构特性的研究[J]. 食品工业科技,2007,28(8):57-60.
[16]贾丹,刘茹,刘明菲,等. 转谷氨酰胺酶对鳙鱼糜热诱导胶凝特性的影响[J]. 食品科学,2013,34(9):37-41.
[17]Panozzo A,Manzocco L,Calligaris S,et al. Effect of high pressure homogenisation on microbial inactivation,protein structure and functionality of egg white[J]. Food Research International,2014,62:718-725.
[18]Raikos V,Campbell L,Euston S R. Rheology and texture of hen’s egg protein heat-set gels as affected by pH and the addition of sugar and/or salt[J]. Food Hydrocolloids,2007,21(2):237-244.
[19]Christ D,Takeuchi K P,Cunha R L. Effect of sucrose addition and heat treatment on egg albumen protein gelation[J]. Journal of Food Science,2005,70(3):230-238.
[20]Ferreira Machado F,Coimbra J S R,Garcia Rojas E E,et al. Solubility and density of egg white proteins:Effect of pH and saline concentration[J]. LWT-food Science and Technology,2007,40(7):1304-1307.
Effect of transglutaminase on the heat coagulation of egg white
LEI Ming-hui,YE Jin-song*,ZHANG Ming-rong,LI Zhi,LI Rui,XIAO Meng,ZHANG Zi-li,LI Xin-yang,ZHENG Bo-hong
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
The effect of sodium chloride concentration,pH,enzyme acting temperature,time and its adding amount on the gel hardness and water holding capacity of egg white treated by transglutaminase were studied in this experiment. The SDS-PAGE electrophoresis was used to analyze the protein crosslinking after enzyme treatment to explore the mechanism of transglutaminase on heat coagulation of egg white. The results showed that the gel hardness and water holding capacity of egg white was increased significnatly after TGase treatment(p<0.01).When sodium chloride concentration was 0.4mol/L,pH was 6.0,temperature was 35℃,acting time was 3.5h and the TGase addition was 10U/g protein,the value of gel hardness and water holding capacity of egg white reached their maximum value of(134.73±1.79)g and 93.83%±0.58%,which were 58.87% and 29.38% higher than that of control group,respectively. The SDS-PAGE electrophoresis analysis showed:TGase could contribute to the crosslinking of protein molecules in egg white under certain conditions,which improved the heat coagulation of egg white.
transglutaminase;egg white;heat coagulation
2014-08-06
雷明辉(1988-),男,硕士,研究方向:蛋品贮藏及加工。
*通讯作者:叶劲松(1967-),男,硕士,副教授,研究方向:蛋品贮藏及加工。
TS253.2
A
1002-0306(2015)13-0143-07
10.13386/j.issn1002-0306.2015.13.021
