三明野生蕉β-1,3葡聚糖酶基因克隆及其低温下SA处理后的表达分析
2015-05-05陈芳兰林玉玲陈裕坤张梓浩赖钟雄
陈芳兰,林玉玲,陈裕坤,冯 新,张梓浩,赖钟雄
(福建农林大学 园艺植物生物工程研究所/园艺学院,福州 350002)
三明野生蕉β-1,3葡聚糖酶基因克隆及其低温下SA处理后的表达分析
陈芳兰,林玉玲,陈裕坤,冯 新,张梓浩,赖钟雄*
(福建农林大学 园艺植物生物工程研究所/园艺学院,福州 350002)
以三明野生蕉(Musaspp.AB group)为材料,利用RT-PCR和RACE技术,克隆获得β-1,3葡聚糖酶5个基因(Mugsp1.2~Mugsp5)的cDNA和DNA序列。序列和生物信息学分析表明Mugsp1.2、Mugsp2、Mugsp3、Mugsp4和Mugsp5的ORF长度分别为1 020、1 047、999、1 023和960 bp,分别编码339、348、332、340和319个氨基酸;Mugsp1.2、Mugsp2和Mugsp4蛋白具有N端和C端(CTPP)信号肽结构,推测为Ⅰ类β-1,3葡聚糖酶,而Mugsp3只含有N端信号肽,无CTPP结构,Mugsp5则不具有信号肽结构;构建Mugsp1.2、Mugsp2、Mugsp4瞬时表达载体并转化洋葱表皮的亚细胞定位观察结果显示,常温下Mugsp1.2、Mugsp2和Mugsp4主要在细胞膜、细胞质上表达,而经过8 ℃低温处理后Mugsp1.2、Mugsp2和Mugsp4均能够转移至细胞核表达;β-1,3葡聚糖酶基因在不同低温处理下的实时荧光定量(qRT-PCR)检测结果显示,β-1,3葡聚糖酶基因均能响应低温胁迫,是低温胁迫相关基因,但基因间表达水平存在差异;低温下SA处理后的定量结果显示,SA处理会推迟β-1,3葡聚糖酶基因的表达。
三明野生蕉;β-1,3葡聚糖酶;水杨酸;低温胁迫;亚细胞定位;实时荧光定量PCR
香蕉是芭蕉科(Musaceac)芭蕉属(Musa)植物,是重要的观赏植物和粮食作物。栽培香蕉适于在热带亚热带地区种植,低温寒害会造成香蕉严重的叶片果实损伤,在观赏和生产应用上受到严重限制[1-2]。研究发现,野生蕉具有较强耐寒性和抗病性,与栽培香蕉相比,能够在温度更低,环境更恶劣的条件下生长,因此充分开发利用野生蕉的优良特性,对改良香蕉种质资源具有重要意义[3-5]。
植物在受到非生物胁迫(机械伤害、高温、低温、盐胁迫等)时,除了会产生生理生化上的应激反应抵抗环境胁迫外,还会形成一系列的信号传导途径,激活逆境相关基因的表达,诱导包括β-1,3葡聚糖酶在内的一系列抗逆蛋白来提高植物抵御环境伤害的能力[6-9]。β-1,3葡聚糖酶所属的PR-2蛋白是一类重要的病程相关蛋白[10],在抵抗真菌侵染、病虫害、环境胁迫等方面具有重要作用[11-13]。β-1,3葡聚糖酶根据其进化关系、蛋白质定位、功能和理化性质等特点,可分为4类:Ⅰ类蛋白含有一个与液泡定位相关的C-端信号肽延伸结构(CTPP),通常定位于液泡上,主要由碱性蛋白组成,能够被病原体、乙烯、紫外线照射及伤害诱导等表达,但受细胞分裂素和生长素的抑制;Ⅱ、Ⅲ、Ⅳ类由于不含有CTPP结构通常定位在细胞间隙和细胞外,一般为酸性蛋白,酸性蛋白能够受到病原体、细胞分裂素、水杨酸等诱导表达[13-17]。目前对β-1,3葡聚糖酶在植物抗寒作用方面的研究相对较少,张妙霞[4]对野生蕉抗寒机理展开了初步研究,并在28 ℃常温和15 ℃下处理30 h后转入4 ℃处理64 h的低温条件下,克隆到三明野生蕉碱性β-1,3葡聚糖酶基因Mugsp和Mugsp1,进行相关的生物信息学和定量表达分析后,推测Mugsp和Mugsp1是抗寒相关基因。
水杨酸(SA)是普遍存在于高等植物体中的内源激素,广泛参与植物的生长发育,同时也是响应植物环境伤害的重要信号因子,研究表明,外施SA能够缓解病虫害、高温、低温、重金属胁迫、盐胁迫等造成的植物伤害[18-19]。近年来的研究表明,在非生物胁迫方面,SA能通过NP1-independent途径,促进抗氧化酶及保护酶相关基因如SOD、APX、GST、HSP、AOX、LEA等的表达来清除植物体内的过氧化物;也能通过NP1-dependent途径诱导PR相关基因如葡聚糖酶基因、几丁质酶基因等的表达,共同提高植物抗性,促进植物体抵御环境胁迫的能力[20]。在SA缓解植物低温胁迫方面,目前人们集中于SA作用于NP1-independent途径的研究,在香蕉幼苗、甘蓝幼苗、茄子幼苗、西洋杜鹃、黄瓜幼苗、水稻幼苗等不同科属植物上均有报道[21-28]。对NP1-dependent途径,即SA在低温下诱导病程相关基因表达的研究较少,Chang-Kui Ding[17]的研究表明,水杨酸及茉莉酸能够诱导低温处理番茄果实中PR2和PR3基因的表达。本试验通过克隆获得5条三明野生蕉β-1,3葡聚糖酶基因,分别为编码酸性β-1,3葡聚糖酶的Mugsp2、Mugsp3、Mugsp5以及编码碱性β-1,3葡聚糖酶的Mugsp1.2、Mugsp4,之后进行了基因的碱基序列、氨基酸序列及生物信息学的分析;对Mugsp1.2、Mugsp2、Mugsp4进行洋葱表皮亚细胞定位观察;分析不同低温及SA处理后β-1,3葡聚糖酶基因的定量表达情况,探讨β-1,3葡聚糖酶基因的低温表达机制。
1 材料和方法
1.1 供试材料
试验所用三明野生蕉组培苗由福建农林大学园艺植物生物工程研究所继代保存。
1.2 方 法
1.2.1 β-1,3葡聚糖酶基因的克隆及序列分析 以13 ℃处理36 h的三明野生蕉组培苗叶片为材料,参照天泽RNA提取试剂盒说明书进行总RNA的提取,并根据Thermo公司的RevertAid First Strand cDNA Synthesis Kit试剂盒说明书合成cDNA,作为基因克隆模板。采用CTAB法进行三明野生蕉组培苗叶片DNA的提取。将Mugsp和Mugsp1的cDNA序列作为目标序列在小果野蕉基因组数据库(http://banana-genome.cirad.fr/home)中Blast,选取结果最靠前的5条β-1,3葡聚糖酶基因序列作为参考序列进行同源克隆,使用DNAMAN设计不同基因间包含有开放阅读框(ORF)的引物,用于cDNA及DNA的克隆,其中Mugsp1.2的ORF扩增采用张妙霞设计的引物序列。3′端非编码区克隆采用RACE巢式PCR技术,根据已经获得的cDNA序列,设计2条3′-RACE引物,以auap为下游引物进行扩增。PCR反应体系及扩增程序参考赖恭梯[29]的方法做适当调整。引物序列、退火温度和用途见表1。PCR产物经过电泳、回收、TA克隆后,将阳性克隆子送至铂尚公司测序。测序结果采用DNAMAN、MEGA和ProParam、SignalP 4.0、TMpred、PSORT、NCBI-ProteinTools、Motif在线分析软件对其核苷酸和氨基酸序列进行分析。
1.2.2 亚细胞定位观察 对所获得的其中3个β-1,3葡聚糖酶基因(Mugsp1.2、Mugsp2、Mugsp4)的ORF序列进行限制性内切酶分析,在基因编码区的起始密码子和终止密码子处分别设计带酶切位点NcoⅠ和SpeⅠ的上下游引物见表1,PCR扩增获得带酶切位点的ORF片段。采用限制性内切酶NcoⅠ和SpeⅠ分别双酶切pCAMBIAl302-GFP质粒及Mugsp1.2、Mugsp2、Mugsp4的PCR产物(酶切体系参照Thermo酶切说明书)后,经T4DNA 连接酶连接,获得35S-Mugsp1.2-GFP、35S-Mugsp2-GFP、35S-Mugsp4-GFP重组质粒,并送铂尚公司测序以验证载体构建正确。采用冻融法将重组质粒导入LBA4404农杆菌,使用农杆菌介导法侵染洋葱表皮细胞[30]。将侵染的洋葱表皮材料,一部分置于25 ℃培养2~3 d后使用共聚焦成像仪观察基因的亚细胞定位,另一部分在25 ℃培养2 d后转移到8 ℃继续培养20 h,使用1 μg/mL DAPI染色后再进行亚细胞定位的观察。

表1 基因克隆、亚细胞定位以及荧光定量PCR引物序列Table 1 List of primers used in gene cloning,subcellular localization,QRT-PCR
注:下划线为酶切位点,黑体部分为保护性碱基。
Note:The restriction enzyme cutting sites were pointed out by underlines and protective bases were appeared in bold.
1.2.3 实时荧光定量表达分析 将生长健壮且长势相近的三明野生蕉组培苗,分别经不同温度(28 ℃、20 ℃、13 ℃、4 ℃、0 ℃、-2 ℃、-4 ℃、-6 ℃)下处理36 h,8 ℃低温下处理1、4、8、12和24 h,8 ℃低温下喷施0.5 mmol/L SA处理1、4、8、12和24 h后,取叶片于液氮速冻,置于-80 ℃保存,用于RNA提取。每个处理重复3次。参照SYBR Ex-ScriptTM试剂盒将提取的总RNA逆转录成cDNA,用于荧光定量表达分析。分别在Mugsp、Mugsp1的跨内含子区域,Mugsp1.2区别于Mugsp、Mugsp1的外显子区域设计特异性引物,Mugsp2和Mugsp4在靠近终止密码的区域设计上游引物,3′-UTR区域设计下游引物,在Mugsp3的ORF区域,Mugsp5的5′-UTR区域分别设计上下游引物,引物序列见表1。以18S为内参基因[4]。反应体系和扩增程序参考赖恭梯方法[29]做适当调整。使用荧光定量PCR仪LightCycler 480(Roche)进行扩增。将不同处理的cDNA样本的混合物稀释不同倍数作为模板制作标准曲线,获得E值在1.9~2.1之间,并验证引物特异性,得到单峰溶解曲线。扩增反应结束后,数据处理按照Pfaffi法,采用Excel计算基因相对表达量。每试验3次独立重复。
2 结果与分析
2.1 三明野生蕉β-1,3葡聚糖酶基因cDNA和DNA序列的获得
表2显示,以合成的经13 ℃处理36 h的三明野生蕉组培苗叶片cDNA为模板,经 PCR扩增得到5个单一片段,长度分别为1 122、1 181、1 198、1 120和1 292 bp。测序结果分析显示,这5条序列均带有完整ORF区,分别为1 020、1 047、999、1 023和960 bp。Blastn和功能结构域分析显示,这5条片段与其他物种β-1,3葡聚糖酶基因序列高度一致,编码蛋白均具有糖基水解酶第17保守特征结构域[LIVM].[LIVMFYWA]{3}[STAG]E[STA]GWP[STN].[SAGQ][13]。说明它们为三明野生蕉的β-1,3葡聚糖酶基因,分别命名为Mugsp1.2、Mugsp2、Mugsp3、Mugsp4和Mugsp5。之后进行3′-UTR巢式扩增,获得Mugsp1.2、Mugsp2 3′-UTR长度分别为81和134 bp。 最后以三明野生蕉叶片DNA为模板,克隆获得Mugsp2、Mugsp3、Mugsp4、Mugsp5 DNA序列,长度分别为1 207、1 198、1 211和1 292 bp(表2)。
2.2 三明野生蕉与小果野蕉β-1,3葡聚糖酶基因序列比对分析
以三明野生蕉为材料,克隆获得的β-1,3葡聚糖酶基因序列。结果分析显示,β-1,3葡聚糖酶基因间具有较高相似性,为80.52%(ORF),Mugsp3和Mugsp5无内含子结构,而Mugsp1.2、Mugsp2和Mugsp4均包含1个内含子,2个外显子,内含子剪接均符合GT-AG剪切规则(图1)。
三明野生蕉与小果野蕉的β-1,3葡聚糖酶基因序列比对发现,Mugsp1.2、Mugsp2、Mugsp3、Mugsp4和Mugsp5分别与小果野蕉β-1,3葡聚糖酶基因GSMUA_Achr10T01250_001、GSMUA_Achr8T22040_001 、GSMUA_Achr8T22450_001 、GSMUA_Achr3T08030_001和GSMUA_Achr8T22440_001具有高度相似性,但在基因内含子剪接和翻译位点上存在较大差异(图1)。Mugsp1.2与GSMUA_Achr10T01250_001有着相同的内含子剪切位点,编码基本一致的氨基酸序列;Mugsp2和Mugsp4 与GSMUA_Achr8T22040_001和GSMUA_Achr3T08030_001不同的内含子剪切位点,使得Mugsp2和Mugsp4形成更长的转录本,从而编码更长的氨基酸序列;而翻译起始位点的不同使得Mugsp3、Mugsp5比GSMUA_Achr8T22450_001、GSMUA_Achr8T22440_001编码更短的氨基酸序列。这种基因结构的差异,使得三明野生蕉与小果野蕉形成不同的β-1,3葡聚糖酶基因转录本,从而导致翻译的β-1,3葡聚糖酶在结构和功能上存在差别。

表2 β-1,3葡聚糖酶基因cDNA及DNA序列信息Table 2 The information of β-1,3-glucanase cDNA and DNA sequences

图1 三明野生蕉及小果野蕉β-1,3葡聚糖酶基因结构示意图
将Mugsp1.2与Mugsp(915 bp) 和Mugsp1(951 bp)[4]对比发现,Mugsp1.2 比Mugsp、Mugsp1多出104和69 bp碱基,其余部分基本匹配。观察基因结构(图1)发现,Mugsp1.2比Mugsp和Mugsp1多出的片段正好与位于Mugsp-DNA、Mugsp1-DNA中与外显子相接的内含子片段相吻合,并且Mugsp1.2、Mugsp、Mugsp1中,只有Mugsp1.2符合GT-AG内含子剪切规则。因此认为Mugsp1.2、Mugsp、Mugsp1是来自于同一基因的不同转录本,但是Mugsp1.2才是Mugsp1.2、Mugsp、Mugsp13个基因中的正常转录本,Mugsp、Mugsp1可能是外显子缺失型的可变剪接体[31-33]。即Mugsp在剪切时将连接内含子5′和3′端的51和53 bp外显子一同切除,Mugsp1在剪切时则将连接内含子3′端的69 bp外显子切除。
2.3 三明野生蕉β-1,3葡聚糖酶生物信息学分析
利用DNAMAN将克隆获得的β-1,3葡聚糖酶基因序列翻译成氨基酸序列,进行生物信息学分析, Mugsp1.2、Mugsp4属于碱性β-1,3葡聚糖酶,Mugsp2、Mugsp3、Mugsp5属于酸性β-1,3葡聚糖酶(表3)。5个β-1,3葡聚糖酶基因富含的氨基酸情况为(氨基酸含量大于8%):Mugsp1.2富含Ala 11.2%、Ser 9.7%、Val 9.7%、Gly 8.3%和Leu 8.3%,Mugsp2富含Ala 10.6%、Ser 11.8%和Val 9.5%;Mugsp3富含Asn 8.4%、Leu 9.3%、Ser 11.1%和Val 10.8%,Mugsp4富含Ala 11.5%、Val 10.9%和Ser 8.8%的氨基酸,Mugsp5富含Ala 9.4%、Leu 8.5%和Ser 8.8%。分析氨基酸序列比对图(图2),结果显示Mugsp1.2、Mugsp2和Mugsp4均编码有21个氨基酸组成的N端前导信号肽序列,并且具有C端延伸信号肽序列(CTPP)结构的N-糖基水解酶位点,推测Mugsp1.2、Mugsp2和Mugsp4属于Ⅰ类β-1,3葡聚糖酶,而Mugsp3只含有N端信号肽,无CTPP结构,Mugsp5不具有信号肽结构,因此Mugsp3和Mugsp5可能归于后三类β-1,3葡聚糖酶[15,16,34]。将三明野生蕉β-1,3葡聚糖酶基因与多个物种的β-1,3葡聚糖酶氨基酸序列进行进化树分析(图3),结果可以分为2大分支体系,Ⅰ类Mugsp1.2、Mugsp2、Mugsp4与拟南芥(Arabidopsisthaliana)β-1,3葡聚糖酶基因BG1(AT3G57270.1)、BG2(AT3G57260.1)、BG3(AT3G57240.1)、BETAG4(AT5G20330.1)、BG5(AT5G20340.1)处于同一分支体系,进化关系较近,其中碱性Mugsp1.2、Mugsp4与生姜(Zingiber)亲缘关系最接近,酸性Mugsp2与豆科的田菁(Sesbaniarostrata)亲缘关系最接近;Mugsp、Mugsp1、Mugsp3、Mugsp5则与海棠(Jatrophacurcas)、橡胶树(Heveabrasiliensis)、无油樟(Amborellatrichopoda)独立为另一分支体系。
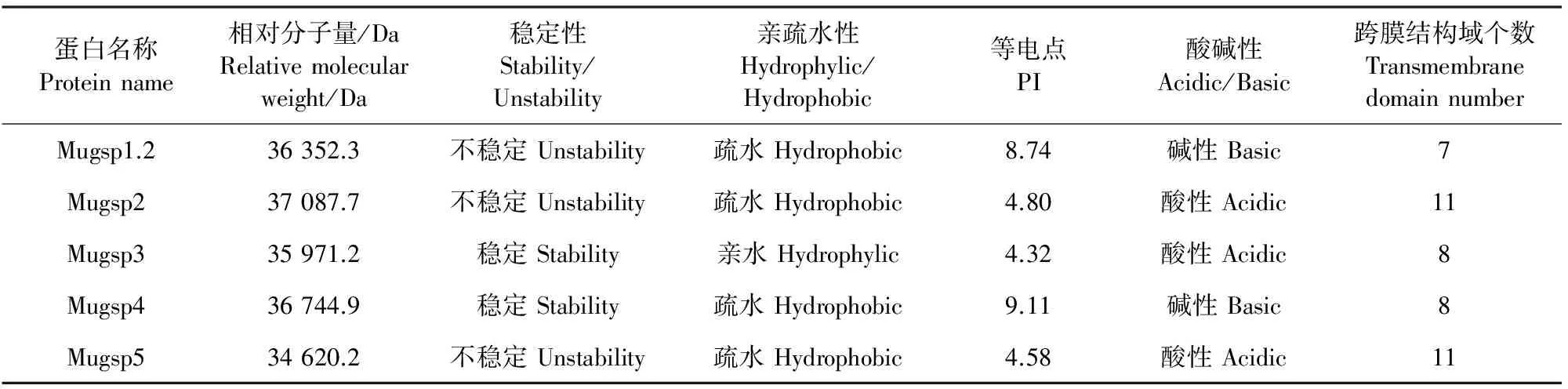
表3 β-1,3葡聚糖酶基因翻译的氨基酸序列特征Table 3 The amino acid sequence characteristics of β-1,3-glucanase genes

图2 β-1,3葡聚糖酶基因间的氨基酸序列比对图
2.4Mugsp1.2、Mugsp2、Mugsp4的亚细胞定位分析
利用PSORT预测Mugsp2主要在细胞质膜和内质网膜表达,而Mugsp1.2和Mugsp4在细胞外表达。试验中根据GFP荧光蛋白信号在洋葱表皮上的分布,观察Mugsp1.2、Mugsp2和Mugsp4常温和低温处理下亚细胞定位。常温处理结果(图4)显示,Mugsp1.2-GFP、Mugsp2-GFP和Mugsp4-GFP蛋白主要分布在细胞膜、细胞质上,GFP空载体蛋白在细胞核、细胞质、细胞膜、细胞间隙处均有分布;8 ℃低温处理结果(图5)显示,经核染料DAPI染色过的洋葱表皮细胞核呈现蓝色荧光信号, Mugsp1.2-GFP、Mugsp2-GFP和Mugsp4-GPF融合表达载体的绿色荧光信号除了分布在细胞膜和细胞质外,还与DAPI染色的核荧光信号重叠,说明Mugsp1.2-GFP、Mugsp2-GFP和Mugsp4-GPF在低温下均能够转移至细胞核表达。

图3 三明野生蕉及其他物种β-1,3葡聚糖酶的系统进化树分支上的数字代表1 000次Bootstrap重复验证中该节点的可信度百分比值
2.5 低温处理下β-1,3葡聚糖酶基因表达分析
利用实时荧光定量,检测不同温度处理下,三明野生蕉β-1,3葡聚糖酶基因的表达水平。结果(图6)显示,随着温度降低,Mugsp、Mugsp1和Mugsp1.2呈现“先升高后降低”的表达趋势,Mugsp2、Mugsp3、Mugsp4和Mugsp5呈现“先降低后升高再降低”的表达趋势;Mugsp、Mugsp1.2、Mugsp2和Mugsp5在4 ℃时达到表达高峰,表达量分别为常温的2.5、2.2、3.5和1.4倍左右,而Mugsp1、Mugsp3和Mugsp4在0 ℃表达量达到最高,分别为常温的2.7、5和4.5倍左右。总体上,Mugsp、Mugsp2、Mugsp4和Mugsp5对温度变化的响应较为平缓,表达量较低,而Mugsp1、Mugsp1.2和Mugsp3对温度变化响应剧烈,表达量较高。说明β-1,3葡聚糖酶基因均能够响应低温胁迫改变表达量,但是基因间的表达趋势和表达水平存在差异。
2.6 低温下SA处理后β-1,3葡聚糖酶基因表达分析
对三明野生蕉组培苗进行8 ℃低温及8 ℃下喷施SA处理,处理时间为0~24 h。实时荧光定量结果(图7)显示,β-1,3葡聚糖酶基因能够在8 ℃低温处理1~4 h内显著提高表达量,其中Mugsp、Mugsp1和Mugsp1.2在低温处理1 h时达到高峰,而Mugsp2、Mugsp4和Mugsp5在处理4 h时达到高峰。8 ℃低温下喷施SA则推迟了β-1,3葡聚糖酶基因的表达,使得Mugsp、Mugsp1和Mugsp1.2在处理12 h时达到最高,且高于未喷施SA达到高峰时的表达量,而Mugsp2、Mugsp4和Mugsp5在SA处理12 h后开始升高,并且在处理24 h时已显著超过未喷施SA所达到的表达高峰。说明β-1,3葡聚糖酶基因对低温的响应呈现较为敏感的即时效应,均能在短时间内快速提高表达水平,并且在低温下能够被SA调控表达。

图4 常温下Mugsp1.2、Mugsp2和Mugsp4在洋葱表皮细胞中的亚细胞定位

图5 8℃低温处理后Mugsp1.2、Mugsp2和Mugsp4在洋葱表皮细胞中的亚细胞定位
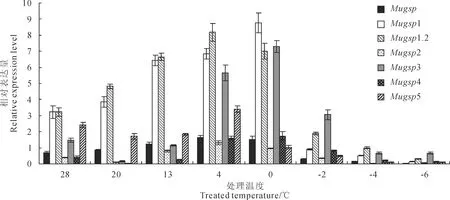
图6 β-1,3葡聚糖酶基因在不同温度下处理36 h的相对表达

图7 β-1,3葡聚糖酶基因不同处理下的相对表达量A、B、C分别为常温28 ℃、8 ℃、8 ℃+SA处理0~24 h的β-1,3葡聚糖酶基因相对表达量
3 讨 论
3.1 β-1,3葡聚糖酶基因的可变剪接可能参与低温胁迫相关反应
β-1,3葡聚糖酶基因是一类重要的逆境胁迫相关基因[35]。本试验通过对三明野生蕉β-1,3葡聚糖酶基因进行不同处理的定量表达结果分析表明,β-1,3葡聚糖酶基因均能够响应低温胁迫,是低温胁迫相关基因,在抗寒中起到重要作用。β-1,3葡聚糖酶基因对低温胁迫的响应可分为2种类型:Mugsp、Mugsp1,Mugsp1.2对低温响应更为敏感(8 ℃处理1 h即达到表达高峰),随着温度的降低,能够迅速启动抗寒响应机制,呈现直接“升高后降低”的表达趋势;而Mugsp2、Mugsp3、Mugsp4和Mugsp5对低温表现出一段时间的适应过程(8 ℃处理4 h达到表达高峰),随着温度的降低呈现“先降低后升高再降低”的表达趋势。总体上β-1,3葡聚糖酶基因均能够相继在4 ℃和0 ℃处理下达到表达高峰,推测低温胁迫下,β-1,3葡聚糖酶基因能够分工协作,协同表达提高植物抵抗低温伤害的能力。研究表明可变剪接现象在真核生物界普遍存在,环境胁迫能够激发基因不同可变剪接体的表达,从而上调相关蛋白的表达水平,增强植物抵抗逆境的能力[36-38]。本试验发现,不同低温处理诱导了Mugsp、Mugsp1和Mugsp1.2三个剪接体的表达,剪接位点的差异使得Mugsp、Mugsp1、Mugsp1.2在植物体中的转录水平和对低温的响应水平上存在差异:总体上Mugsp1、Mugsp1.2的转录水平远高于Mugsp,推测Mugsp与内含子5端相接部分的可变外显子片段缺失可能是造成Mugsp比Mugsp1、Mugsp1.2转录水平低的关键;低温处理下Mugsp、Mugsp1.2在4 ℃表达量最高,而Mugsp1在0 ℃时才达到最高表达量,可能Mugsp、Mugsp1.2与Mugsp1具有差异的3端可变剪接片段对调控基因响应低温胁迫起到重要作用。
3.2 低温诱导Mugsp1.2、Mugsp2、Mugsp4的亚细胞定位改变从而提高抗寒性
本试验利用共聚焦显微镜观察到常温下,Ⅰ类β-1,3葡聚糖酶基因Mugsp1.2、Mugsp2、Mugsp4不仅定位于膜系统,还有少量定位在细胞质中。研究表明,许多基因并不只存在一种蛋白定位,如NRIP1、NPR1等一些R基因的多种定位是其能够执行功能的关键[39,40]。推测β-1,3葡聚糖酶在细胞膜系统及细胞质的分布使得β-1,3葡聚糖酶可能执行蛋白转运及信号传递等功能。此外许多基因能够被代谢干扰、信号传导、环境改变等刺激改变其亚细胞定位[39-42]。如拟南芥中,定位于内质网的β-1,3葡聚糖酶AtBG2在SA处理下能够分泌到质外体中[43]。本试验对Mugsp1.2、Mugsp2、Mugsp4的亚细胞定位试验进行了低温处理,观察低温对Mugsp1.2、Mugsp2、Mugsp4表达的影响,结果显示8 ℃低温处理下Mugsp1.2、Mugsp2、Mugsp4均能够转移至细胞核表达,结合定量结果Mugsp1.2、Mugsp2、Mugsp4从13 ℃到4 ℃处理之间的基因表达量急剧升高,推测Mugsp1.2、Mugsp2、Mugsp4基因在低温下大量表达,一部分翻译成抗逆蛋白直接参与抗寒作用,另一部分则转移至细胞核,作为其他低温胁迫相关基因的信号传导因子起调控作用。相关作用机理已有报道,如在拟南芥中,EDS1对抗病基因的诱导需要在定位于细胞核的RPS4基因的调控下才能起作用[44]。因此推测Mugsp1.2、Mugsp2、Mugsp4的抗寒途径及作用方式并不是唯一的,而是与其他抗寒调节相关因子形成复杂的调控网络从而共同抵抗植物的低温胁迫。
3.3 低温下SA调控β-1,3葡聚糖酶基因表达的可能机制
Tomoya Niki等[45]认为SA是碱性β-1,3葡聚糖酶基因的抑制因子,是酸性β-1,3葡聚糖酶基因的激发因子,反之JA是碱性β-1,3葡聚糖酶基因的激发因子,是酸性β-1,3葡聚糖酶基因的抑制因子,植物受到机械伤害下,内源SA不会变化,而JA能够积累,因此机械伤害会促进碱性β-1,3葡聚糖酶基因的表达,但不会诱导酸性β-1,3葡聚糖酶基因表达。而Chang-Kui Ding[17]用低温处理西红柿果实0~28 d发现,SA和JA都能够促进了碱性β-1,3葡聚糖酶基因的表达。因此SA和JA在受到机械伤害和低温胁迫下对PR蛋白的诱导机制是不同的。本试验定量结果表明,SA能够通过NP1-dependent途径推迟8 ℃低温下碱性和酸性β-1,3葡聚糖酶基因的表达。前人研究表明低温会使植物体内的细胞膜结构首先出现变化,膜脂相变导致细胞代谢失调是植物受到寒害的关键[46-48]。推测8 ℃低温破坏了细胞膜结构稳定性,使定位于膜系统上的β-1,3葡聚糖酶基因能够快速响应低温伤害大量表达,而低温下SA处理在短时间内保护了植物细胞膜结构稳定性和完整性,从而减缓了细胞膜受到的低温伤害[21,22,28]。因此低温下SA处理延缓了细胞膜受到低温伤害的时间,使得β-1,3葡聚糖酶基因因未能感受到膜变化而推迟表达。β-1,3葡聚糖酶基因的表达机制还有待更为深入的研究。
[1] LIU CH Q(刘长全).Advances in reseach on chilling injury in banana[J].JournalofFruitScience(果树学报),2006,23(3):448-453(in Chinese).
[2] LIN Y J(林燕金),HUANG X F(黄雄峰),ZHONG Q ZH(钟秋珍),etal.The present situation and trend analysis of banana low temperature damage [J].FujianFruits(福建果树),2010,2(4):36-39(in Chinese).
[3] LAI ZH X(赖钟雄),CHEN Y(陈 源),LIN Y L(林玉玲),etal.Investigation of basic biological characteristics of wild banana(Musaspp.,‘AB’ Group) in Sanming City[J].SubtropicalAgricultureResearch(亚热带农业研究),2006,2(4):241-244(in Chinese).
[4] 张妙霞.野生香蕉(Musaspp.,AB Group)抗寒相关基因的克隆与表达分析[D].福州:福建农林大学.2010.
[5] HESLOP-HARRISON J S,SCHWARZACHER T.Domestication,genomics and the future for banana[J].AnnalsofBotany,2007,100(5):1 073-1 084.
[6] MA W Y(马文月).Studies on chilling injury and cold hardiness of plants[J].JournalofAnhuiAgriculturalSciences(安徽农业科学),2004,32(5):1 003-1 006(in Chinese).
[7] GRIFFTH M,ALA P,YANG D S,etal.Antifreeze protein produced endogenously in winter rye leaves[J].PlantPhysiology,1992,100(2):593-596.
[8] SHAO H B,GUO Q J,CHU L Y,etal.Understanding molecular mechanism of higher plant plasticity under abiotic stress[J].ColloidsandSurfacesB:Biointerfaces,2007,54(1):37-45.
[9] XIONG L,ZHU J K.Abiotic stress signal transduction in plants:Molecular and genetic perspectives[J].PhysiologiaPlantarum,2001,112(2):152-166.
[10] LEGRAND M S,KAUFFMANN,GEOFFROY P,etal.Biological function of pathogenesis-related proteins:four tobacco pathogenesis-related proteins are chitinases[J].ProceedingsofTheNationalAcademyofSciences,1987,84(19):6 750-6 754.
[11] BEFFA R,MEINS F.Pathogenesis-related functions of plant β-1,3-glucanases investigated by antisense transformation——a review[J].Gene,1996,179(1):97-103.
[12] HE J F(何江峰),HAN B(韩 冰),ZHAO H X(赵宏鑫).Research on β-1,3-glucanae in Plants [J].InnerMongoliaAgriculturalScienceandTechnology(内蒙古农业科技),2006,(5):21-25(in Chinese).
[13] OUYANG B(欧阳波),LI H X(李汉霞),YE ZH B(叶志彪).Plant beta 1,3 - glucanase proteins and genes [J].JournalofChineseBiotechnology(中国生物工程杂志),2002,22(6):18-23(in Chinese).
[14] LEUBNER-METZGER G,MEINS F.Functions and regulation of plant β-1,3-glucanases (PR-2)[J].Pathogenesis-RelatedProteinsinPlants,1999:49-76.
[15] SHINSHI H,WENZLER H,NEUHAUS J-M,etal.Evidence for N-and C-terminal processing of a plant defense-related enzyme:Primary structure of tobacco prepro-β-1,3-glucanase[J].ProceedingsoftheNationalAcademyofSciences,1988,85(15):5 541-5 545.
[16] VAN KAN J A,JOOSTEN M.H,WAGEMAKERS C A,etal.Differential accumulation of mRNAs encoding extracellular and intracellular PR proteins in tomato induced by virulent and avirulent races ofCladosporiumfulvum[J].PlantMolecularBiology,1992,20(3):513-527.
[17] DING C K,WANG,C K,GROSS C,etal.Jasmonate and salicylate induce the expression of pathogenesis-related-protein genes and increase resistance to chilling injury in tomato fruit[J].Planta,2002,214(6):895-901.
[18] HUANG SH W(黄水文),GE SH F(葛淑芳).Research advance on physiological and biochemical responses of salicylic acid in plant under stress [J].JournalofAnhuiAgriculturalSciences(安徽农业科学),2013,41(10):4 248-4 249(in Chinese).
[19] YANG X J(杨筱静).Review on the role of salicylic acid in adversity-stressed plant [J].AnhuiAgriculturalScienceBulletin(安徽农学通报),2009,15(17):47-51(in Chinese).
[20] KANG G.,LI G,GUO T.Molecular mechanism of salicylic acid-induced abiotic stress tolerance in higher plants[J].ActaPhysiologiaePlantarum,2014,36(9):2 287-2 297.
[21] ZHOU L M(周利民),CHEN H P(陈惠萍).Effect of salicylic acid on banana seedlings under chilling stress[J].SubtropicalPlantScience(亚热带植物科学),2009,38(1):19-22(in Chinese).
[22] TANG G ZH(康国章),OU ZH Y(欧志英),WANG ZH X(王正询),etal.Salicylic acid alleviated the damage caused by low temperature to cell membrane and some photosynthetic functions of banana seedlings [J].ActaHorticulturaeSinica(园艺学报),2003,30(2):141-146(in Chinese).
[23] HAO J,DONG C,ZHANG Z,etal.Insights into salicylic acid responses in cucumber (CucumissativusL.) cotyledons based on a comparative proteomic analysis[J].PlantScience,2012,187:69-82.
[24] GENG G D(耿广东),CHENG ZH H(程智慧),LI J SH(李建设),etal.Effects of salicylic acid on chill-resistance activity of eggplant seedlings[J].JournalofNorthwestSci-TechUniversityofAgricultureandForestry(Natural Science Edition)(西北农林科技大学学报·自然科学版),2002,30(6):101-103 (in Chinese).
[25] ZHOU Y T(周忆堂),LIANG L J(梁丽娇),MA H Q(马红群),etal.Mitigative effect of salicylic acid on chilling stress-induced injuries inbrassicaoleraceaL.seedlings[J].JournalofSouthwestChinaNormalUniversity(Natural Science Edition)(西南师范大学学报·自然科学版),2007,32(5):99-103(in Chinese).
[26] YU L L(余丽玲),HE T Y(何天友),CHEN L Y(陈凌艳),etal.Study on the effect of salicylic acid on cold resistance of seedlings of Rhododendron[J].FujianJournalofAgriculturalSciences(福建农业学报),2014,29(3):220-226(in Chinese).
[27] XU F F(徐芬芬),YE L M(叶利民),FU SH Q(付淑琴).Effects of salicylic acid on resistance to cold stress of rice seedlings[J].GuangdongAgriculturalSciences(广东农业科学),2010,37(1):18-20(in Chinese).
[28] LEI T,FENG H,SUN X,etal.The alternative pathway in cucumber seedlings under low temperature stress was enhanced by salicylic acid[J].PlantGrowthRegulation,2010,60(1):35-42.
[29] 赖恭梯.福建香蕉种质资源试管保存及野生蕉ISSR与抗寒性分析[D].福州:福建农林大学.2014.
[30] LIU H Y(刘海燕),FENG D R(冯冬茹),LIU B(刘 兵),etal.Studies on subcellular localization of MpASR in onion epidermal cells mediated by agrobacterium[J].JournalofTropicalandSubtropicalBotany(热带亚热带植物学报),2009,17(3):218-222(in Chinese).
[31] REDDY A S,MARQUEZ Y,KALYNA M,etal.Complexity of the alternative splicing landscape in plants[J].ThePlantCellOnline,2013,25(10):3 657-3 683.
[32] 林玉玲.龙眼体胚发生过程中SOD基因的克隆及表达调控研究[D].福州:福建农林大学.2011.
[33] 方智振.龙眼体胚发生中期的蛋白质组学及Ran表达调控研究[D].福州:福建农林大学.2012.
[34] SHI Y,ZHANG Y,SHIH D S.Cloning and expression analysis of two β -1,3-glucanase genes from strawberry[J].JournalofPlantPhysiology,2006,163(9):956-967.
[35] BALASUBRAMANIAN V,VASHISHT D,CLETUS J,etal.Plant β-1,3-glucanases:their biological functions and transgenic expression against phytopathogenic fungi[J].BiotechnologyLetters,2012,34(11):1 983-1 990.
[36] KEREN H,LEV-MAOR G,AST G.Alternative splicing and evolution:diversification,exon definition and function[J].NatureReviewsGenetics,2010,11(5):345-355.
[37] STAIGER D,BROWN J W.Alternative splicing at the intersection of biological timing,development,and stress responses[J].ThePlantCellOnline,2013,25(10):3 640-3 656.
[38] BOVE J,KIM C Y,GIBSON C A,etal.Characterization of wound-responsive RNA-binding proteins and their splice variants in Arabidopsis[J].PlantMolecularBiology,2008,67(1-2):71-88.
[39] CAPLAN J L,MAMILLAPALLI P,BURCH-SMITH T M,etal.Chloroplastic protein NRIP1 mediates innate immune receptor recognition of a viral effector[J].Cell,2008,132(3):449-462.
[40] TADA Y,SPOEL S H,PAJEROWSKA-MUKHTAR K,etal.Plant immunity requires conformational charges of NPR1 via S-nitrosylation and thioredoxins[J].Science,2008,321(5 891):952-956.
[41] MEYERS B C,KOZIK A,GRIEGO A,etal.Genome-wide analysis of NBS-LRR-encoding genes in Arabidopsis[J].ThePlantCellOnline,2003,15(4):809-834.
[42] BOISVERT F M,LAM Y W,LAMONT D,etal.A quantitative proteomics analysis of subcellular proteome localization and changes induced by DNA damage[J].Molecular&CellularProteomics,2010,9(3):457-470.
[43] ZAVALIEV R,LEVY A,GERA A,etal.Subcellular dynamics and role of Arabidopsis β-1,3-glucanases in cell-to-cell movement of tobamoviruses[J].MolecularPlant-MicrobeInteractions,2013,26(9):1 016-1 030.
[44] HEIDRICH K,WIRTHMUELLER L,TASSET C,etal.Arabidopsis EDS1 connects pathogen effector recognition to cell compartment-specific immune responses[J].Science,2011,334(6 061):1 401-1 404.
[45] NIKI T,MITSUHARA I,SEO S,etal.Antagonistic effect of salicylic acid and jasmonic acid on the expression of pathogenesis-related (PR) protein genes in wounded mature tobacco leaves[J].PlantandCellPhysiology,1998,39(5):500-507.
[46] LI D H(李德红),PAN R ZH(潘瑞炽).The role of salicylic acid in plants[J].ChineseBulletinofBotany(植物学通报),1995,31(2):144-149(in Chinese).
[47] YAMAGUCHI-SHINOZAKI K,SHINOZAKI K.Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J].AnnualReviewofPlantBiology,2006,57:781-803.
[48] BRIGGS W K,GREEN P B,JONES R L,etal.Annual review of plant physiology[J].SoilScience,1979,127(2):127.
(编辑:宋亚珍)
Cloning and Expression Analysis under Cold and SA Treatments of β-1,3-glucanase Genes from the Wild Banana in Sanming City
CHEN Fanglan,LIN Yuling,CHEN Yukun,FENG Xin,ZHANG Zihao,LAI Zhongxiong*
(Institute of Horticultural Biotechnology/College of Horticulture,Fujian Agriculture and Forestry University,Fuzhou 350002,China)
The cDNA and DNA sequences of β-1,3-glucanase genes (Mugsp1.2-Mugsp5) were cloned from the leaves of the wild banana(Musaspp.) in Sanming City using RT-PCR and RACE methods.Sequences and bioinformatics analysis showed that the ORF sequences ofMugsp1.2,Mugsp2,Mugsp3,Mugsp4 andMugsp5 were 1 020,1 047,999,1 023 and 960 bp,respectively,which encoded 339,348,332,340 and 319 amino acids,respectively.Mugsp1.2,Mugsp2 and Mugsp4 contained both N-terminal and C-terminal(CTPP) signal peptide,suggesting they belong to Ⅰclass of β-1,3-glucanase,while Mugsp3 contained N-terminal without CTPP signal peptide,and Mugsp5 contained neither N-terminal nor CTPP signal peptide.We constructed the expression vectors ofMugsp1.2,Mugsp2,Mugsp4 and expressed the genes in onion epidermal cells.The results of subcellular localization showed thatMugsp1.2,Mugsp2,Mugsp4 were expressed on plasma membranes and cytoplasm at room temperature,respectively,while allMugsp1.2,Mugsp2 andMugsp4 could transfer to cell nucleus under 8 ℃.The expressions of β-1,3-glucanase genes under diffierent tempertaures were dectected by qRT-PCR.The results revealed that all β-1,3-glucanase genes responded to cold stress,but their expression levels were differed from each other.SA treatment under low temperature would delayed the expression of β-1,3-glucanase genes.
Sanming wild banana;β-1,3-glucanase;salicylic acid;cold stress;subcellular localization;qRT-PCR
1000-4025(2015)09-1709-13
10.7606/j.issn.1000-4025.2015.09.1709
2015-05-08;修改稿收到日期:2015-07-20
国家香蕉产业技术体系专项资金(CARS-32-11);福建省农业科技平台(2008 N2001)
陈芳兰(1991-),女,在读硕士研究生,主要从事花卉生物技术研究。E-mail:fl59xw@sina.com。
*通信作者:赖钟雄,博士,研究员,博士生导师,主要从事园艺植物生物技术研究。E-mail:laizx01@163.com。
Q786;Q789
A
