番茄LeRma1基因的克隆与表达
2015-05-05金晓霞于丽杰丁国华傅文上
陈 默,金晓霞,于丽杰,朱 宏,丁国华,傅文上,付 畅
(1 哈尔滨师范大学 生命科学与技术学院,植物生物学黑龙江省高校重点实验室,哈尔滨 150025;2 密山市第一中学,黑龙江密山 158300)
番茄LeRma1基因的克隆与表达
陈 默1,2,金晓霞1*,于丽杰1,朱 宏1,丁国华1,傅文上1,付 畅1
(1 哈尔滨师范大学 生命科学与技术学院,植物生物学黑龙江省高校重点实验室,哈尔滨 150025;2 密山市第一中学,黑龙江密山 158300)
以番茄‘哈大粉801’为试材,利用RT-PCR技术,克隆得到1个E3泛素蛋白连接酶基因LeRma1(GenBank登录号XM_004243764.1)。对LeRma1基因进行序列分析,并对LeRma1基因在番茄植株的不同部位以及在非生物胁迫(干旱、盐、碱、高温、低温)下的表达和生理特性进行研究,为培育和改良番茄品种提供理论依据。结果表明:(1)序列分析显示,LeRma1基因的cDNA全长序列729 bp,编码242个氨基酸,分子量为27.05 kD,理论pI 7.97;同源分析显示,番茄LeRma1蛋白与马铃薯的一致性最高(91%)。(2)半定量PCR检测表明,LeRma1基因在番茄根、茎、叶、花、果实中均有表达,且表达差异不明显。(3)干旱胁迫下,LeRma1基因在番茄叶片中优势表达,而在整个干旱过程中根部的LeRma1基因表达量变化不明显;抗旱相关基因LEA、DREB2A、ABI3在干旱胁迫过程中,番茄叶片中均有表达,且其表达量呈上升趋势,而在根部DREB2A、ABI3基因基本没有检测到。(4)干旱胁迫过程中,番茄植株中丙二醛(MDA)含量呈显著升高趋势,质膜系统严重损伤,体内保护酶(SOD、POD、CAT)活性上升,且根部活性总体明显高于叶片。(5)在非生物逆境(盐、碱、高温、低温)胁迫过程中,LeRma1基因在番茄叶片和根部的表达几乎都有增强的趋势,且在叶片中均是胁迫3 h后诱导起始增强表达。研究认为,LeRma1基因是一个受干旱胁迫诱导增强表达的基因,且在叶片中优势表达,说明LeRma1基因对植物耐受干旱胁迫所起的作用存在一定的组织差异性,而且LeRma1基因可能参与番茄的干旱应答及信号转导过程,在番茄抵抗其他非生物胁迫中LeRma1基因也可能具有一定的作用。
番茄;LeRma1;克隆;表达
植物在生长发育过程中,经常遭遇到生物和非生物胁迫的伤害。在各种非生物胁迫中,干旱、高盐和低温等非生物胁迫对植物的影响尤为突出,是制约植物生长和农作物产量的最主要非生物胁迫因子[1-2]。番茄(LycopersiconesculentumMill.)是重要的经济作物,然而干旱环境严重影响了番茄的生长发育和产量[3-7]。因此,如何提高番茄对干旱胁迫的抗性以及通过分子生物学手段改良番茄抗逆性、培育相关新品种,已成为中国乃至世界农业能否持续高效发展的重大课题之一[8-10]。
E3泛素蛋白连接酶(ubiquitin-protein ligases,E3s)是泛素/26S蛋白酶体途径[11]中负责与底物蛋白特异结合的关键酶,它可以通过泛素化降解与胁迫信号有关的成分来响应对各种非生物的胁迫[12-13],通过其对无功能蛋白的降解,在植物抗逆中发挥着重要作用。Lee等[14]从辣椒中分离出一个RING-finger类型[15]E3连接酶CaRma1H1,在拟南芥中异源过表达Rma1H1明显增强了植物对干旱的耐受性,说明Rma1H1基因正调控植物的干旱胁迫响应过程。Bae等[16]报道,辣椒Rma1H1在水稻中的同源蛋白OsRDCP1参与对水稻干旱胁迫响应过程的正调控,但是其具体作用机制仍不清楚。同样,Seo等[17]从辣椒中获得CaRma1H1,并发现其在番茄中异源过表达与野生型相比可以极大增强其对干旱胁迫的耐性。
尽管在其他植物中已有部分关于E3连接酶Rma1的研究,但在番茄中的Rma1基因至今尚未报道。本研究根据已有的基因序列数据库资源,同源克隆出番茄的LeRma1基因cDNA全长,在对其进行生物信息学预测的基础上,分析LeRma1基因在番茄植株的不同部位以及干旱胁迫处理下的表达情况,并对胁迫过程中的生理特性进行研究,为番茄改良和培育抗旱品种提供一定的理论依据。
1 材料与方法
1.1 试验材料及处理
供试材料为哈尔滨市农业科学院‘哈大粉801’番茄(LycopersiconesculentumMill.),五叶期(根、叶)、成株期(根、茎、叶、花、果实)取材于哈尔滨师范大学植物培养室。
采用草炭土育种,当番茄长出子叶时,移植于6 cm×7 cm的小钵里。当植株长至5叶期时,取番茄叶片用于基因克隆。五叶期番茄进行干旱控水处理,分别于处理后0、1、3、6、8、10 d和复水后1 d取根和成熟叶,用于半定量表达分析与番茄植株部分生理指标的测定。干旱处理后0、3、6、10 d和复水后1 d取根和成熟叶,用于荧光定量表达分析。五叶期番茄进行盐(200 mmol/L NaCl)、碱(100 mmol/L Na2CO3)、高温(40 ℃)、低温(4 ℃)胁迫处理,并取胁迫后0、3、6、12和24 h幼苗的根部和叶片,用于半定量表达分析。取番茄成株不同部位(根、茎、叶、花、果实)用于基因的组织器官表达分析。以上材料均用锡箔纸包好后迅速用液氮冷冻后,-80 ℃保存备用。
1.2 方 法
1.2.1 RNA提取和cDNA合成 对以上材料进行总RNA的提取和cDNA第一链的合成,具体方法参照RNAprep Pure植物总RNA提取试剂盒(天根生化科技有限公司)和反转录试剂盒(TOYOBO)操作程序进行。
1.2.2 番茄LeRma1基因cDNA序列克隆和PCR反应体系 以辣椒的Rma1H1的cDNA序列为信息,与已公布的番茄基因组序列(http://gkcsuja.solgenomics.net/tools/blast/)进行比对,获得编号为Solyc07g054080.1的基因序列,根据这个基因cDNA序列信息设计特异引物L1和L2(表1)。以叶片cDNA第一链为模板,进行PCR扩增,PCR体系为模板cDNA 1 μL,上下游引物(10 μmol·L-1)各1 μL,10×PCR Buffer 2.5 μL,MgCl22.5 μL,dNTP Mixture(2 mmol·L-1)2.5 μL,TaqDNA聚合酶(5U·μL-1)0.2 μL,加双蒸水至25 μL。PCR反应条件为94 ℃预变性5 min;94 ℃变性60 s,58 ℃退火60 s,72 ℃延伸90 s,共进行35个反应循环,72 ℃延伸10 min。
PCR扩增产物分别用0.8%琼脂糖凝胶进行电泳检测。电泳回收产物与pMD18-T载体连接,然后将连接产物转化感受态大肠杆菌细胞,涂板筛选白色克隆,菌液PCR和双酶切初步鉴定后送上海生工公司测序。
1.2.3 序列分析与系统进化树的构建 应用NCBI的ORF Finder程序分析蛋白质的开放读码区。应用SignaIP(http://www.cbs.dtu.dk/services/SignaIP/)预测蛋白的信号肽。利用在线软件TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)对蛋白进行跨膜分析。应用PredictProtein(http://www.predictprotein.org/)在线蛋白质序列和结构预测网站对蛋白进行二级结构的预测。应用在线网站http://www.expasy.org/prosite/预测蛋白质具有生物学意义的位点、模式和轮廓。其他植物的Rma1蛋白序列均来自于NCBI数据库,使用BLAST进行序列比对。先用软件DNAMAN对序列进行多重比对,然后用软件MEGA 4构建系统进化树。
1.2.4LeRma1基因在番茄不同器官中的表达 根据LeRma1基因的cDNA序列设计半定量表达引物L3和L4(表1)。提取番茄成株不同部位(根、茎、叶、花、果实)的RNA,去除DNA后反转录成cDNA,测定cDNA浓度,使各自浓度一致,然后进行半定量RT-PCR。模板分别为不同组织的cDNA 1 μL,引物L3和L4(10 μmol·L-1)各1 μL,PCR体系同1.2.2,退火温度58 ℃。同时以β-Actin基因作为内参,用β-Actin引物(表1)对其进行扩增。

表1 引物名称及序列Table 1 Names and sequences of the primers
1.2.5 干旱胁迫下LeRma1和其他抗旱相关基因的表达分析 干旱处理后0、1、3、6、8、10 d和复水后1 d取根部和叶片,用于LeRma1和其他抗旱相关基因(DREB2A、ABI3、LEA)半定量表达分析,方法同1.2.4。
1.2.6 干旱胁迫下LeRma1基因实时荧光定量表达分析 分别提取番茄五叶期干旱处理0、3、6、10 d和复水后1 d的根和叶的RNA,去除DNA后反转录成cDNA,测定cDNA浓度,使其浓度一致,然后进行实时荧光定量RT-PCR,以β-Actin基因作为内参(表1)。
反应体系为PCR Master Mix-Plus- 25 μL,Plus solution 5 μL, 10 μmol·L-1L3和L4引物(表1)各2 μL,模板cDNA 5 μL,加入双蒸水至50 μL。反应程序为95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸35 s,共进行40个循环。反应在ABI 7500型实时荧光 PCR仪(Applied Biosystems Co.Ltd.,USA)上进行,采用两步法,在60 ℃进行荧光信号采集,反应结束后绘制融解曲线。样本和内参分别设3个重复,β-Actin为内参(表1)。采用比较CT法(ΔΔCT)荧光定量PCR扩增数据进行处理,以干旱胁迫0 d的根和叶为对照样品。
1.2.7 干旱胁迫下番茄植株生理指标测定 以五叶期番茄植株干旱处理0、1、3、6、8、10 d和复水后1 d的根和叶为材料,进行丙二醛(MDA)含量及抗氧化酶活性(POD、CAT、SOD)的测定。
丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法[18]。过氧化物酶(POD)活性测定采用愈创木酚显色法[19],以每克鲜重每分钟A470变化0.01的酶量为一个酶活性单位。过氧化氢酶(CAT)活性测定采用紫外吸收法[19],以每克鲜重每分钟A240光密度降低0.1的酶量为一个酶活性单位。超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光还原法[19],以每克鲜重抑制NBT光化学还原50%为一个酶活性单位。以上试验均进行3次重复,所得数据用SPSS17.0软件进行统计分析。1.2.8 盐、碱、高温、低温胁迫下LeRma1基因的表达分析 对五叶期番茄进行盐(200 mmol/L NaCl)、碱(100 mmol/L Na2CO3)、高温(40 ℃)、低温(4 ℃)胁迫处理,并取胁迫后0、3、6、12、24 h幼苗的根部和叶片,用于半定量表达分析,方法同1.2.4。
2 结果与分析
2.1 番茄LeRma1基因cDNA序列的获得
以番茄叶片的cDNA为模板,进行PCR扩增,得到1条约750 bp左右的条带(图1)。将回收产物与pMD18-T载体连接,然后将连接产物转化感受态大肠杆菌细胞,涂板筛选白色克隆,菌液PCR后进行双酶切(图2),得到目的条带。

图1 LeRma1基因全长cDNA序列扩增结果

图2 pMD18T-LeRma1双酶切电泳
2.2LeRma1基因的序列分析
应用NCBI的ORF Finder程序显示开放读码区为729 bp,编码242个氨基酸(图3)。对番茄LeRma1蛋白氨基酸组成分析,242个氨基酸中有18个强负极性氨基酸(D、E),20个强正极性氨基酸(K、R),6个弱碱性氨基酸(H),94个疏水性氨基酸(A、I、L、F、W、V、P、M),104个极性氨基酸(N、C、Q、S、T、Y、G);其分子量为27.05 kD,理论pI为7.97。预测LeRma1蛋白信号肽发现,番茄LeRma1蛋白质不含有信号强烈的信号肽。
对番茄LeRma1蛋白进行跨膜分析表明,按膜的取向来分,由内向外有3个显著的跨膜螺旋,由外向内有3个明显的跨膜螺旋。对番茄LeRma1蛋白进行二级结构的预测,结果表明该蛋白二级结构主要由loop环(78.9%)、α螺旋(19.0%)构成,此外还有少量的β折叠(2.1%)。应用在线网站http://www.expasy.org/prosite/预测番茄LeRma1蛋白质的生物学意义的位点、模式和轮廓,发现该蛋白在37~86氨基酸残基处有1个RING-type锌指蛋白结构区。
采用BlastX分析番茄LeRma1氨基酸序列与GenBank中其他植物的Rma1蛋白的同源关系,蛋白氨基酸序列分析结果(图4)表明,番茄LeRma1氨基酸序列与马铃薯的一致性为91%,与甜椒的一致性为86%,与毛果杨、大豆、黄瓜等作物为60%以下,这说明LeRma1基因在这些植物中的一致性较低。

图3 LeRma1 cDNA 的核苷酸及编码氨基酸序列

图4 番茄LeRma1与其他物种Rma1H1氨基酸序列保守区域的多重比对
2.3 番茄LeRma1的进化树分析
选取在氨基酸序列比对中相似度较高的9种植物,分析番茄LeRma1与其他物种中相关蛋白的进化关系,用MEGA 4绘制进化树。结果(图5)显示,番茄的LeRma1与马铃薯和甜椒同属1个分支,且与马铃薯进化最近,其次是甜椒。葡萄和毛果杨的Rma1属于同1个分支;野草莓和苹果的Rma1属于同1个分支;大豆、黄瓜和甜瓜的Rma1属于同1个分支,其中黄瓜和甜瓜的进化关系较近。
2.4LeRma1基因在番茄不同器官中的表达
采用半定量PCR方法,检测番茄LeRma1基因在不同器官(根、茎、叶、花、果实)的表达情况。如图6所示,番茄LeRma1基因在根、茎、叶、花、果实中均有表达,且表达差异不明显。
2.5 干旱胁迫下LeRma1及其他抗旱相关基因的表达分析
采用半定量RT-PCR方法,检测干旱胁迫下,LeRma1基因和其他抗旱相关基因在番茄叶片和根部中的表达水平(图7)。结果显示,干旱胁迫下,LeRma1基因在番茄叶片和根部均有表达。随着干旱胁迫进行,番茄叶片中LeRma1的表达量呈先上升后下降又上升又下降的趋势。在干旱处理1和3 d时,表达量有所增强,之后表达量下降,而在干旱10 d时,表达量又增加并达到最大,复水后表达减弱。番茄根部中LeRma1基因虽在干旱1 d时表达量有所下降,但在整个干旱过程中,其表达量变化并不明显。
干旱胁迫下,抗旱相关基因LEA在番茄叶片和根部均有表达,在叶片中,其表达量呈上升趋势,而在根部的表达量变化不明显;抗旱相关基因DREB2A、ABI3在番茄叶片中均有表达,与对照相比,表达量均增加,说明该基因在叶片中增强表达,且在整个干旱过程中,表达量的变化不明显;而在根部中,这2个基因基本没有被检测出来(图7)。

图5 部分物种的Rma1氨基酸序列的系统进化树
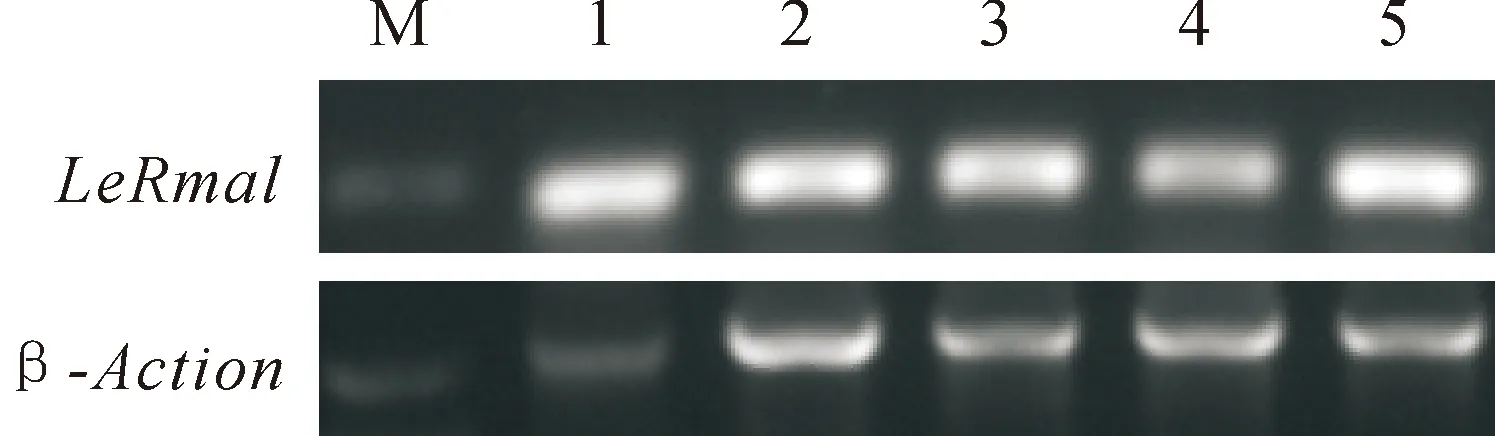
图6 番茄LeRma1基因在不同器官的表达
2.6 干旱胁迫下LeRma1基因实时荧光定量表达分析
采用荧光定量PCR方法,检测番茄LeRma1基因在干旱胁迫条件下的表达水平。结果(图8)显示,干旱胁迫下该基因在番茄叶片和根部均有表达。随着干旱胁迫进行,番茄叶片中LeRma1的表达量呈先上升后下降再升高的趋势,且与对照相比表达量呈现上升趋势。在干旱处理3 d时有一次应激反应的上升,之后表达量下降;在干旱处理10 d时表达量又升高并达到最大,约为对照的9倍。LeRma1在复水后1 d其在叶片中的表达量下降。干旱胁迫下,基因表达量在根部的变化趋势与叶片相反,呈现总体下降的趋势。在干旱处理6 d时,表达量达到最低,约为对照的0.5倍;与叶片相似,该基因在根部复水后1 d其表达又呈下降趋势(图8)。

图8 番茄LeRma1基因干旱胁迫下在叶片和根部的表达
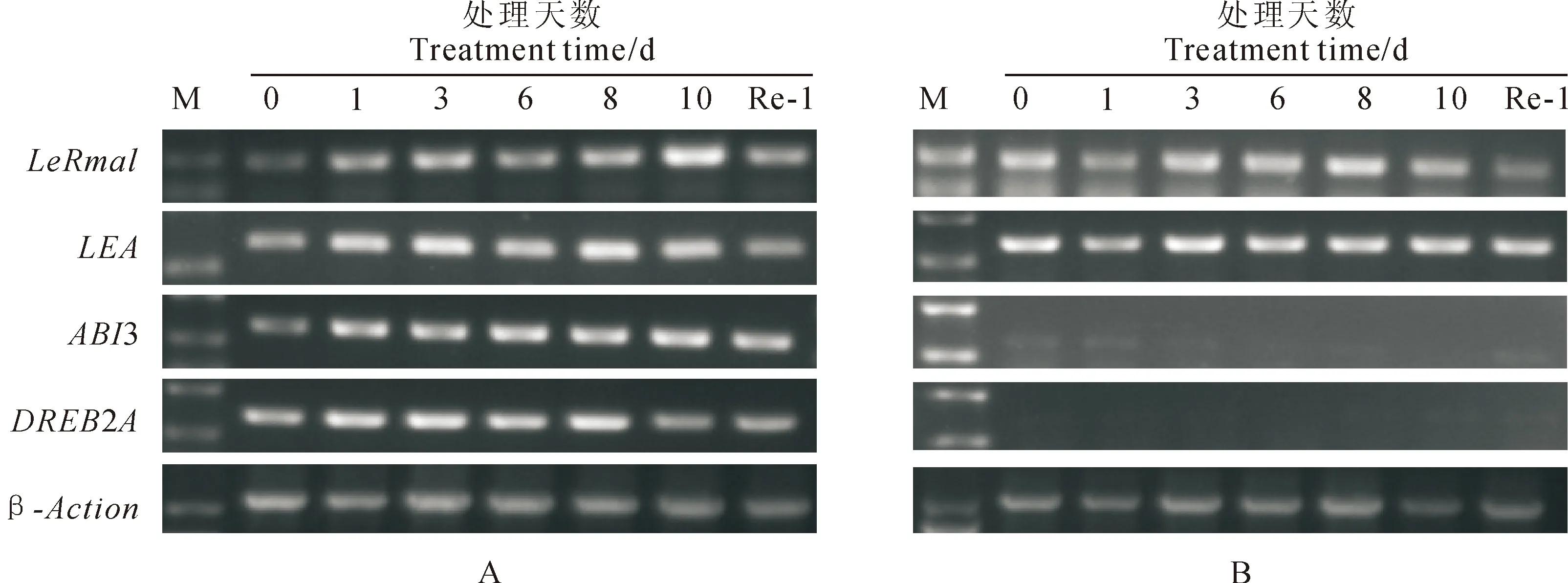
图7 干旱胁迫下番茄LeRma1基因和干旱相关基因在叶片(A)和根部(B)的表达
2.7 干旱胁迫对番茄植株生理指标影响
在干旱胁迫处理下,对其五叶期番茄植株的叶片和根部的生理指标进行了测定。结果(图9)显示,在干旱及复水处理过程中,MDA含量呈先升高后降低的趋势。干旱胁迫导致叶片MDA含量明显增加。其中,干旱处理10 d时,MDA含量增加最多,高出对照2倍之多,膜脂过氧化程度加重;而在复水后1 d时,MDA含量得到了降低,但仍高于对照,说明复水处理部分缓解了干旱胁迫导致的膜脂过氧化。根部MDA含量变化趋势与叶片相似,均呈先升高后下降趋势。
POD、CAT、SOD是植物体内清除活性氧对细胞膜系统伤害的重要保护酶。从图9可知,在干旱及复水过程中,番茄叶片SOD和CAT活性均呈先上升后下降再上升趋势。干旱处理3 d,二者活性均明显上升,而后逐渐下降;复水后活性得以上升。两者根部变化趋势同叶片相似。虽然根部CAT活性在干旱处理3 d时略低于对照,但二者之间差异并不显著。番茄叶片POD活性在干旱胁迫及复水过程中也呈先上升后下降再上升趋势。在干旱处理6 d时,POD活性达到最大随后下降,复水后活性显著上升。根部POD的活性在干旱胁迫与复水过程中整体高于叶片,呈先下降后上升再下降趋势。尽管在干旱处理3 d时,POD活性略有下降,但与0 d相比,二者差异也均并不显著。而在复水后,与叶片不同,根部POD活性显著下降。
以上结果表明,干旱胁迫引起膜脂过氧化程度加剧,使番茄植株体内MDA含量升高,植物为维持正常生长,POD、CAT、SOD保护酶系统均发挥作用。干旱胁迫后复水,清除活性氧保护酶SOD、POD和CAT的活性提高,MDA得到清除,膜系统的损伤得到恢复,透性降低,恢复原有正常的生理代谢机能。
2.8 在不同逆境胁迫下LeRma1基因的表达分析
利用半定量RT-PCR方法,检测番茄中LeRma1基因在盐、碱、高温、低温逆境胁迫的响应表达情况。结果(图10)显示,盐胁迫下,番茄LeRma1基因在叶片的表达有增强的趋势,在3和6 h处有明显增强,根部变化的趋势与叶片相似,也在3 h处增强(图10,A);碱胁迫下,LeRma1基因在叶片的表达也是从3 h起呈增强趋势(图10,B);高温胁迫下,LeRma1基因在叶片的表达量在3和6 h处均增加,在根部3 h处表达略有增强(图10,C);低温胁迫下,LeRma1基因在叶片的表达量从3 h开始持续增加,24 h时达到最大,根部在6和24 h时表达量增多,但不明显(图10,D)。
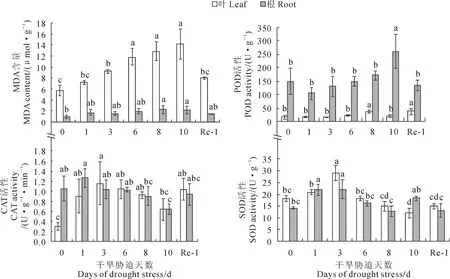
图9 番茄植株在干旱胁迫下MDA含量与抗氧化酶活性变化

图10 不同逆境胁迫下番茄LeRma1基因在叶片和根部的表达
以上结果表明,在盐、碱、高温、低温胁迫下,LeRma1基因在番茄叶片和根部的表达几乎都有增强的趋势,且在上述胁迫下,该基因在叶片中均是胁迫3 h后诱导起始增强表达。
3 讨 论
自从Rma1H1被作为干旱诱导基因被最初鉴定出来[20],就使人们猜想,它在其他物种是否也具有抗非生物胁迫功能,进而陆续对它进行研究[14,16-17]。然而虽然在部分植物中LeRma1基因已被克隆,但在栽培经济作物番茄中尚未见报道。本试验中采用RT-PCR的方法,获得番茄LeRma1基因cDNA全长序列。对番茄LeRma1蛋白进行跨膜分析,发现该蛋白具有跨膜螺旋。并且在37~86氨基酸残基处有1个RING-type锌指蛋白结构区。这与Lee等[14]在辣椒中的LeRma1序列分析相类似,在其C末端具有跨膜结构域,在N末端附近具有RING结构域,氨基酸残基具Zn2+结构。在其他E3泛素连接酶同样具有该Zn2+结构[21-22]。番茄LeRma1与其他9种植物进行同源性分析,发现番茄LeRma1氨基酸序列与马铃薯的一致性最高为91%,与毛果杨、大豆、黄瓜等作物一致性为60%以下,说明LeRma1基因在这些植物中的一致性较低。这同样与Lee等[14]在辣椒中的LeRma1同源性分析结果相似,其选择与RmaH1高度同源的Rma1、Rma2、Rma3进行相互比对,发现在杨树、拟南芥、水稻等植物的一致性均在50%以下,一致性同样较低。
基因表达模式能够反映基因特定的生物学功能。半定量分析表明,LeRma1在番茄根、茎、叶、花和果实中均有表达,说明此基因编码的蛋白在番茄各器官中普遍存在。而该基因编码的蛋白即是E3泛素连接酶,前人研究发现植物体内多种E3泛素连接酶在各器官中大都均有表达。Catala R等[23]发现一个SUMO E3泛素连接酶SIZ1,其在拟南芥中各组织均有表达。ZmRFP1是玉米中1个编码RING-H2 E3泛素连接酶的基因[24],该基因与拟南芥SDIR1同源[25]。ZmRFP1在各组织,包括叶、茎、穗和幼穗均有表达。拟南芥E3泛素蛋白酶AtSAP5[26]在根、茎、叶、花中均有表达。烟草RING-H2型基因RHF1编码1个E3连接酶NtRHF1在根、茎、叶、花、成熟的果实不同器官中也均有表达[27]。
干旱胁迫下,半定量分析表明LeRma1基因在番茄叶片和根部均有表达。随着干旱胁迫进行,番茄叶片中LeRma1的表达量呈先上升后下降又上升又下降的趋势。根部中LeRma1基因在整个干旱过程中表达量变化并不明显。抗旱相关基因LEA、DREB2A、ABI3在叶片中表达量呈上升趋势。进而对LeRma1基因进一步实时荧光定量PCR检测结果表明:在干旱胁迫处理下,LeRma1基因在番茄叶片的表达量在胁迫初期呈现一次明显的上升,略有下降后又上升,表达量总体上与对照相比呈现明显的上升趋势。这与玉米中鉴定出的一个与水稻OsGW2同源的RING型E3泛素连接酶ZmGW2相似,在玉米苗期不同胁迫处理下,ZmGW2基因在根和叶中均被诱导表达,在干旱胁迫条件下,该基因前期表现出上调表达,而后表达量逐渐下降[28]。LeRma1在根中表达量虽有变化,但相对于叶片还是稳定的,且表达水平整体低于叶片。表明LeRma1基因是一个受干旱胁迫诱导增强表达的基因且在叶片中优势表达。干旱胁迫诱导时叶、根中基因表达水平的不同说明该基因对植物耐受干旱胁迫所起的作用存在一定的组织差异性。这与Lee等[14]结果相似,其试验结果表明,叶组织是Rma1H1诱导辣椒响应干旱胁迫的主要部位。
以上通过荧光定量PCR技术,证明了干旱胁迫处理对LeRma1基因表达有一定诱导作用。因此,可初步认定LeRma1是一个受干旱诱导表达的基因且在叶片中优势表达;进一步表明该基因可能参与番茄的干旱应答及信号转导。而Lee等[14]对辣椒中的同源基因CaRma1转入拟南芥的研究,发现CaRma1可以参与干旱胁迫诱导,其作用机制是可能通过抑制水通道蛋白PIP2;1从内质网到质膜的转运,并伴随蛋白酶体对其的降解来减少PIP2;1在转基因植物原生质体中的水平,从而来响应转基因拟南芥对干旱的胁迫。因此,推测番茄LeRma1基因是否也是通过该机制来实现干旱胁迫响应的,还需进一步研究。
与基因表达检测的同时,本试验还对干旱处理番茄植株生理方面进行检验,MDA是膜脂过氧化的主要产物之一。干旱胁迫下,植物膜脂过氧化物MDA大量积累,而MDA含量的上升与膜透性的增加呈显著的正相关,导致细胞膜系统的严重损伤,其积累是活性氧毒害作用的表现[29-30]。MDA能与细胞膜上的蛋白质、酶等结合,引起蛋白质分子内和分子间的交联,使之失活,从而破坏生物膜的结构与功能[31]。因此,MDA被广泛用作衡量膜脂过氧化损伤的指标,可用MDA含量表示细胞遭受氧化损伤的程度。其含量高低反映了细胞膜脂过氧化作用的强弱,MDA含量增加,表明膜脂过氧化程度加剧。干旱胁迫使质膜受损同时,可以使植物体内活性氧(ROS)大量积累,ROS的产生对细胞具有一定的损伤作用。植物体内存在清除活性氧的抗氧化酶系统(POD、SOD、CAT)。在正常生长条件下,植物体内活性氧的产生和清除处于动态平衡状态,从而使植物体内活性氧维持在较低的浓度范围内。干旱等逆境胁迫破坏了这种平衡[32-33],导致细胞膜破坏使植物受损。本实验结果表明,干旱胁迫下,质膜系统在一定程度上受损,体内MDA含量呈升高趋势。番茄植株为维持正常生长,保护酶系统相应发挥作用。该结果与何乘坤等[34]和孙三杰等[35]报道相似。干旱胁迫下,引起膜脂过氧化程度加剧,使番茄植株体内MDA含量升高,POD、CAT、SOD保护酶系统活性上升,干旱处理后期酶活下降;干旱胁迫后复水,清除活性氧保护酶SOD、POD和CAT的活性重新提高,MDA得到清除,膜系统的损伤得到恢复,透性降低,恢复正常的生理代谢机能[34]。
此外,植物体内多数E3泛素连接酶除具抗旱性外,还具有其他抗非生物胁迫的功能,比如,耐盐碱、高低温、外源激素ABA、乙烯等[14,17,22,26,28,36-37]。推测LeRma1基因也可能在植物抵抗以上非生物胁迫中发挥作用。本试验在对番茄LeRma1进行干旱相关研究的同时,也对它在其他非生物胁迫中的作用进行了初步研究。对五叶期番茄进行盐、碱、高温、低温胁迫处理,并用半定量RT-PCR方法检测了LeRma1基因在以上非生物胁迫下的表达量变化。结果显示,在上述胁迫下,LeRma1基因在番茄叶片和根部的表达几乎都有增强的趋势,且在叶片中是胁迫3 h后诱导增强表达,推测LeRma1基因可能在番茄抵抗以上非生物胁迫中发挥作用。其结果也与Lee等[14]相似,在盐和低温处理下,Rma1H1上调表达。因此,推测LeRma1基因可能作为上调基因在以上非生物胁迫中发挥作用,且该基因是否具有上述功能还需进一步的研究。
本研究通过克隆番茄泛素E3连接酶LeRma1基因并对其表达进行研究表明,该基因在番茄成株不同器官中均有表达,且差异不显著。在干旱胁迫下,LeRma1基因在叶片中增强表达,而在根中表达相对稳定,叶片中的表达水平整体高于根,可见该基因可能参与番茄的干旱应答及信号转导过程,且在不同器官所起的调节作用有一定的差异,其机理需进一步研究。此外,研究结果表明该基因在番茄抵抗其他非生物胁迫中也可能发挥一定作用,其功能还需通过转基因方法进一步进行验证。本研究结果为理解番茄的抗旱分子机理提供了试验基础,为番茄抗旱及其他抗非生物胁迫遗传改良提供了理论依据和候选基因资源。
致谢:本研究在植物生物学黑龙江省高校重点实验室内完成。
[1] MUNDY J,CHUA N H.Abscisic acid and water-stress induce the expression of a novel rice gene[J].TheEMBOJournal,1988,7:2 279-2 286.
[2] ABBA S,GHIGNONE S,BONFANTE P.A dehydration-inducible gene in the truffle tuber borchii identifies a novel group of dehydrins[J].BMCGenomics,2006,7:39-54.
[3] BRAY E A.Molecular responses to water deficit[J].PlantPhysiology,1993,103(4):1 035-1 040.
[4] DURE L.A repeating 11-mer amino acid motif and plant desiccation[J].ThePlantJournal,1993,3:363-369.
[5] ROBERTSON M,CHANDLER P M.A dehydrin cognate protein from pea(PisumsativumL.)with an atypical pattern of expression[J].PlantMolecularBiologyReporter,1994,26:805-816.
[6] MOMMA M,KANEKO S,HARAGUCHI K,etal.Peptide mapping and assessment of cryoprotective activity of 26/27 kDa dehydrin from soybean seeds[J].BioscienceBiotechnologyandBiochemistry,2003,67:1 832-1 835.
[7] SOULAGE J L,KIM K,ARREEE E L,etal.Conformation of a Group 2 late embryogenesis abundant protein from soybean:Evidence of poly(L-Proline)-type Ⅱ structure[J].PlantPhysiology,2003,131:963-975.
[8] FARQUHAR G D,RASCHKE K.On the resistance to transpiration of the sites of evaporation within the leaf[J].PlantPhysiology,1978,61:1 000-1 005.
[9] GARAY-ARROYO A,COLMENERO-FLORES J M,Garciarrubio A,etal.Highly hydrophilic proteins in prokaryotes and eukaryotes are common during conditions of water deficit[J].JournalofBiologyChemistry,2000,275:5 668-5 674.
[10] OLIVER A E,LEPRINCE O,WOLKERS W F,etal.Non-disaccharide-based mechanisms of protection during drying[J].Cryobiology,2001,43:151-167.
[11] WU H J(吴慧娟),ZHANG ZH G(张志刚).Ubiquitin-Proteasome pathway and its significance[J].JournalofInternationalPathologyandClinicalMedicine(国际病理科学与临床杂志),2006,26(1):7-10(in Chinese).
[12] STONE S L,CALLIS J.Ubiquitin Ligases mediate growth and development by promoting protein death[J].CurrentOpinioninPlantBiology,2007,10(6):624-632.
[13] LEE J H,KIM W T.Regulation of abiotic stress signal transduction by E3 ubiquitin ligases inArabidopsis[J].MoleculesandCells,2011,31(3):201-208.
[14] LEE H K,CHO S K,SON O,etal.Drought stress-induced Rma1H1,a RING membrane-anchor E3 ubiquitin ligase homolog,regulates aquaporin levels via ubiquitination in transgenicArabidopsisplants[J].PlantCell,2009,21:622-641.
[15] VIERSTRA R D.The ubiquitin-26S proteasome system at the nexus of plant biology[J].NatureReviewsMolecularCellBiology,2009,10(6):385-397.
[16] BAE H,KIM S K,CHO S K,etal.Overexpression ofOsRDCP1,a rice RING domain-containing E3 ubiquitin ligase,increased tolerance to drought stress in rice(OryzasativaL.)[J].PlantSci,2011,180:775-782.
[17] SEO Y S,CHOI J Y,KIM S J,etal.Constitutive expression of CaRma1H1,a hot pepper ER-localized RING E3 ubiquitin ligase,increases tolerance to drought and salt stresses in transgenic tomato plants[J].PlantCellReports,2012,31(9):1 659-1 665.
[18] 高俊凤.植物生理学实验指导[M].西安:世界图书出版社,2000:192-199.
[19] 孙 群.植物生理学研究技术[M].陕西杨凌:西北农林科技大学出版社,2007:138-171.
[20] PARK J A,CHO S K,KIM J E,etal.Isolation of cDNAs differentially expressed in response to drought stress and characterization of the Ca-LEAL1 gene encoding a new family of atypical LEA-like protein homologue in hot pepper(CapsicumannuumL.cv.Pukang)[J].PlantSci,2003,165:471-481.
[21] ZEBA N,ISBAT M,KWON N J,etal.Heat-inducible C3HC4 type RING zinc finger protein gene fromCapsicumannuumenhances growth of transgenic tobacco[J].Planta,2009,229(4):861-871.
[22] CHO S K,RYU M Y,SEO D H,etal.TheArabidopsisRING E3 ubiquitin ligase AtAIRP2 plays combinatory roles with AtAIRP1 in abscisic acid-mediated drought stress responses[J].PlantPhysiology,2011,157(4):2 240-2 257.
[23] CATALA R,OUYANG J,ABREU I A,etal.TheArabidopsisE3 SUMO ligase SIZ1 regulates plant growth and drought responses[J].ThePlantCellOnline,2007,19(9):2 952-2 966.
[24] XIA Z L,LIU Q,WU J,etal.ZmRFP1,the putative ortholog of SDIR1,encodes a RING-H2 E3 ubiquitin ligase and responds to drought stress in an ABA-dependent manner in maize[J].Gene,2012,495(2):146-153.
[25] ZHANG Y,YANG C,LI Y,etal.SDIR1 is a RING finger E3 ligase that positively regulates stress-responsive abscisic acid signaling inArabidopsis[J].ThePlantCellOnline,2007,19(6):1912-1929.
[26] KANG M,FOKAR M,ABDELMAGEED H,etal.ArabidopsisSAP5 functions as a positive regulator of stress responses and exhibits E3 ubiquitin ligase activity[J].PlantMolecularBiology,2011,75(4-5):451-466.
[27] XIA Z L,SU X H,LIU J J,etal.The RING-H2 finger gene 1(RHF1)encodes an E3 ubiquitin ligase and participates in drought stress response inNicotianatabacum[J].Genetica,2013,141:11-21.
[28] LIU F F(刘方方),JIANG T(姜 涛).Expression pattern assay ofZmGW2,a RING-domain E3 ubiqutin ligase gene in maize[J].JournalofMaizeSciences(玉米科学),2013,21(2):47-51(in Chinese).
[29] DHINDSA R S,MATOWE W.Drought tolerance in two mosser:Corre-lated with enzymatic defence against lipid peroxidation[J].JournalofExperimentalBotany,1981,(32):79-91.
[30] ZHU Q S(朱其松),etal.Herbicide-induced oxidative stress in seedlings of two rice cultivars with different chilling tolerance[J].JournalofNuclearAgriculturalSciences(核农学报),2009,23(1):145-149(in Chinese).
[31] SUN F X(孙方行),etal.Effect of NaCl stress on lipid peroxidation and activity of cell defense enzymes in leaves of cercis chinensis seedlings[J].JournalofCentralSouthforestryUniversity(中南林学院学报),2005,25:34-37(in Chinese).
[32] GRANTJ J.,LOAKEG J.Role of reactive oxygen intermediates and cognatered oxsignaling in disease resistance[J].PlantPhysiology,2000,(124):21-29.
[33] LI C.Z.,JIAO J.,WANG G.X.The important roles of reactive oxygen species in the relationship between ethylene and polyamines in leaves of spring wheat seedlings under root osmotic stress[J].PlantScience,2004,(166):303-315.
[34] HE CH K(何承坤),GUO S ZH(郭素枝),LI J SH(李家慎).Effects of drought stress oil activated oxygen metabolism in tomato[J].JournalofFuJianAgricultureUniversity(福建农业大学),1996,25(3):307-311(in Chinese).
[35] SUN S J(孙三杰),LI J M(李建明),YAO Y ZH(姚勇哲),etal.Effects of sub-low temperature and drought stress on osmotic substances and activities of antioxidant enzymes in tomato seedling[J].AgriculturalResearchintheAridAreas(干旱地区农业研究),2012,30(3):154-158(in Chinese).
[36] KIM J H,KIM W T.TheArabidopsisRING E3 ubiquitin Ligase AtAIRP3/LOG2 participates in positive regulation of high salt and drought stress responses[J].PlantPhysiology,2013,21:3.
[37] MIURA K,NOZAWA R.Overexpression of SIZ1 enhances tolerance to cold and salt stresses and attenuates response to abscisic acid inArabidopsisthaliana[J].PlantBiotechnology,2014,31:167-172.
(编辑:宋亚珍)
Clone and Expression ofLeRma1 fromLycopersiconesculentumMill.
CHEN Mo1,2,JIN Xiaoxia1*,YU Lijie1,ZHU Hong1,DING Guohua1,FU Wenshang1,FU Chang1
(1 Life Science and Technology,Harbin Normal University,Key Laboratory of Plant Biology of Heilongjiang Province,Harbin 150025,China;2 Mishan No.1 Middle School,Mishan,Heilongjiang 158300,China)
The experiment cloned an E3 ubiquitin ligase geneLeRma1(GenBank accession No XM_004243764.1)by RT-PCR method with tomato ‘Hadafen 801’ used as experimental materials.To provide a theoretical basis for the cultivation and improved varieties of tomato,we analyzed the gene sequence,while studied the expression and physiological characteristics ofLeRma1 gene in different parts of the tomato plants under abiotic stress(drought,salt,alkali,high temperature,low temperature).The results showed that:(1)LeRma1 gene sequence analysis showed that the length ofLeRma1 gene was 729 bp,which encoded 242 amino acids.It was predicted that the molecular mass of its protein was 27.05 kD,and pI was 7.97.Homology analysis showed that the deduced amino acid sequence exhibited high homology with Solanum tuberosum(91% similarity).(2)RT-PCR results indicating that the gene were expressed in roots,stems,leaves,flowers and fruits of tomato,and the changes in expression levels were not significantly different.(3)Expression ofLeRma1 had the advantage in leaves,and the changes in expression levels were not significantly different in roots under the whole drought stress.The other drought-related genesDREB2A,LEA,ABI3 are all expression in leaves,and they were enhanced expression compared with the control,whileDREB2A,ABI3 have not detected in roots under the whole drought stress.(4)Major membrane lipid peroxidation product of MDA content was increased significantly,and plasma membrane systems were severely damaged,the protective enzyme activity increased significantly,and activity in roots was significantly higher than that in leaves.(5)LeRma1 gene was enhanced expression in roots and leaves of tomato,and the gene in the leaves all starting enhanced expression after stress 3 h under abiotic stress(salt,alkali,high temperature,low temperature).The results showed thatLeRma1 was the gene of enhancement expression by drought-induced and it had the advantage in leaves.It showed that there were some differences that the function of theLeRma1 genes in different tissues(organizational differences)under drought stress,andLeRma1 genes may be participate response of drought stress tolerance and the signal transduction process,it also might play an important role in the tomato under the other abiotic stresses.
tomato;LeRma1;clone;expression
1000-4025(2015)09-1735-11
10.7606/j.issn.1000-4025.2015.09.1735
2015-05-07;修改稿收到日期:2015-08-20
黑龙江省教育厅面上项目(12531204,12531178);植物生物学黑龙江省高校重点实验室开放课题(ZK201205);哈尔滨师范大学青年学术骨干资助计划(KGB201218,09KXQ-01);黑龙江省普通高等学校青年学术骨干支持计划;哈尔滨师范大学硕士研究生创新科研项目(HSDSSCX2014-32) 作者简介:陈 默(1989-),女,在读硕士研究生,主要从事植物分子生物学研究。E-mail:chenmo1989smile@163.com
Q785;Q786
A
*通信作者:金晓霞,博士,讲师,主要从事植物分子生物学研究。E-mail:xiaoxia6195@126.com
