肿瘤睾丸抗原乳酸脱氢酶C蛋白表达对肾癌细胞功能影响的实验研究
2015-05-05王尚乾
李 双,张 磊,王尚乾,秦 超
(南京医科大学第一附属医院,江苏南京 210029)
·基础研究·
肿瘤睾丸抗原乳酸脱氢酶C蛋白表达对肾癌细胞功能影响的实验研究
(南京医科大学第一附属医院,江苏南京 210029)
目的 研究肿瘤睾丸抗原LDHC蛋白表达对肾癌细胞侵袭迁移等生物学功能的影响。方法 采用siRNA技术在肾癌细胞系Caki-1中降低乳酸脱氢酶C(LDHC)的表达,通过细胞侵袭和迁移实验研究LDHC蛋白表达水平对肾癌细胞侵袭迁移等生物学行为的影响。同时测定LDHC表达降低后,MMP-9蛋白的表达水平及培养基中乳酸的浓度。结果 当LDHC表达水平下调后,肾癌细胞的侵袭迁移能力减弱,MMP-9蛋白表达水平及培养基中乳酸浓度减低,与空白组及阴性组比较差异显著(P<0.05)。结论 LDHC的表达对肾癌细胞的功能有一定的影响,LDHC的表达降低,肾癌细胞的侵袭迁移能力减弱。其可能机制为LDHC能促进MMP-9的表达和乳酸的产生,从而增强肾癌细胞侵袭及迁移能力。
肾细胞癌;LDHC;siRNA;侵袭;迁移
肿瘤睾丸抗原(cancer-testis antigen, CTA)是一类肿瘤特异性抗原,只在肿瘤中表达,在正常组织(睾丸和胎盘除外)中均不表达,由于这种与肿瘤相关的特异性表达方式,使其成为特异性免疫治疗的理想靶分子[1]。目前,关于这一类基因在肾癌中的表达及其对肿瘤细胞功能影响的研究在国内外都很少。我们前期利用液相色谱-质谱联用(Liquid chromatography-tandem mass spectrometry,LC-MS/MS)高通量蛋白质组学的方法对10例行肾癌根治患者的肾癌组织标本进行蛋白质鉴定,随后我们利用生物信息学分析了最新的人体多组织脏器的二代测序数据[2]并将其代入PageFinder软件[3]中计算并得到了1 152个人类睾丸特异性表达基因。将肾癌蛋白与人类睾丸特异性表达基因进行交叉重合从中找到了本文研究的乳酸脱氢酶C (lactate dehydrogenase C,LDHC)。LDHC为乳酸脱氢酶(LDH)同工酶之一,催化丙酮酸和乳酸之间的可逆反应。哺乳动物体内由同源亚基组成的乳酸脱氢酶有3种:LDHA、LDHB以及LDHC。前两种乳酸脱氢酶广泛分布于各种组织,LDHC则主要分布在睾丸组织中。我们通过对肾癌细胞株Caki-1进行免疫荧光定位发现LDHC在肾癌细胞株中有表达且主要定位于细胞质,胞核可能有弱表达,核仁无表达。本实验运用siRNA技术沉默LDHC基因在肾癌细胞株Caki-1中的表达,并进一步研究LDHC蛋白表达水平对肾癌细胞侵袭、迁移等生物学功能的影响。
1 材料与方法
1.1 材料 人肾癌细胞株Caki-1购于上海细胞生物研究所,兔抗人单克隆抗体LDHC购于Abcam公司;β-actin购于Santa cruz公司;MMP-9抗体购于美国Sigma公司;辣根过氧化物酶羊抗兔二抗购于中杉金桥公司;Negative control siRNA购于上海吉玛公司;Lipofectamin2000购于Invitrogen公司;millicell小室购于Millipore公司;基质胶购于美国BD公司;乳酸测试盒购于南京建成公司。上海吉玛公司针对LDHC序列设计合成3条siRNA,我们采用Western验证筛选出一条有效序列,正义链:5′-CAGAAACACUUUGGAAUAUTT-3′;反义链:5′-AUAUUCCAAAGUGUUUCUGTT-3′,根据说明书用LDEPC水将干粉状siRNA稀释。
1.2 细胞培养 与传代人肾癌细胞株Caki-1用含10%(体积分数)小牛血清的McCoy’s5A培养基,在37 ℃,5%CO2条件下培养,隔天换液;细胞长满单层后用0.25%胰蛋白酶消化1 min左右,10%小牛血清的5A培养基终止消化,用吸管轻轻吹打,制成细胞悬液,1 000 r/min离心5 min,弃上清按1×105/mL的浓度传代。
1.3 细胞转染 于转染前24 h 取对数生长期的Caki-1细胞,经消化、离心、重悬、计数,调整细胞浓度至1.0×105个/mL,接种于6孔板,温箱培养,待细胞浓度至70%后转染。设置空白组、阴性组(negative control siRNA转染组)、实验组(LDHC siRNA转染组)。配置A、B液,A液为5 μL siRNA+250 μL DMEN,空白组为300 μL DMEM;B液为5 μL Lipofectamin 2000+250 μL DMEM,室温5 min,将A液和B液混合,室温放置15 min,将混合液加入6孔培养板中,放入CO2温箱培养,8 h后换液,置温箱继续培养48~72 h。
1.4 侵袭、迁移实验 用50 mg/L Matrigel 1∶8稀释液100 μL包被millicell小室底部膜的上室面,37 ℃风干。取转染后48 h各组细胞,消化离心,用PBS洗2遍,加入无血清5A培养基重悬,调整细胞浓度至2.5×105/mL,取各组细胞200 μL加入millicell小室,下室加入500 μL含20%FBS的5A培养基,37 ℃恒温培养32 h。孵育结束后稍用PBS洗,用棉签擦去millicell小室上室面基质胶和细胞,将小室浸入4%甲醛溶液中固定15 min,PBS清洗3次,然后于苏木精中10 min,再用PBS清洗3次。200倍光镜下计数小室膜背面的细胞。迁移实验,小室内不铺胶,其余步骤同侵袭实验。
1.5 乳酸浓度测量 Caki-1细胞转染24 h 后,PBS 清洗2 次,每孔换成2 mL新鲜完全培养液,每组设3个复孔。继续培养24 h,收集细胞上清,离心去除细胞碎片后用乳酸试剂盒检测产生乳酸的量。同时将孔里的细胞用胰酶消化,进行计数,用产生的乳酸量除以相应的细胞总数,即可得出平均每106个细胞对应的乳酸产生量。
2 结 果
2.1 转染细胞LDHC蛋白水平的变化 Caki-1细胞经siRNA作用48 h后,提取蛋白行Western blot,LDHC为目的蛋白,β-actin为内参,实验组LDHC蛋白表达量较阴性组或空白组显著降低(P<0.05),阴性组LDHC蛋白表达水平较空白组差异无统计学意义(P>0.05,图1)

图1 各处理组Caki-1细胞经siRNA转染48 h后蛋白表达量
2.2 转染细胞侵袭、迁移能力的变化 Caki-1细胞经siRNA作用48 h后,实验组侵袭迁移穿膜细胞数较空白组、阴性组显著下降(P<0.05),后两者差异无统计学意义(P>0.05)。转染后Caki-1细胞侵袭和迁移能力明显抑制(图2)。
2.3 转染细胞培养基乳酸浓度的变化 Caki-1细胞经siRNA作用48h后,实验组培养基中乳酸浓度较空白组、阴性组差异具有统计学意义(P<0.05, 图3)。
2.4 转染细胞MMP-9蛋白水平的变化 各处理组Caki-1细胞经siRNA作用48 h后,提取蛋白行Western blot,MMP-9为目的蛋白,β-actin为内参,实验组MMP-9蛋白表达量较阴性组和空白组显著降低(P<0.05),阴性组MMP-9蛋白表达水平较空白组差异无统计学意义(P>0.05,图4)。
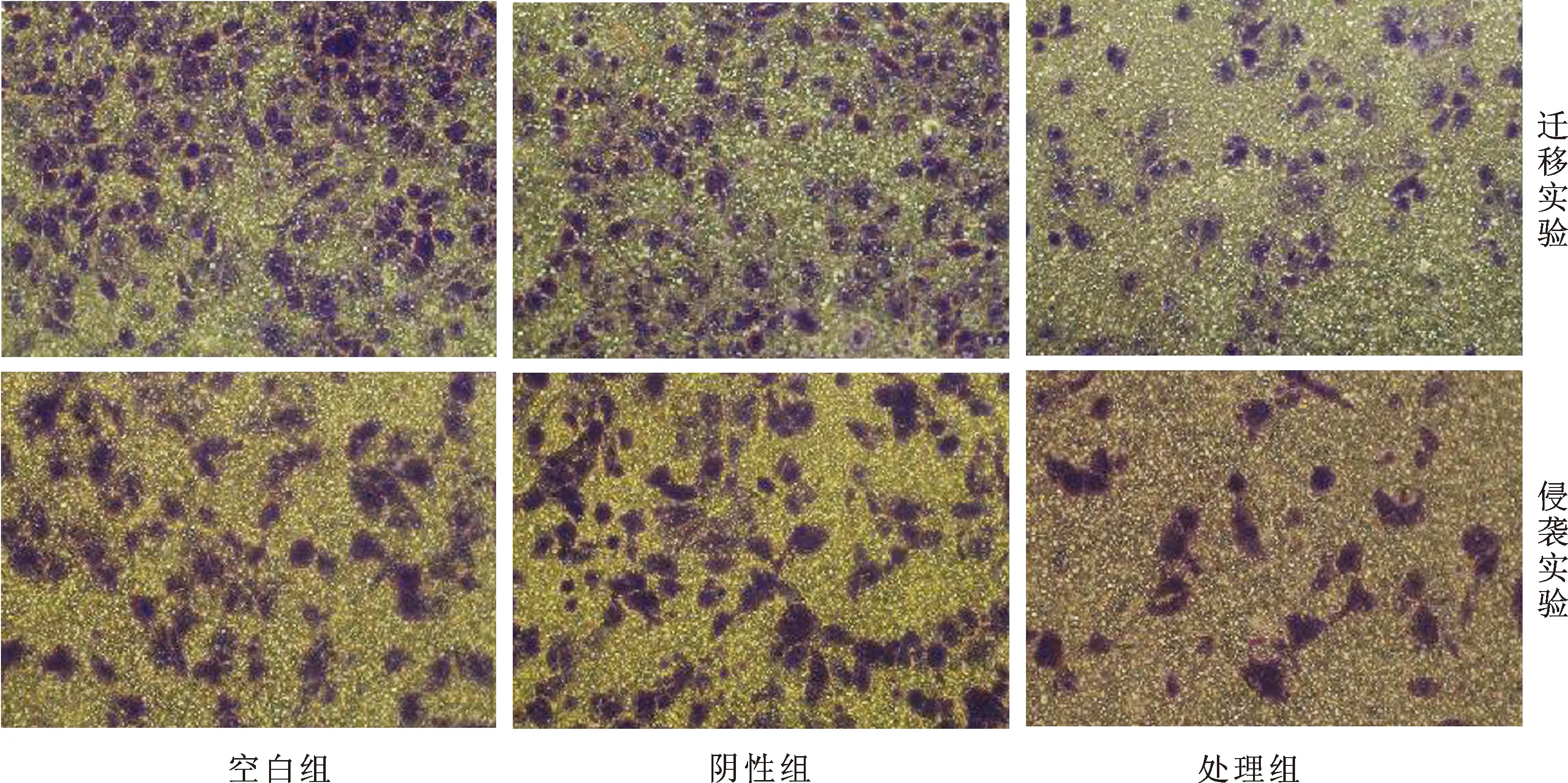
图2 光学显微镜下肾癌细胞侵袭和迁移穿膜细胞数的变化(HE,×200)
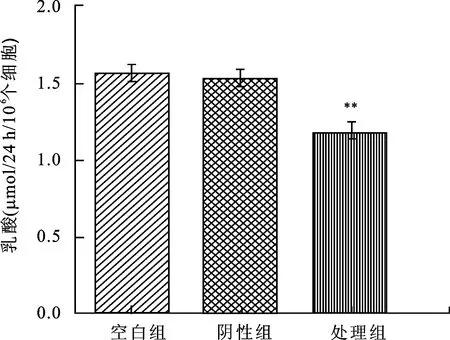
图3 转染细胞生成乳酸能力变化

图4 转染细胞MMP-9蛋白水平变化
3 讨 论
LDHC的基因位于人类染色体11p15.1区,以多分子四聚体的形式存在于细胞内。与大部分NAD依赖的乳酸脱氢酶相同,LDHC的分子量在140 ku左右。LDHC是第一个在男性生殖细胞中发现的具有睾丸特异性的同工酶[4]。与LDHA、LDHB相比,LDHC在动力学及酶底物上有其不同之处,Km值测定显示其与乳酸有较高的亲合力,而且其酶活性具有很好的热稳定性[5]。目前,尚无LDHC在肾癌中表达及对肾癌细胞功能影响的相关报道。
本实验利用siRNA技术成功诱导Caki-1细胞系中LDHC基因的下调。Western结果显示实验组LDHC的表达明显低于空白和阴性组,且空白和阴性组无明显差异,从而证实LDHC基因被成功下调。
我们使用的Caki-1细胞是恶性肾癌细胞,具有侵袭和迁移的能力。根据millicell小室侵袭及迁移实验结果显示实验组侵袭和迁移穿膜细胞数较阴性组、空白组均显著下降,而后两者穿膜细胞数差异无统计学意义。可见LDHC蛋白对Caki-1细胞穿膜能力有明显增强作用。其具体机制可能为LDHC能促进MMP-9的表达和乳酸的产生,从而增强了Caki-1的侵袭及迁移能力。
侵袭和迁移是恶性肿瘤的重要特征,而肿瘤细胞具备这种能力的先决条件是破坏基底膜的完整性,这一过程是肿瘤细胞和细胞外间质相互作用的结果。MMP-9是一种依赖金属离子-锌的蛋白水解酶,能分解基底膜的骨架成分-Ⅳ型胶原。基底膜中的胶原蛋白被分解,其结构被破坏,从而失去对肿瘤的阻隔作用。多篇文献报道MMP-9与多种肿瘤的侵袭和迁移密切相关[6-9]。本实验中,Caki-1细胞中LDHC被成功下调后,与阴性组和空白组相比,实验组MMP-9蛋白表达量明显降低,表明细胞内LDHC表达下调后可能通过减少MMP-9蛋白表达从而抑制肾癌细胞的侵袭迁移能力。
大量研究表明即使在正常氧条件下,肿瘤细胞也优先通过糖酵解途径分解葡萄糖获取能量,消耗大量葡萄糖的同时产生乳酸,此现象称为“有氧糖酵解”,又被命名为“Warburg 效应”[10]。Warburg 效应在多种肿瘤中存在,被认为是肿瘤的基本特征之一。基于这种效应,肿瘤细胞通过活跃的糖酵解代谢产生大量丙酮酸。LDH作为糖酵解通路最后一步的调节酶,可以将大量堆积的丙酮酸转化为乳酸,进而让局部pH降低。近年的研究显示,肿瘤的局部酸性微环境与肿瘤的浸润和转移有明显的相关性[11-12]。VÉGRA[13]等发现乳酸可以通过单羧酸转运蛋白1进入内皮细胞,引起IκBα的降解和磷酸化,进而刺激自分泌核转录因子κB/白细胞介素8通路引起细胞的迁移。GOETZE等[14]通过Boyden小室分析研究乳酸对肿瘤细胞迁移性的影响,发现高浓度乳酸能抑制单核细胞迁移和细胞因子释放,导致免疫逃避,从而促进肿瘤的转移。本实验中,利用siRNA技术沉默LDHC的表达之后,实验组培养基中乳酸浓度较阴性组和空白组均有所降低,表明细胞内LDHC表达下调后可通过减少乳酸生成从而抑制肾癌细胞的侵袭迁移能力。
肾细胞癌是泌尿系统常见的恶性肿瘤,约占成人恶性肿瘤的2%~3%[15]。手术切除是目前治疗肾癌唯一有效的方法,但仍有近1/3的肾癌患者在确诊时已发生远处转移而失去手术机会,其5年生存率不足20%。而即使接受了根治性肾切除术,局限性肾癌的患者术后仍有20%~40%复发率[16]。由于肾癌对放、化疗均不敏感,因此选择有效的特异性免疫治疗靶向分子可以用于晚期肾癌术后的辅助治疗。因此深入探讨肾癌中的LDHC蛋白表达对肾癌细胞生物学功能的影响及其对肾癌发生发展的机制,对评估预后以及指导患者的个体化治疗具有重要的理论意义和实际应用价值。
[1] GHAFOURI-FARD S, SHAMSI R, SEIFI-ALAN M,et al. Cancer-testis genes as candidates for immunotherapy in breast cancer[J]. Immunotherapy, 2014,6(2):165-179.
[2] CABILI MN, TRAPNELL C, GOOF L, et al. Integrative annotation of human large intergenic noncoding RNAs reveals global properties and specific subclasses[J]. Genes Dev,2011 15;25(18):1915-1927.
[3] PAN JB, HU SC, WANG H, et al. PaGeFinder: quantitative identification of spatiotemporal pattern genes[J]. Bioinformatics. 2012, 28, 1544-1545.
[4] GOLDBERG E, EDDY EM, DUAN C, et al. LDHC: the ultimate testis-specific gene[J]. J Androl,2010,31(1):86-94.
[5] LEVAN KM,GOLDBERG E. Properties of human testis-specific lactate dehydrogenase expressed from Escherchia coli[J]. Biochem J,1991,273(Pt 3):587-592.
[6] SUN GG, WEI CD, JING SW, et al. Interactions between filamin A and MMP-9 regulate proliferation and invasion in renal cell carcinoma[J]. Asian Pac J Cancer Prev,2014,15(8):3789-3795.
[7] SATO A, NAGASE H, OBINATA D, et al. Inhibition of MMP-9 using a pyrrole-imidazole polyamide reduces cell invasion in renal cell carcinoma[J]. Int J Oncol,2013,43(5):1441-1446.
[8] LIN F, CHENGYAO X, QINGCHANG L, et al. CRKL promotes lung cancer cell invasion through ERK-MMP9 pathway[J]. Mol Carcinog,2014,24:87-91.
[9] HAN S, HAN L, YAO Y, et al. Activated hepatic stellate cells promote hepatocellular carcinoma cell migration and invasion via the activation of FAK-MMP9 signaling[J]. Oncol Rep,2014 Feb;31(2):641-648.
[10] KOPPENOL WH, BOUNDS PL, DANG CV, et al. Otto Warburg’s contributions to current concepts of cancer metabolism[J]. Nat Rev Cancer,2011,11(5):325-337.
[11] BONUCCELLI G, TSIRIGOS A, WHITAKER-MENEZES D, et al. Ketones and lactate "fuel" tumor growth and metastasis: Evidence that epithelial cancer cells use oxidative mitochondrial metabolism[J]. Cell Cycle, 2010, 9(17):3506-3514.
[12] ESTRELLA V, CHEN T, LLOYD M, et al. Acidity generated by the tumor microenvironment drives local invasion[J]. Cancer Res,2013,73(5):1524-1535.
[13] VÉGRN F, BOIDOT R, MICHIELS C, et al. Lactate influx through the endothelial cell monocarboxylate transporter MCT1 supports an NF-κB/IL-8 pathway that drives tumor angiogenesis[J]. Cancer Res,2011,71(7):2550-2560.
[14] GOETZE K, WALENTA S, KSIAZKIEWICZ M, et al. Lactate enhances motility of tumor cells and inhibits monocyte migration and cytokine release[J]. Int J Oncol,2011 Aug;39(2):453-463.
[15] VAN SPRONSEN DJ, DE WEIJER KJ, MULDERS PF, et al. Novel treatment straegies in clear cell metastatic renal cell carcinoma[J]. Anticancer Drugs, 2005, 16(7):709-717.
[16] JANZEN NK, KIM HL, FIGLIN RA, et al. Surveillance after radical or partial nephrectomy for localized renal cell carcinoma and management of recurrent disease[J]. UrolClin North Am, 2013, 30(4): 843-852.
(编辑 何宏灵)
Effect of cancer-testis antigen LDHC on the invasion and metastasis of renal cell carcinoma
(the First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China)
Objective To investigate the effect of LDHC protein on the invasion and metastasis of renal cell carcinoma. Methods Small interfering RNA mediated gene silencing approach was used to knockdown LDHC in renal cell carcinoma. The malignant characters of transfected Caki-1 cells including activities of invasion and metastasis were analyzed using millicell chamber assay. Western blot was used to quantify protein levels of LDHC and MMP-9. Lactic acid concentration in culture medium was measured. Results siRNA effectively inhibited LDHC protein levels (P<0.05). With siRNA interfering cells, the invasion and metastasis abilities of cells were depressed (P<0.05). Lactic acid concentration was decreased. The protein level of MMP-9 was reduced. Conclusions The expression of LDHC is associated with the function of RCC cells, whose invasion and metastasis abilities are depressed. The possible mechanism is that LDHC may enhance the expression of MMP-9 and increase the concentration of lactic acid in culture medium.
renal cell carcinoma; LDHC; siRNA; invasion; metastasis
2015-03-09
2015-05-22
李双(1989-),男(汉族),在读硕士研究生.研究方向:泌尿肿瘤. E-mail:doctorsli@163.com
R737.25
A
10.3969/j.issn.1009-8291.2015.010.015
