单增李斯特菌P60单克隆抗体的制备及初步应用
2015-05-05朱学亮周邦信骆学农
殷 茵,刘 溯,王 芳,朱学亮,周邦信, 骆学农
单增李斯特菌P60单克隆抗体的制备及初步应用
殷 茵1,2,刘 溯3,王 芳2,朱学亮2,周邦信2, 骆学农2
目的 制备并筛选单增李斯特菌P60特异性单克隆抗体,初步建立其快速检测方法。方法 以体外表达并纯化的李斯特菌P60蛋白为抗原免疫Balb/c 小鼠, 采用杂交瘤技术制备抗李斯特菌P60的McAb,鉴定其抗体亚型,并对单抗的腹水效价、稳定性及亲和力进行分析。用纯化的单克隆抗体包被酶标板,结合生物素化处理的P60多克隆抗体,夹心ELISA筛选单增李斯特菌特异性单抗,并以重组P60为标准品,建立标准曲线。结果 获得了4株可稳定分泌P60单克隆抗体的杂交瘤细胞株。ELISA检测表明,筛选的6C2单克隆抗体株可特异性与单增李斯特菌(4b)P60反应。结论 建立的夹心ELISA方法可对单增李斯特菌进行特异性鉴别和定量检测。
单增李斯特菌;P60;单克隆抗体;鉴定;ELISA
单核细胞增生性李斯特菌(Listeriamonocytogenes, LM) 简称单增李斯特菌,是一种能引起人兽共患的食源性致病菌。该菌属于细胞内寄生的革兰氏阳性杆菌,人畜感染后,主要表现为脑膜炎、败血症和血液中单核细胞增多等症状,死亡率达20%~30%[1]。该菌在自然界广泛存在,食品中存在的单增李斯特菌对人类安全构成很大威胁,是21世纪对人类健康具有重大影响的12种病原微生物之一[2]。
李斯特菌包括单增李斯特菌(Listeriamonocytogenes)、伊氏李斯特菌(L.ivanovii)、无害李斯特菌(L.innocua)、威氏李斯特菌(L.welshimeri)、塞氏李斯特菌(L.seeligeri)。除L.M对人畜致病性高外,其它的都致病力很小或无致病力,而且在自然界中普遍存在。因此,如何区分食品污染的是致病性李斯特菌还是其它常在李斯特菌,是食品工业或动物李斯特菌病免疫学诊断的首要课题。目前,传统的检测方法要经过增菌、细菌分离以及生化鉴定等过程,因而所需时间较长,花费人力物力较大,不适合快速检测的需要。分子检测技术如PCR、基因探针等分子生物学方法[3-4],需要昂贵的实验仪器, 而且特异性差。 因此,不适合在现场对大量样品进行快速检测。
国内外一些学者对单增李斯特菌单克隆抗体的制备以及ELISA检测方法进行了很多研究,但这些研究大都以ActA、LLO等为研究对象。鉴于P60蛋白与李斯特菌侵袭性、免疫原性和种属分类密切相关。本研究以原核表达的重组P60蛋白为免疫原,制备并筛选出了单增李斯特菌特异性单克隆抗体,初步建立了基于P60的夹心ELISA方法,用于食品及动物产品中单增李斯特菌的特异性检测。
1 材料和方法
1.1 菌株和细胞 单增李斯特菌(ATCC 19115,19117) 、绵羊李斯特菌(ATCC 19119)、无害李斯特菌(ATCC 51742)、塞氏李斯特菌(ATCC 35967)、维氏李斯特菌(ATCC 35897)均购自美国模式培养物集存库(American type culture collection)即ATCC公司。重组菌株pET-p60/BL21由本实验构建并保存,SP2/0骨髓瘤细胞由本实验室液氮保存。
1.2 实验动物 Balb/c纯系雄性小鼠购自兰州生物制品研究所,鼠龄6~8周,体重18~22 g,用于免疫和制备饲养细胞;5月龄雌鼠用于制备腹水。
1.3 主要试剂 镍琼脂糖凝胶FF蛋白纯化回收试剂(北京韦氏博慧)、改良型RPMI 1640培养基、胎牛血清(Hy Clone)、HAT、HT、聚乙二醇( PEG 1500 )、弗氏完全佐剂、弗氏不完全佐剂(Sigma),小鼠单克隆抗体亚型检测试剂盒(Iso Strip)、羊抗鼠IgG-HRP(北京博奥森)、HiTrapTMProtein G HP Columns (GE)。生物素N羟基丁二酰亚胺脂(BNHS)、二甲基甲酰氨(DMF)、辣根过氧化物酶标记的链霉素(Sigma)。
1.4 免疫抗原的制备 将携带pET-p60质粒的BL21重组菌株37 ℃培养过夜,将菌液按1.0%接种于含卡那霉素(50 μg/mL)的2×YT培养基中,37 ℃剧烈振摇3~4 h,加IPTG(终浓度为1 mmol/L)诱导表达4~5 h。将诱导表达的菌液离心收集菌体,反复冻融及超声波处理后收集上清,用镍琼脂糖凝胶FF纯化回收目的蛋白。SDS-PAGE分析重组P60蛋白的纯化效果,用Thermo Scientific NanoDrop 2000测定蛋白浓度。
1.5 Balb/ c小鼠的免疫与细胞融合 首次免疫用纯化的P60蛋白100 μg加等量弗氏完全佐剂,混匀制成乳剂,皮下注射6~8周龄雌性Balb/c小鼠。此后改用弗氏不完全佐剂乳化抗原,隔21 d进行加强免疫。于融合前3 d,经小鼠脚掌肌肉进行加强免疫。断尾采血,用间接ELISA检测小鼠血清抗体效价,选取抗体效价最高的小鼠进行细胞融合。将小鼠骨髓瘤细胞SP2/0与免疫小鼠脾细胞(1∶10)在500 μg/L PEG介导下进行融合。加入含有次黄嘌呤-氨基蝶呤-胸腺嘧啶核苷(HAT)的RPMI 1640选择性培养液,在37 ℃、5%CO2条件下培养,2周后换次黄嘌呤2胸腺嘧啶核苷(HT)培养液继续培养。
1.6 杂交瘤细胞的克隆与亚型鉴定 将HT培养液中生长的杂交瘤细胞,用有限稀释法进行克隆化培养。当细胞生长至铺满孔底1/ 4~1/ 3 时,用间接ELISA方法进行检测,选择阳性值高的单克隆细胞株进行再克隆,直至阳性率达到100 %。间接ELISA操作步骤如下:用P60抗原包被酶标板,每孔100 μL,4 ℃包被过夜。按100 μL/孔加入杂交瘤培养上清液,37 ℃反应1 h ,洗涤3次,加入辣根过氧化物酶标记的羊抗鼠IgG抗体,每孔100 μL,37 ℃反应1 h,洗涤3 次,再加入底物( OPD) 显色,每孔100 μL,并用2 mol/L H2SO4终止,每孔50 μL,在酶标仪上测定OD490 nm值。阴性对照孔为1∶200的正常Balb/c小鼠血清,阳性对照孔为1∶200的免疫小鼠血清。
取细胞培养上清液,利用单克隆抗体亚型鉴定试剂盒鉴定单克隆抗体的免疫球蛋白类型及亚型。
1.7 单克隆抗体腹水的制备与效价测定 Balb/c小鼠腹腔注射0. 5 mL液体石蜡(高压灭菌),7~10 d 后腹腔注入1×106~5×106个杂交瘤细胞。注射后7~10 d ,可见小鼠腹部明显膨大,无菌操作采集腹水,1 000 r/ min离心10 min,弃去最上层的脂肪层,收集中间液体层,即为单克隆抗体腹水。 用重组P60抗原包被96孔酶标板,4 ℃过夜,将粗制腹水10倍系列稀释(1∶10~1∶109),采用间接EL ISA 测定抗体效价。
1.8 单克隆抗体的物理性质分析 用P60抗原包被酶标板,将腹水按不同比例稀释,用间接ELISA以进行腹水亲和力测定。根据下列公式计算单克隆抗体的亲和常数[10]:
AI=[2A1+2/(A1+A2)-1]×100%
上式中A1表示第1 株单抗的OD 490值;A2表示第2株单抗的OD 490值;A1+2表示2 株单抗两两叠加后的OD 490值。
取粗制腹水用pH 7.2的PBS做1∶1 000稀释,置56 ℃水浴中4 h、8 h、12 h、24 h、36 h、48 h,分别用ELISA检测其OD值的变化,分析单克隆抗体的热稳定性;同时以pH 2.2的盐酸和pH9.6的碳酸盐缓冲液分别对腹水做1∶10稀释,评价单抗对酸碱的稳定性。
采用饱和硫酸铵沉淀法结合HiTrapTMProtein G HP Columns纯化腹水,进行SDS-PAGE分析,Thermo Scientific NanoDrop 2000测定纯化后腹水的浓度。
1.9 生物素化多克隆抗体的制备 用纯化的P60蛋白免疫家兔,制备P60多克隆抗体。将多抗用饱和硫酸铵沉淀,然后用蛋白G柱进行纯化,测定蛋白含量。用DMF将BNHS配成1 mg/mL溶液,再用0.1 mol/L pH9.0的NaHCO3将多抗稀释至1 mg/mL,按BNHS∶IgG体积比1∶8~1∶15震荡混匀10 min,室温静置3~4 h,将混合物装入透析袋中4 ℃透析过夜,加入等体积甘油,-20 ℃保存备用。
1.10 夹心ELISA检测方法的初步建立 分别用100 μL的2E4、3H5和6C2(5F8单抗效价太低)单抗包被酶标板。将L.monocytogenes、L.ivanovii、L.innocua、L.welshimeri和L.seeligeri分别接种BH培养液,过夜培养后离心收集上清作为待检样品,分别取100 μL加入已用单抗包被的酶标板中,再加入生物素化的P60多抗,室温温育30 min后,加入辣根过氧化物酶标记的链霉亲合素(Streptavidin),室温温育30 min。加入TMB底物溶液显色,测定OD450nm的值。根据OD450 nm的值确定仅与L.monocytogenes反应的单抗株。用筛选确定的L.monocytogenes特异性单抗包被酶标板,用纯化的重组P60作为标准品溶液(2 000 pg/mL),倍比稀释后每孔100 μL分别加入酶标板的反应孔中,再加入生物素化的P60多抗,室温温育30 min后,加入辣根过氧化物酶标记的Streptavidin,室温温育后加入TMB底物溶液显色,测定OD450 nm的值。以标准品的浓度为横坐标,所测OD450 nm为纵坐标绘制标准曲线。根据夹心ELISA所测得的OD450 nm值,从标准曲线即可计算所测样品中P60蛋白的浓度。
2 结 果
2.1 抗原制备 将表达菌体裂解上清进行SDS-PAGE分析,大约在46 ku的位置有一条浓染的蛋白条带,与预期分子量一致;镍琼脂糖凝胶FF纯化后的表达产物经SDS-PAGE分析显示(图1),在46 ku处有单一蛋白带,表明目的蛋白获得了较好的纯化效果。

M:蛋白质标准分子量;1:诱导表达产物;2:纯化后的重组蛋白:
M: Protein marker; 1: pET-P60/BL21 induced by IPTG; 2: Purified recombinant protein.
图1 P60重组抗原的SDS-PAGE分析
Fig.1 SDS-PAGE analysis of recombined p60 protein

图2 抗P60单克隆抗体的亚型鉴定
2.2 单克隆抗体亚型鉴定与效价测定 经细胞融合与克隆筛选,共获得4株P60单克隆抗体杂交瘤细胞,分别为2E4、5F8、3H5和6C2。其中2E4、5F8和6C2为IgG1亚型,3H5为IgG2a亚型。ELISA测定2E4的腹水效价为1∶104,3H5为1∶104,5F8为1∶103,6C2为1∶106(图2)。
2.3 单克隆抗体物理性质分析 经测定腹水中McAb与包被抗原反应的饱和浓度,2E4和3H5均为10-3,5F8为10-2,6C2为10-5。根据McAb饱和度,用间接ELISA法相加试验进行4株单抗识别的抗原表位分析,检测结果见表1。
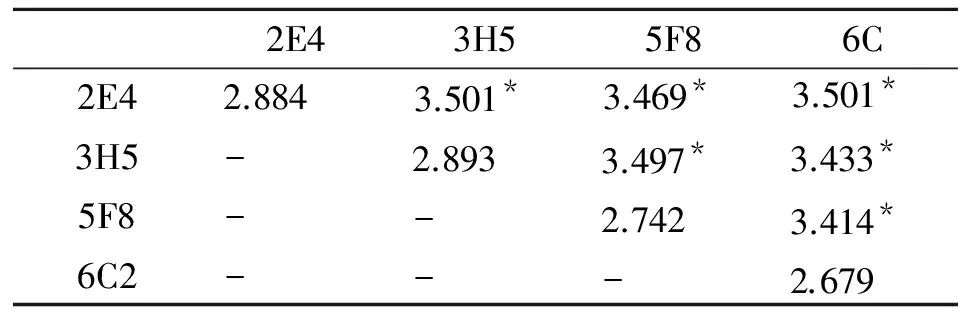
表1 4株单抗识别抗原表位的分析
注:未标注星号为每株单抗的OD 490值,标星号的为2株单抗两两叠加后的OD 490值
Note: Without asterisk numbers represent the value of OD490 for each McAb. The numbers marked with asterisk refer to accumulated value of two McAb.
根据表中数据计算的AI值表明,2E4与3H5识别相同的抗原表位,2E4与5F8识别相同的抗原表位;2E4与6C2识别相同的抗原表位;3H5与5F8识别相同的抗原表位;3H5与6C2识别相同的抗原表位;5F8与6C2识别相同的抗原表位。
4株杂交瘤细胞株的腹水的稳定性均不受热和碱的影响,但均受酸的影响。
2.4 单克隆抗体腹水纯化与浓度测定 纯化前后单克隆抗体腹水的SDS-PAGE分析结果见图3。2E4、3H5和6C2的浓度分别是1.039 mg/ mL,1.190 mg/ mL和5.688 mg/ mL。

M:蛋白质标准分子量;1:2E4腹水;2:纯化后的2E4蛋白;3:3H5腹水;4:纯化后3H5蛋白;5:5F8腹水;6:纯化后5F8蛋白;7:6C2腹水;8:纯化后6C2蛋白
M : Protein marker; 1 : 2E4 ascites; 2 : Purified 2E4 protein; 3 : 3H5 ascites; 4: Purified 3H5 protein; 5: 5F8ascites; 6: Purified 5F8 protein; 7: 6C2 ascites; 8 : Purified 6C2 protein.
图3 单克隆抗体腹水SDS-PAGE电泳分析
Fig.3 SDS-PAGE analysis of the McAbs ascites
2.5 夹心ELISA的初步建立 不同单抗与李斯特菌属不同成员培养上清的夹心ELISA反应结果表明,三株单抗6C2、3H5和2E4与单增李斯特菌LM4b反应的OD450 nm在0.2以上,而单抗株6C2与其余菌株培养上清反应的OD450 nm均在0.1以下(图4所示)。说明根据6C2单抗与李斯特菌反应的OD450 nm大小可以区分致病菌(单增李斯特菌)与非致病菌。用重组P60为标准品,倍比稀释后包被酶标板,以生物素标记的P60多抗和6C2单抗建立的夹心ELISA,测定不同浓度P60所对应的OD450 nm。结果以P60浓度为横坐标,以OD450 nm为纵坐标绘制的标准曲线(R2=0.992 2)如图5所示,基本呈一条直线。说明待检样品的OD450nm值与待测样品中P60浓度成正比,可通过建立的标准曲线对待检样品进行定量分析。
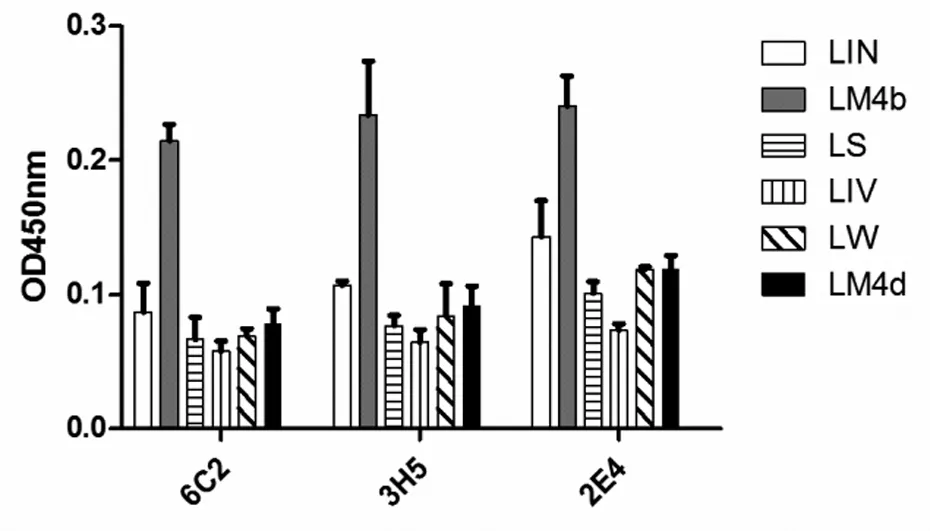
单增李斯特菌(L.monocytogenes, LM)、绵羊李斯特菌(L.ivanovii, LIV)、无害李斯特菌(L.innocua, LIN)、威氏李斯特菌(L.welshimeri, LW)、塞氏李斯特菌(L.seeligeri, LS)
图4 四株单抗与李斯特菌属不同菌株培养上清的夹心ELISA反应
Fig.4 OD value of ELISA of four McAb reacted with culture supernatant from Listeria
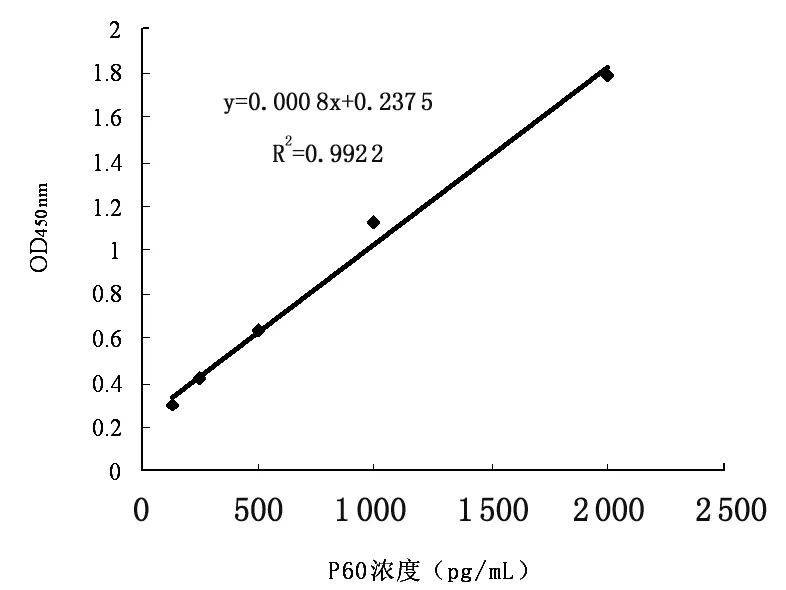
图5 不同浓度P60与夹心ELISA光密度(OD)值间的标准曲线
Fig.5 Plotting P60 standards against the corresponding of the value of OD450
3 讨 论
Boerlin[5]等学者用重组的LLO和inl A作为ELISA诊断抗原检测牛的L.monocytogenes抗体。结果敏感性特异性分别达82%和92%,说明用基因工程生产的抗原建立的ELISA方法可用于L.monocytogenes的诊断和检测。Vazquez- Boland[6]等用纯化的重组溶血素蛋白包被聚苯乙烯板,利用间接ELISA 方法,成功检测出了绵羊感染的L.monocytogenes。崔焕忠[7]等以致病性李斯特菌ActA蛋白为研究对象,原核表达了ActA 蛋白,制备了抗ActA 特异性单克隆抗体,并从中筛选2株单克隆抗体,分别用于免疫胶体金标记和胶体金试纸检测线的包被,从而研制成了检测L.monocytogenes的胶体金试纸条。秦玉敏[8]用纯化的重组LLO蛋白免疫小鼠,获得6株稳定分泌抗LLO单克隆抗体的杂交瘤细胞株,以制备的腹水单抗为诊断抗体,分别与BHI培养基和TSB-YE培养基培养的不同时段的L.monocytogenes上清发生反应,建立了检测L.monocytogenes的阻断ELISA方法。但这些方法只能用于L.monocytogenes的定性检测,而且容易出现假阳性。因为其他非致病性李斯特菌也可能呈现阳性反应。因此,进行致病性和非致病性李斯特菌的鉴别诊断或检测是非常重要的。
李斯特菌P60蛋白是由入侵相关蛋白(invasion-associated protein,iap)基因编码的分子量为60 ku的蛋白质,是细胞分裂中非常重要的具有免疫原性的胞壁质水解酶(murein hydrolase),可大量分泌于培养介质中。因此,P60是开发单增李斯特菌免疫学检测系统的理想靶标。Yu等[9]筛选了两株P60单克隆抗体p6007和p6017,分别特异性识别单增李斯特菌和李斯特菌属的P60蛋白。利用两株单抗结合P60多克隆抗体,建立了能特异性鉴别单增李斯特菌的夹心ELISA方法。与上述研究相比,本研究用重组蛋白P60抗原免疫小鼠,获得了4株稳定性较高的单克隆抗体,并从中筛选出了能特异性识别单增李斯特菌P60的单抗。制备重组P60的多克隆抗体,并将其进行生物素化处理,利用生物素(Biotin)-亲合素(Avidin)放大系统,大大提高了夹心ELISA检测的敏感性。同时,通过用重组P60蛋白作为标准品建立的标准曲线,可实现对待检样品培养物中P60蛋白的定量检测。上述研究结果将为建立基于6C2单克隆抗体的夹心ELISA方法,用于单增李斯特菌病的鉴别诊断和食品单增李斯特菌污染的定量检测奠定了基础。
[1]Dussurget O, Pizarro-cerda J, Cossart P. Molecular determinants ofListeriamonocytogenesvirulence[J]. Annu Rev Microbiol, 2004, 58(6): 587-610. DOI: 10.1146/annurev.micro.57.030502.090934
[2]Bielecki J. Emerging food pathogens and bacterial toxins[J]. Acta Microbiol Pol, 2003, 52(Suppl): 17-22.
[3]Becker B, Jorda S, Holzapf WH, et al. Rapid and specific detection ofListeriamonocytogenesin smoked salmon with BAX-PCR[J]. Food Ctrl, 2005, 16(8): 717-721.
[4]Xu DS, Shen YH, Yu MH. Development of a rapid,sensitive and specific polymerase chain reaction method for detection ofListeriamonocytogenesin foods[J]. Mod Prevent Med, 2007, 34(16): 3040-3041. (in Chinese) 徐德顺, 沈月华, 俞明华. 食品中单核细胞增生李斯特菌PCR快速检测方法[J]. 现代预防医学, 2007, 34(16): 3040-3041.
[5]Boerlin P, Boerlin PF, Jemmi T. Use of listeriolysin O and internalin A in a seroepidemiological study of Listeriosis in Swiss dairy cows[J]. J Clin Microbiol, 2003, 41(3) : 1055-1061.DOI: 10.1128/JCM.41.3.1055-1061.2003
[6]Vazquez-boland JA, Dominguez-bernal G, Gonzalez-zorn B, et al. Pathogenicity islands and virulence evolution inListeria[J]. Microbes Infect, 2001, 3: 571- 584.
[7]Cui HZ, Zhang H, Wand XL. Preparation of monoclonal antibody toListeriamonocytogenesand development of colloidal gold strip for detection of the bacterium[J]. Chin Vet Sci, 2010, 40(01): 45-50. (in Chinese) 崔焕忠, 张辉, 王兴龙. 单增李斯特菌单克隆抗体的制备及胶体金试纸的研制[J]. 中国兽医科学, 2010, 40(01): 45-50.
[8]Qin YM. Preparation of Listeriolysin O monoclonal antibodies and preliminary deteetion ofListeriamonocytogenes[D]. Harbin: Department of Preventive Veterinary Medicine, Northeast Agricultural University, 2007. (in Chinese) 秦玉敏. 李氏溶血素单克隆抗体制备及检测李氏溶血素的初步探索[D]. 哈尔滨: 东北农业大学预防兽医学系, 2007.
[9]Yu KY, Noh Y, Chung M, et al. Use of monoclonal antibodies that recognize p60 for identification ofListeriamonocytogenes[J]. Clin Diagn Lab Immunol, 2004, 11(3): 446-451.DOI: 10.1128/CDLI.11.3.446-451.2004
Luo Xue-nong, Email: luoxuenong@caas.cn
Monoclonal antibodies againstListeriamonocytogenes
YIN Yin1,2,LIU Su3,WANG Fang2,ZHU Xue-liang2,ZHOU Bang-xin2,LUO Xue-nong2
(1.TianjinCenterForAnimalDiseaseControlandPrevention,Tianjin300402,China; 2.StateKeyLaboratoryofVeterinaryEtiologicalBiology,LanzhouVeterinaryResearchInstitute,CAAS,Lanzhou730046,China; 3.LanzhouInstituteofBiologicalProducts,Lanzhou730046,China)
The aim of this study was to prepare monoclonal antibodies against P60 and develop a double-antibody sandwich enzyme-linked immunosorbent assay, which would be used in the detection ofListeriamonocytogenes. The purified recombinant protein of P60, produced by prokaryotic expression, was used to immunize the Balb/c mice. The hybridoma cell lines against P60 were obtained by fusing spleen cells from the immunized mice with mouse Sp2/0 myeloma cells. Specific McAb againstL.monocytogeneswas screened by ELISA. The isotype of the McAb was identified, and then the titers, stability and the affinity of ascites were analyzed. Sandwich ELISA was established using purified ascites and biotinylated P60 polyclonal antibody to detect the p60, which obtained from supernatant ofListeriacultures. The standard curve was established for quantitative determination using the recombinant P60 as the standard against the corresponding the value of OD450. Results showed that 6C2 McAb could be recognized specifically byL.monocytogenes, and the ELISA method based on 6C2 McAb could be used in identification and quantitative detection of samples contaminated withL.monocytogenes.
Listeriamonocytogenes; P60; monoclonal antibodies; identification; ELISA
国家“十一五”科技支撑计划项目(No.2007BAD40B01)
骆学农,Email:luoxuenong@caas.cn
1.天津市动物疫病预防控制中心,天津 300402; 2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,兰州 730046 3.兰州生物制品研究所有限责任公司, 兰州 730046
Supported by the National Science & Technology Pillar Program (No. 2007BAD40B01)
10.3969/cjz.j.issn.1002-2694.2015.06.007
R378.99
A
1002-2694(2015)06-0527-05
2014-12-16;
2015-03-30
