99Tcm(CO)3-BPHRGD的制备及其在荷M21人黑色素瘤裸鼠体内的生物分布
2015-05-04梁积新罗联哲费月英阳国桂
卿 晶,胡 骥,*,梁积新,罗联哲,费月英,阳国桂,洪 业
(1.中国原子能科学研究院 同位素研究所,北京 102413;2.原子高科股份有限公司,北京 102413)
99Tcm(CO)3-BPHRGD的制备及其在荷M21人黑色素瘤裸鼠体内的生物分布
卿 晶1,2,胡 骥1,2,*,梁积新1,罗联哲2,费月英2,阳国桂2,洪 业1,2
(1.中国原子能科学研究院 同位素研究所,北京 102413;2.原子高科股份有限公司,北京 102413)
制备了99Tcm(CO)3-BPHRGD,并进行了荷M21人黑色素瘤裸鼠体内生物学评价。在pH=7、75 ℃条件下反应30 min,99Tcm(CO)3-BPHRGD的标记率大于80%,纯化后标记物的放化纯度大于98%。体外稳定性实验结果显示,37 ℃下,标记物在生理盐水、人血清中具有很好的稳定性。荷M21人黑色素瘤裸鼠体内分布显示,注射99Tcm(CO)3-BPHRGD后0.5、1、2、4 h,标记物的瘤/血比分别为0.70±0.45、0.87±0.05、1.10±0.19、1.68±0.04。随着时间的延长,靶与非靶的放射性摄取比(T/NT)增大,表明该标记物在肿瘤细胞中的清除速度慢于其他组织。通过进一步结构修饰,改变其体内代谢途径及药代动力学性质,99Tcm(CO)3-BPHRGD非常有希望成为一种新型肿瘤显像剂。
RGD;99Tcm;黑色素瘤;生物分布
整合素(integrin) αvβ3是一类由α亚基和β亚基经非共价键连接而形成的异二聚体跨膜糖蛋白黏附分子,在新生血管内皮细胞表面及多种恶性肿瘤细胞表面有高密度表达,而成熟血管内皮细胞和绝大多数正常器官系统则无表达或表达极低[1-3],这使得整合素αvβ3成为肿瘤诊断与治疗的一个重要靶点。RGD肽是含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)序列的一类短肽,能与整合素αvβ3受体特异性结合[4],因此,放射性核素标记的含RGD肽的放射性药物备受关注,并应用于肿瘤的诊断与治疗[5-11]。
近年来,放射性核素标记的RGD多肽化合物已广泛用于肿瘤的显像和治疗研究,这些放射性核素包括18F、64Cu、125I、111In、68Ga、90Y、177Lu、99Tcm等[12-14],其中,99Tcm由于其良好的物理性质,作为诊断用核素备受人们青睐:它具有合适的半衰期(6.006 h);发射140 keV的γ射线,且具有89%的分支比;具有多种价态,标记灵活;采用99Mo/99Tcm发生器制备,生产成本低;SPECT显像成本较低,便于普及。其放射性药物在临床核医学诊断中占主导地位,其用量约占临床诊断用放射性药物的85%以上。
本文通过对目前研究较多的c(RGDyK)进行结构修饰,设计并合成6-(二(吡啶-2-甲基)氨基)己酸-RGD(BPHRGD),用[99Tcm(CO)3(H2O)3]+进行标记,得到99Tcm(CO)3-BPHRGD,并进行荷M21人黑色素瘤裸鼠体内生物学评价,探讨其进行肿瘤细胞高表达的整合素αvβ3受体显像的可行性。
1 实验材料
1.1 实验动物
荷M21人黑色素瘤雄性裸鼠,瘤块体积0.8~1 cm3,SPF级,由中国医学科学院肿瘤研究所提供。
1.2 试剂及仪器
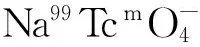
RE-52型旋转蒸发仪,上海博通公司;高纯水器,美国Millipore公司;1470自动伽马计数器,芬兰Perkin Elmer公司;C-18 Sep-Pak色谱柱,美国Waters公司;CRC-15R放射性活度计,美国Capintec公司;ProStar320 HPLC,美国Varian公司;Hypersil ODS C18色谱柱,φ4.6 mm×250 mm;GABI型高效液相色谱放射性监控仪,德国Raytest公司。
2 实验方法
2.1 质量控制方法
采用HPLC法进行质量控制。溶剂A为0.1%三氟乙酸(TFA)/H2O,溶剂B为0.1%TFA/乙腈,流速1 mL/min,紫外检测器波长220 nm。梯度洗脱程序为:0~1 min,0%溶剂B;1~15 min,0%~90%溶剂B;15~16 min,90%溶剂B;16~18 min,90%~0%溶剂B;18~20 min,0%溶剂B。
2.2 99Tcm(CO)3-BPHRGD的制备
c(RGDyK)及经结构修饰后形成的BPHRGD的化学结构示于图1,99Tcm(CO)3-BPHRGD的制备路线示于图2。
1) 6-(二(吡啶-2-甲基)氨基)己酸的合成[15]
取2.624 0 g (0.02 mol) 6-氨基己酸溶于30 mL水中,再加入6.889 7 g (0.042 mol) 2-氯甲基吡啶盐酸盐和3.200 0 g (0.08 mol) NaOH,常温搅拌1 d。反应结束后,首先在碱性条件下用20 mL氯仿萃取3次,再用1 mol/L HCl调节水层pH=3,再用20 mL氯仿萃取3次,收集酸性萃取层,旋蒸除去溶剂后,得红色的油状物,经柱色谱纯化后得黄色油状物,此即为6-(二(吡啶-2-甲基)氨基)己酸。将所得产品真空干燥。

图1 c(RGDyK)与BPHRGD的结构Fig.1 Structures of c(RGDyK) and BPHRGD
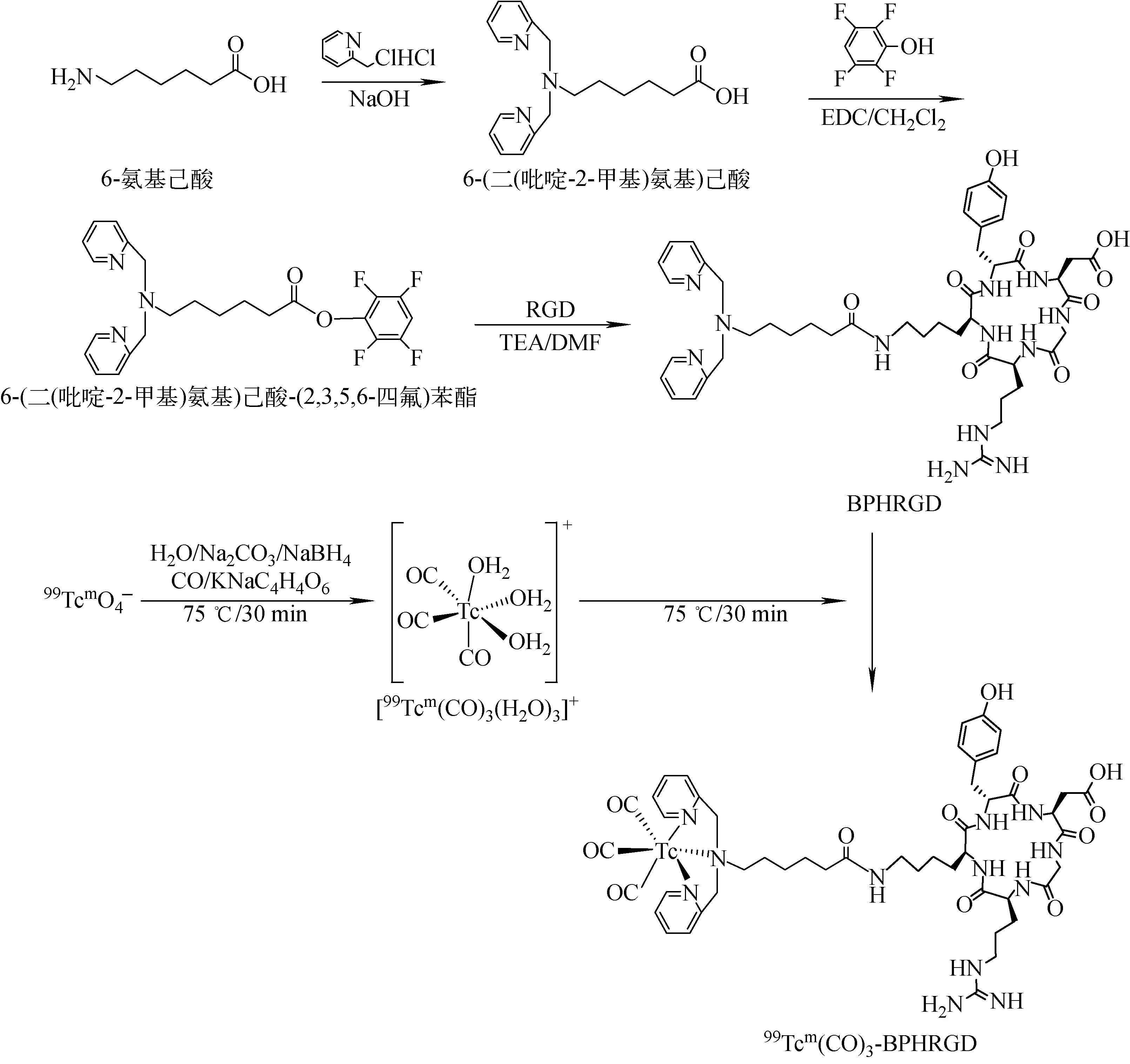
图2 99Tcm (CO)3-BPHRGD的合成路线Fig.2 Synthesis route of 99Tcm(CO)3-BPHRGD
2) 6-(二(吡啶-2-甲基)氨基)己酸-(2,3,5,6-四氟)苯酯的合成[16]
取0.130 8 g (0.417 5 mmol) 6-(二(吡啶-2-甲基)氨基)己酸溶于4 mL二氯甲烷,再加入0.160 1 g (0.835 mmol) EDC,常温下震荡30 min,加入0.104 0 g (0.626 3 mmol) 2,3,5,6-四氟苯酚,常温下震荡6 h。反应结束后,旋蒸除去溶剂后,用乙酸乙酯溶解产物,再用饱和Na2CO3洗乙酸乙酯4次,经柱色谱纯化后得黄色油状物,此即为6-(二(吡啶-2-甲基)氨基)己酸-(2,3,5,6-四氟)苯酯。将所得产品进行真空干燥。
3) BPHRGD的合成
取5 mg RGD溶于1 mL N,N-二甲基甲酰胺(DMF)和30 μL (0.24 mmol) 三乙胺中,然后加入10 mg (0.021 7 mmol) 6-(二(吡啶-2-甲基)氨基)己酸-(2,3,5,6-四氟)苯酯,室温振荡2 h,将反应液置于真空干燥器中,用油泵抽去溶剂,残留物溶于0.5 mL水中,通过HPLC分离纯化,浓缩后,冻干,冷藏待用。
4) [99Tcm(CO)3(H2O)3]+的制备
在10 mL青霉素瓶中先加入4 mg Na2CO3、5.5 mg NaBH4和15 mg 酒石酸钾钠,然后加入0.5 mL去离子水溶解,密封后通入CO气体15 min,将瓶中空气排净。然后用注射器加入1 mL Na99TcmO4洗脱液(1.85×108~1.85×109Bq),在75 ℃条件下加热反应30 min(图2),冷却至室温后,用1 mol/L HCl调pH值为7,用HPLC法分析其放化纯度。
5)99Tcm(CO)3-BPHRGD的制备
取3 mL青霉素真空瓶,加入30 μL BPHRGD的溶液(1 mg/mL、pH=7)和0.1 mL新鲜制备的[99Tcm(CO)3(H2O)3]+溶液,75 ℃下反应30 min(图2),待反应溶液冷却到室温后,用C18 Sep-Pak反向萃取柱进行纯化,用HPLC法分析标记物的标记率和放化纯度。
2.3 99Tcm(CO)3-BPHRGD的脂水分配系数测定
取20 μL纯化后的99Tcm(CO)3-BPHRGD,加入到含500 μL正辛醇和480 μL磷酸盐缓冲溶液(PBS,pH=7.4,0.05 mol/L)的EP管中,涡旋混匀30 min后在2 000 r/min条件下离心15 min,分别取100 μL有机相和水相测量放射性计数,计算标记物的脂水分配系数P(有机相计数/水相计数)及lgP。
2.4 99Tcm(CO)3-BPHRGD的体外稳定性
将标记物分别稀释于生理盐水、10%胎牛血清、0.01 mol/L半胱氨酸溶液中,37 ℃下放置24 h,分别于1、2、4、6、24 h取样,用HPLC法检测标记物的放化纯度。
2.5 99Tcm(CO)3-BPHRGD在荷M21人黑色素瘤裸鼠体内的生物分布
取12只荷M21人黑色素瘤裸鼠,随机分成4组,每组3只。经尾静脉注射0.1 mL标记物 (约0.74 MBq,BPHRGD肽含量<1 μg),于注射后0.5、1、2、4 h时断颈处死,取血、心、肝、脾、肺、肾、胃、肠、肌肉、肾上腺、肿瘤等主要脏器,称重并测量其放射性计数,经衰变校正后,计算每克组织百分注射剂量率(ID%·g-1),获得标记物在荷瘤裸鼠体内的生物分布。
3 结果与讨论
3.1 6-(二(吡啶-2-甲基)氨基)己酸的表征
随着反应的进行,反应液由无色变为红褐色。TLC展开剂为氯仿/甲醇(体积比=9∶1),Rf=0.3。此反应的副产物较多,纯化困难,经柱色谱纯化后得黄色油状物1.13 g,产率为18%。1H-NMR(400 MHz,CDCl3,δ):8.55~8.53(d,2H,HPy-6,J=4.9 Hz)、7.68~7.64(t,2H,HPy-4,J=7.6 Hz)、7.56~7.54(d,2H,HPy-3,J=7.8 Hz)、7.19~7.15(t,2H,HPy-5,J=6.1 Hz)、3.88(s,4H,HPy-α)、2.62~2.58(t,2H,1-CH2,J=7.3 Hz)、2.33~2.28(t,2H,5-CH2,J=7.4 Hz)、1.64~1.56(m,4H,2-CH2+ 4-CH2)、1.35~1.29(m,2H,3-CH2)。MS (ESI):m/z[C18H24N3O2]+(M+H)+:314.2。
3.2 6-(二(吡啶-2-甲基)氨基)己酸-(2,3,5,6 -四氟)苯酯的表征
通过紫外显色监测反应进程,TLC展开剂为氯仿/甲醇(体积比为9∶1),Rf=0.5。经柱色谱纯化后得黄色油状物,干燥称重得0.077 g,产率为40%。1H-NMR(400 MHz,CDCl3,δ):8.52~8.80(d,2H,HPy-6,J=4.9 Hz)、7.67~7.62(t,2H,HPy-4,J=7.6 Hz)、7.55~7.53(d,2H,HPy-3,J=7.7 Hz)、7.16~7.12(t,2H,HPy-5,J=6.1 Hz)、7.02~6.93(m,1H,ArF4H)、3.84(s,4H,HPy-α)、2.62~2.58(t,2H,1-CH2,J=7.3 Hz)、2.61~2.56(t,2H,5-CH2,J=7.5 Hz)、1.73~1.65(m,2H,4-CH2)、1.64~1.56(m,2H,2-CH2)、1.43~1.35(m,2H,3-CH2)。MS(FAB):m/z[C24H24F4N3O2]+(M+H)+:462.1。
3.3 BPHRGD的表征
为使RGD反应完全,6-(二(吡啶-2-甲基)氨基)己酸-(2,3,5,6-四氟)苯酯应适当过量。此偶联反应迅速,在室温下振荡1.5 h即可反应完全。由于DMF在HPLC中有较强的吸收峰,在用HPLC纯化产物时有很大的干扰,因此应先除去DMF溶剂后再进行纯化。纯化后的BPHRGD的HPLC谱示于图3。经冻干得纯度大于99%的白色粉末3.77 mg,产率约为51%。MS(ESI):m/z[C45H63N12O9]+(M+H)+:915.1。

图3 纯化后的BPHRGD的HPLC谱Fig.3 HPLC spectrum of BPHRGD after purification
3.4 99Tcm(CO)3-BPHRGD制备的影响因素
[99Tcm(CO)3(H2O)3]+制备方法已很成熟,在通入足量CO和保证NaBH4不发生潮解的情况下可高产率地制得。[99Tcm(CO)3(H2O)3]+及99Tcm(CO)3-BPHRGD的Radio-HPLC谱示于图4。由图4a可计算得,[99Tcm(CO)3(H2O)3]+的放化纯度达99%。制备完成后将pH值调为中性,常温下,[99Tcm(CO)3(H2O)3]+可稳定放置24 h以上。优化标记条件后,99Tcm(CO)3-BPHRGD的标记率可稳定在80%以上(图4b),经C18 Sep-Pak柱纯化后,标记物放化纯度大于98%(图4c)。纯化后,99Tcm(CO)3-BPHRGD的比活度为3.29×1015Bq/kg(假设99Tcm(CO)3-BPHRGD和BPHRGD在纯化过程中损失比例相同,比活度=AY/W,其中A为[99Tcm(CO)3(H2O)3]+的总活度,Y为标记率,W为BPHRGD的投料质量)。
1) 反应时间对标记率的影响
反应时间对[99Tcm(CO)3(H2O)3]+标记BPHRGD的影响示于图5。由图5可看出,反应时间在30 min内,标记率随反应时间的增加而增大,30 min后,标记率基本不再变化,因此将标记反应时间定为30 min。
2) pH值对标记率的影响
反应介质的pH值对[99Tcm(CO)3(H2O)3]+标记BPHRGD的影响示于图6。由图6可看出,pH值为7.0时,标记率达到最高。在酸性条件下,H+可与吡啶环上的N和叔N原子结合,从而影响标记物的配位,导致标记率降低;在碱性条件下,BPHRGD可能发生了水解,因此标记率下降趋势显著。因此标记时,将反应溶液的pH值定为7.0。
3) BPHRGD用量对标记率的影响
BPHRGD用量对标记率的影响示于图7。
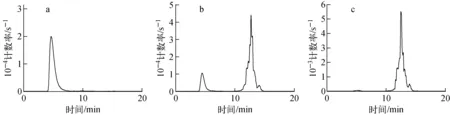
a——[99Tcm (CO)3(H2O)3]+;b——未纯化99Tcm (CO)3-BPHRGD;c——纯化后的99Tcm (CO)3-BPHRGD
由图7可看出,随着BPHRGD用量的增加,99Tcm(CO)3-BPHRGD的标记率也随之增大,但BPHRGD用量过高会降低标记物的比活度,因此不能仅通过增加BPHRGD用量的方式来提高标记率。在BPHRGD用量为30 μg时,标记率已达到80%,且当用量小于30 μg时,标记率随用量的增加而急剧增大;当BPHRGD用量大于30 μg时,标记率的增大并不显著。综合考虑标记率及比活度的影响因素后,将BPHRGD的用量定为30 μg。
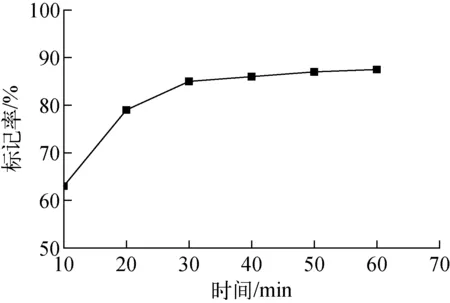
图5 反应时间对标记率的影响Fig.5 Effect of reaction time on labeling yield

图6 pH值对标记率的影响Fig.6 Effect of pH on labeling yield
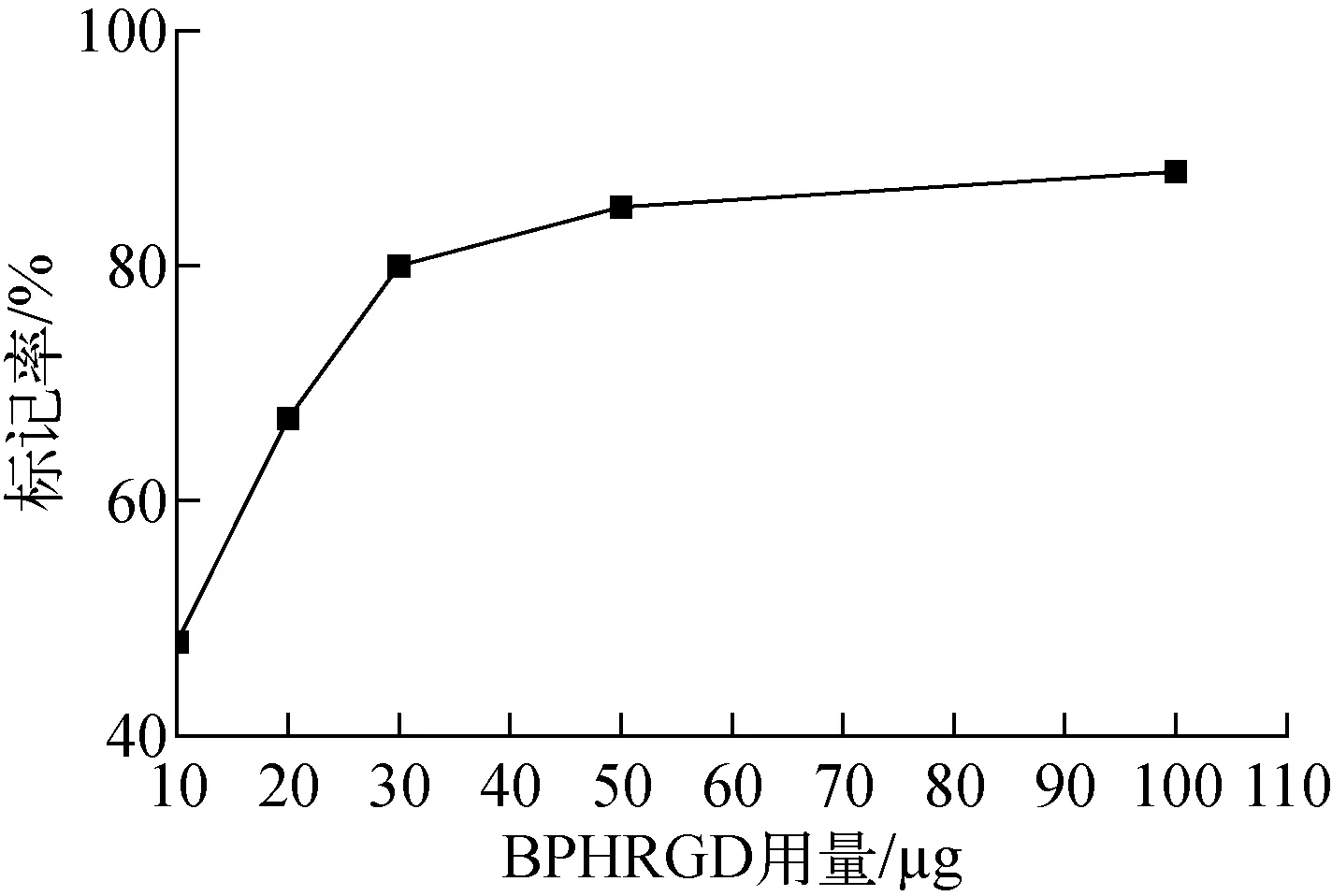
图7 BPHRGD用量对标记率的影响Fig.7 Effect of BPHRGD on labeling yield
3.5 99Tcm(CO)3-BPHRGD的脂水分配系数
99Tcm(CO)3-BPHRGD的脂水分配系数P=0.227,lgP=-0.644,说明标记物的脂溶性较好,这可能是由于BPHRGD增长了RGD碳链的缘故。
3.6 99Tcm(CO)3-BPHRGD的体外稳定性
37 ℃下,99Tcm(CO)3-BPHRGD的体外稳定性示于图8。由图8可见,标记物在生理盐水和胎牛血清中具有较高的体外稳定性,放置24 h内,其放化纯度始终高于95%。其在半胱氨酸溶液中的放化纯度略有下降,但始终高于90%,表明99Tcm(CO)3-BPHRGD基本不与巯基发生配体交换反应。由于生物体内含有一些游离的巯基化合物,与99Tcm标记物在体内竞争络合,体外竞争稳定性实验结果可间接反映99Tcm标记物在生物体内的稳定性,由此可推断99Tcm(CO)3-BPHRGD具有较好的体内稳定性。
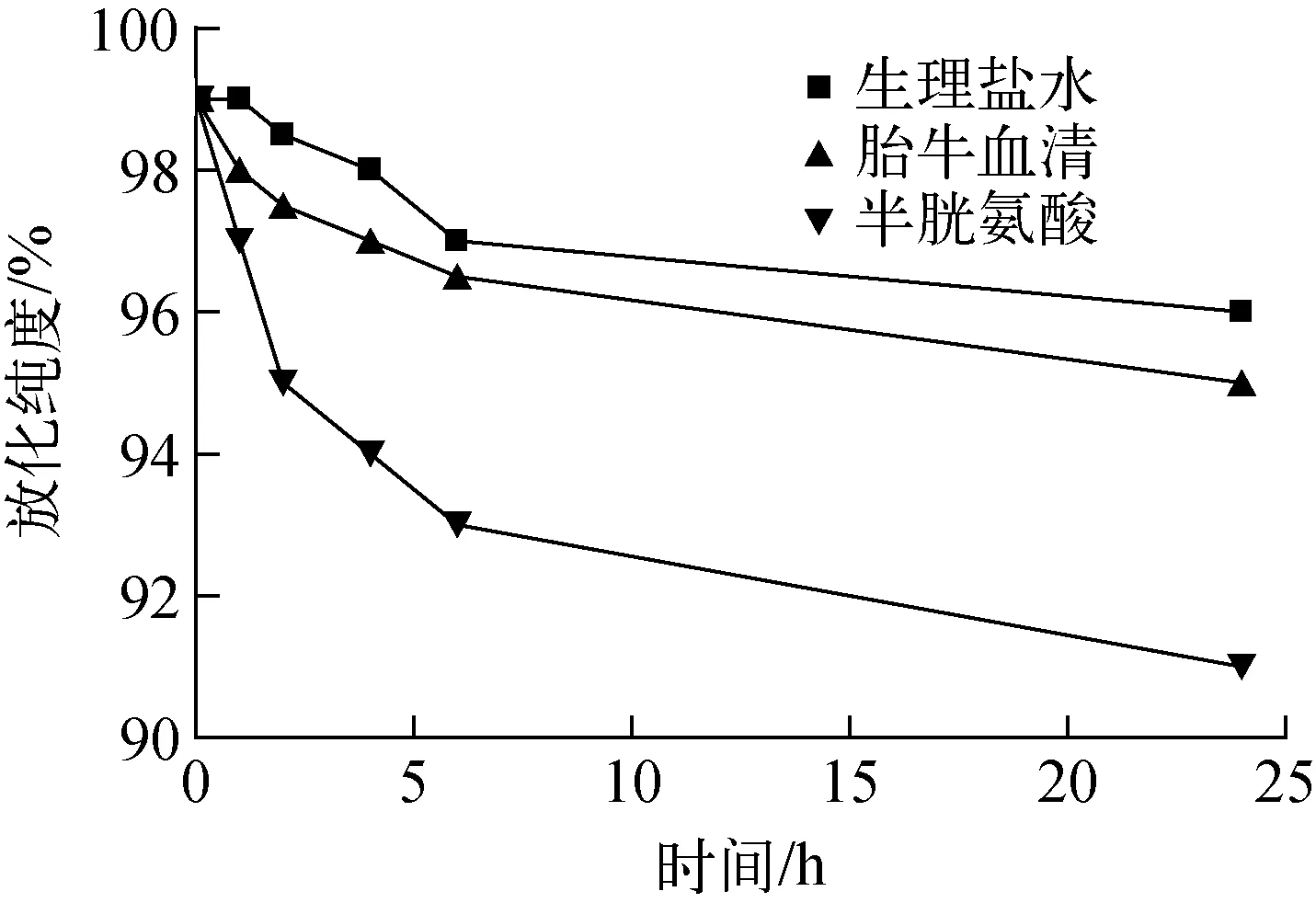
图8 99Tcm(CO)3-BPHRGD的体外稳定性Fig.8 In-vitro stability of 99Tcm(CO)3-BPHRGD
3.7 99Tcm(CO)3-BPHRGD在荷M21人黑色素瘤裸鼠体内的生物分布
99Tcm(CO)3-BPHRGD在荷M21人黑色素瘤裸鼠体内的生物分布列于表1,瘤与血及瘤与肌肉的靶与非靶放射性摄取比(T/NT)列于表2。
由表1可见,99Tcm(CO)3-BPHRGD在血液中的清除较快,主要通过肝脏代谢、肾脏排泄。腹部放射性摄取偏高,在肝肾中有较长的滞留时间,与文献[17]结果基本一致。
由表2可见,随着时间的延长,瘤与血的T/NT及瘤与肌肉的T/NT均呈增大的趋势,0.5 h时,瘤与肌肉的T/NT略高于1 h时的,可能是由于测量误差造成的。由瘤与血的T/NT变化规律可判断,该标记物在肿瘤细胞中有较高的摄取和较长的滞留时间。与文献[17-18]相比,T/NT偏低,这是由于文献中RGD为二聚体,二聚体RGD对整合素αvβ3受体具有更高的亲和性。此外,不同肿瘤细胞系表达的αvβ3受体数量不同,对RGD的亲和力也不同,由于所选肿瘤细胞系的不同,导致T/NT存在一定差异。在进一步的研究中,可在其结构中引入亲水性基团或制备RGD的多聚体等,从而改善药物在体内的代谢途径,并增强药物的靶向性,以期研制出适于肿瘤显像诊断的RGD多肽放射性药物。
表1 99Tcm(CO)3-BPHRGD在荷M21人黑色素瘤裸鼠体内的生物分布Table 1 Biodistribution of 99Tcm(CO)3-BPHRGD in nude mice bearing M21 human melanoma tumor ±s,n=3)

表2 99Tcm(CO)3-BPHRGD在荷M21人黑色素瘤裸鼠体内的T/NTTable 2 T/NT of 99Tcm(CO)3-BPHRGD in nude mice bearing M21 human melanoma tumor
4 结论
本文合成的BPHRGD能很好地进行[99Tcm(CO)3(H2O)3]+标记,标记物99Tcm(CO)3-BPHRGD体外稳定性较好,血液清除较快,在肿瘤中有较长的滞留时间。本实验为研究[99Tcm(CO)3(H2O)3]+标记RGD显像药物提供了新的思路。
[1] BROOKS P C, CLARK R A, CHERESH D A. Requirement of vascular integrin alpha v beta 3 for angiogenesis[J]. Science, 1994, 264: 569-571.
[2] RUOSLAHTI E. Specialization of tumour vasculature[J]. Nat Rev Cancer, 2002, 2(2): 83-90.
[3] ZITZMANN S, EHEMANN V, SCHWAB M. Arginine-glycine-aspartic acid (RGD)-peptide binds to both tumor and tumor-endothelial cells in vivo[J]. Cancer Res, 2002, 62(18): 5 139-5 143.
[4] PASQUALINI R, KOIVUNEN E, RUOSLAHTI E. Alpha v integrins as receptors for tumor targeting by circulating ligands[J]. Nat Biotechnol, 1997, 15(6): 542-546.
[5] BIANCHINI F, CINI N, TRABOCCHI A, et al.125I-radiolabeled morpholine-containing arginine-glycine-aspartate (RGD) ligand of alpha(v)beta(3) integrin as a molecular imaging probe for angiogenesis[J]. J Med Chem, 2012, 55(11): 5 024-5 033.
[6] 张春丽,王荣福,张丽,等. 靶向整合素αvβ3受体的新型RGD肽二聚体的131I标记与生物活性的初步评价[J]. 北京大学学报:医学版,2011,43(2):295-300.
ZHANG Chunli, WANG Rongfu, ZHANG Li, et al.131I labeling and bioactivity evaluation of a novel RGD dimer targeted to integrin αvβ3receptor[J]. Journal of Peking University: Health Sciences, 2011, 43(2): 295-300.
[7] LIU Z, HUANG J, DONG C, et al.99mTc-labeled RGD-BBN peptide for small-animal SPECT/CT of lung carcinoma[J]. Mol Pharm, 2012, 9(5): 1 409-1 417.
[8] LIU Z, SHI J, JIA B, et al. Two90Y-labeled multimeric RGD peptides RGD4 and 3PRGD2 for integrin targeted radionuclide therapy[J]. Mol Pharm, 2011, 8(2): 591-599.
[9] LIU Z, NIU G, WANG F, et al.68Ga-labeled NOTA-RGD-BBN peptide for dual integrin and GRPR-targeted tumor imaging[J]. Eur J Nucl Med Mol Imaging, 2009, 36(9): 1 483-1 494.
[10]BRIAT A, WENK C H, AHMADI M, et al. Reduction of renal uptake of111In-DOTA-labeled and A700-labeled RAFT-RGD during integrin alpha v beta 3 targeting using single photon emission computed tomography and optical imaging[J]. Cancer Sci, 2012, 103(6): 1 105-1 110.
[11]HAUBNER R, BRUCHERTSEIFER F, BOCK M, et al. Synthesis and biological evaluation of a99mTc-labelled cyclic RGD peptide for imaging the alpha v beta 3 expression[J]. Nuklearmedizin, 2004, 43(1): 26-32.
[12]LIU Z, LI Y, LOZADA J, et al. Stoichiometric leverage: Rapid18F-aryltrifluoroborate radiosynthesis at high specific activity for click conjugation[J]. Angew Chem Int Ed Engl, 2013, 52(8): 2 303-2 307.
[13]WU Z, LI Z B, CAI W, et al.18F-labeled mini-PEG spacered RGD dimer (18F-FPRGD2): Synthesis and micro PET imaging of alpha v beta 3 integrin expression[J]. Eur J Nucl Med Mol Imaging, 2007, 34(11): 1 823-1 831.
[14]DECRISTOFORO C, HERNANDEZ G I, CARLSEN J, et al.68Ga- and111In-labelled DOTA-RGD peptides for imaging of alpha v beta 3 integrin expression[J]. Eur J Nucl Med Mol Imaging, 2008, 35(8): 1 507-1 515.
[15]KIRIN S I, DUBON P, WEYHERMULLER T, et al. Amino acid and peptide bioconjugates of copper(Ⅱ) and zinc(Ⅱ) complexes with a modified N, N-bis(2-picolyl)amine ligand[J]. Inorg Chem, 2005, 44(15): 5 405-5 415.
[16]KIM I S, YOO T M, KOBAYASHI H, et al. Chemical modification to reduce renal uptake of disulfide-bonded variable region fragment of anti-Tac monoclonal antibody labeled with99mTc[J]. Bioconjug Chem, 1999, 10(3): 447-453.
[17]SHI J, WANG L, KIM Y S, et al. Improving tumor uptake and excretion kinetics of99mTc-labeled cyclic arginine-glycine-aspartic (RGD) dimers with triglycine linkers[J]. J Med Chem, 2008, 51(24): 7 980-7 990.
[18]WANG L, SHI J, KIM Y S, et al. Improving tumor-targeting capability and pharmacokinetics of99mTc-labeled cyclic RGD dimers with PEG(4) linkers[J]. Mol Pharm, 2009, 6(1): 231-245.
Preparation of99Tcm(CO)3-BPHRGD and Its Biodistribution in Nude Mice Bearing M21 Human Melanoma Tumor
QING Jing1,2, HU Ji1,2, *, LIANG Ji-xin1, LUO Lian-zhe2, FEI Yue-ying2,YANG Guo-gui2, HONG Ye1,2
(1.DepartmentofIsotope,ChinaInstituteofAtomicEnergy,Beijing102413,China;2.AtomHi-TechCo.,Ltd.,Beijing102413,China)
The99Tcm(CO)3-BPHRGD was prepared, and in-vivo biological evaluations in nude mice bearing M21 human melanoma tumor were completed. The labeling yield of99Tcm(CO)3-BPHRGD is more than 80% under optimal conditions (pH=7, reacting at 75 ℃ for 30 min), and the radiochemical purity is more than 98% after purification. The in-vitro stability experiments show that the radiolabeled compound has good stability in normal saline and human serum under 37 ℃. The biodistribution of99Tcm(CO)3-BPHRGD in nude mice bearing M21 human melanoma tumor shows that the ratio of tumor/blood is 0.70±0.45, 0.87±0.05, 1.10±0.19 and 1.68±0.04 at 0.5, 1, 2 and 4 h respectively. The ratio of T/NT increases with time. This indicates that the clearance rate of this radiolebeled compound in tumor is slower than in other tissues. Through the further structural modification to change metabolic pathways and pharmacokinetic properties, it is very promising as a new tumor imaging agent.
RGD;99Tcm; melanoma tumor; biodistribution
2014-03-04;
2014-06-25
卿 晶(1985—),男,四川内江人,博士研究生,放射性同位素技术专业
*通信作者:胡 骥,E-mail: ji_hu@ciae.ac.cn
TL817.2
A
1000-6931(2015)07-1170-08
10.7538/yzk.2015.49.07.1170
