生脉注射液质量分析与热原控制探讨
2015-05-04唐健新
唐健新
广州医科大学附属第五医院,广东 广州 510180
生脉注射液质量分析与热原控制探讨
唐健新
广州医科大学附属第五医院,广东 广州 510180
目的:对国家食品药品监督管理局公告的苏中药业的生脉注射液(批号:14081413)进行全面检测,探索引起不良反应的原因。方法:按照生脉注射液质量标准进行全面检测。结果:热原存在批内差异,不符合标准规定要求。结论:建议企业扩大批内批间检查批次,确保临床用药安全。
生脉注射液;热原;质量分析
生脉注射液是根据中医经典古方“生脉散”研制而成的中药注射液,由红参、麦冬、五味子组成,收载于2009 年版国家基本药物目录。具有理气开窍、益气强心、生津复脉、回阳救逆、扶正祛邪、活血化瘀、抗凝等功效[1],临床用于治疗冠心病,心肌梗死,心功能衰竭,各种休克及肿瘤患者化疗的辅助治疗。现行生脉注射液质量标准收载于《国家食品药品监督管理局国家药品标准》( WS3-B-2865-98-2011)。该药于1983年由华西药业首家上市,1995年经国家中医药管理局批准为“必备急救中药”,目前全国共有8家企业生产[2-4]。但生脉注射液在2007年即列为国家食药监“中药注射剂高风险品种名单”,2012年国家食药监发布过《药品不良反应信息通报》提示生脉注射液存在严重过敏反应现象。2004~2011年间国家药品不良反应监测中心共收到生脉注射液严重不良反应/事件病例报告508例[5-7]。
生脉注射液在临床上会产生“过敏样反应”,严重者可导致其体克甚至死亡。国家食品药品监督管理局于2015年4月24日公告苏中药业的生脉注射液(批号:14081413)个别患者用药后出现寒战、发热症状的质量问题[8]。实验根据《国家食品药品监督管理局国家药品标准》( WS3-B-2865-98-2011)对生脉注射液(批号:14081413)进行全面分析,探讨生脉注射液热源不合格的判断依据及引起不良反应的原因,为临床用药提供实验依据。
1 仪器与材料
1.1 仪器 岛津LC2010-A系列高效液相色谱仪。
1.2 材料 人参皂苷Rb1对照品、Re对照品、Rgl对照品、麦冬对照药材;五味子对照药材;五味子醇甲对照品(以上材料均由中国药品生物制品检定所提供);生脉注射液(批号:14081413,江苏苏中药业)样品抽自普宁市里湖镇中心卫生院。标准缓冲液(默克公司)试剂。
2 方法与结果
2.1 性状 标准规定应本品为淡黄色或淡黄棕色的澄明液体,对该批样品进行观察发现该批样品为淡黄色的澄明液体,符合标准规定要求。
2.2 薄层鉴别2.2.1 人参皂苷Rb1、Re、Rgl的薄层鉴别 取生脉注射液约10ml,置水浴上蒸干,残渣加2ml乙醇使溶解,作为供试品溶液。另分别取人参皂苷Rb1、Re、Rgl对照品适量,加乙醇制成2mg/ml的混合溶液,作为对照品溶液。按照2010年版《中国药典》薄层色谱法试验,吸取上述两种溶液各2μl,分别点于同一硅胶G薄层板上,在温度为20℃,湿度为65%的条件下,以三氯甲烷-甲醇-水(75∶20∶2)为展开剂展开,取出,晾干;喷10%硫酸乙醇溶液,在105℃加热至斑点显色淸晰,置紫外光灯(365nm)下检视,结果见图1。
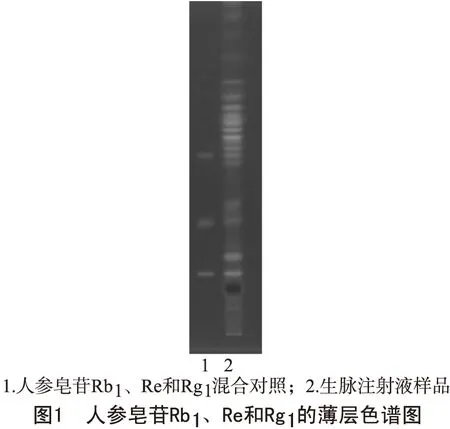
由图1可知,人参皂苷Rb1、Re和Rgl混合对照的分离度良好,斑点清晰,并与生脉注射液样品在相同位置上显示相同颜色的斑点。符合《中国药典》规定的要求。
2.2.2 麦冬薄层鉴别 取本品40ml,加盐酸3ml,置水浴中加热1小时,放冷,加乙醚30ml振摇提取,分取乙醚液,蒸干,残渣加三氯甲烷l ml使溶解,作为供试品溶液。另取麦冬对照药材2g,加水煎煮30分钟,滤过,滤液浓缩至约40ml,同法制成对照药材溶液。按照2010年版《中国药典》薄层色谱法试验,分别吸取上述溶液各5μ1,分别点于同一硅胶G薄层板上,在温度为20℃,湿度为65%的条件下,以三氯甲烷-丙酮(4∶1)为展开剂展开,取出,晾干;喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,结果见图2。
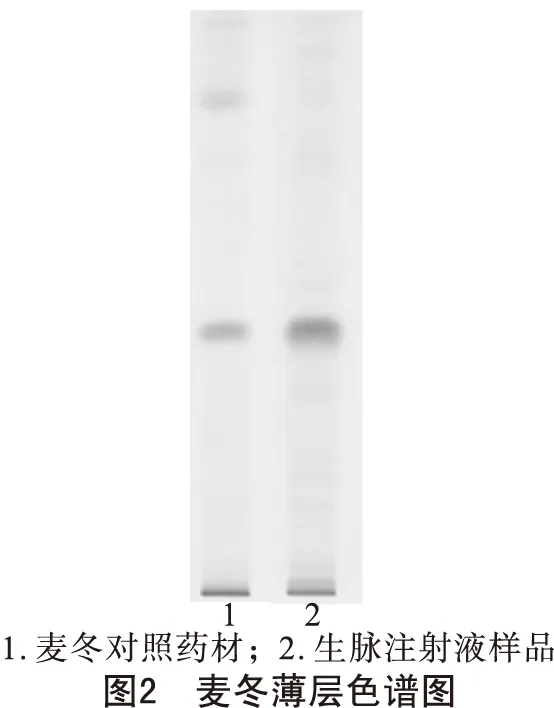
由图2可知,麦冬对照药材的斑点清晰,与生脉注射液样品在相同位置上显示相同颜色的斑点。符合《中国药典》规定的要求。
2.2.3 五味子薄层鉴别 取本品50ml,水浴上浓缩至约25ml,移至分液漏斗中,加正己烷振摇提取3次,每次10ml滤过,合并滤液,蒸干,残渣加三氯甲烷l ml使溶解,作为供试品溶液。另取五味子对照药材2g,加水煎煮30min,滤过,滤液浓缩至约40ml,同法制成对照药材溶液。再取五味子醇甲对照品,加三氯甲烷制成每1ml含0.5mg的溶液,作为对照品溶液。按照2010年版《中国药典》薄层色谱法试验,分别吸取供试品溶液10μl、对照约材溶液和对照品溶液各1μl,分别点于同一硅胶板上,在温度为20℃,湿度为65%的条件下,以石油醚(30~60℃)-乙酸乙酯-甲酸(14∶5∶1)为展开剂展开,取出,晾干,置紫外光灯(254nm)下检视,结果见图3。
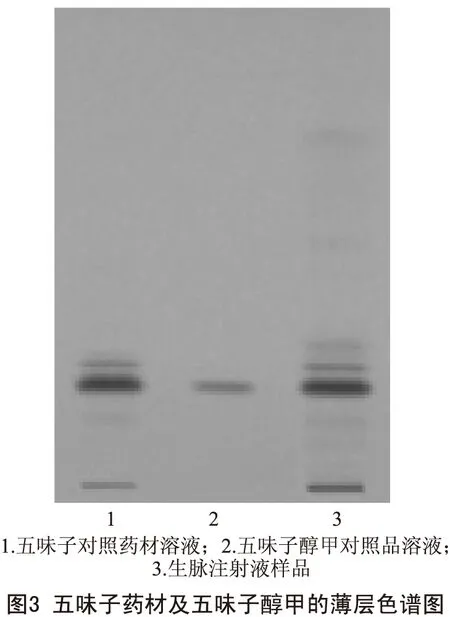
由图3可知,五味子对照药材、五味子醇甲与生脉注射液样品在相同位置上显示相同颜色的斑点,Rf值适中,分离度良好。符合《中国药典》规定的要求。
2.2.4 液相色谱鉴别 制备供试品溶液和对照提取物溶液(见含量测定项)。按照2010年版《中国药典》高效液相色谱法试验,色谱柱为Alltech Prevail Carbohydrate ES,乙腈-水(80∶20)为流动相,用蒸发光散射检测器检测。结果供试品色谱中检出与对照品(药材)保留时间相同的四个主要色谱峰。
2.3 检查项
2.3.1 pH值 参照2010年版《中国药典》一部附录VⅡ G进行pH值检测,在温度为20℃,湿度为65%的条件下,采用默克公司生产的标准缓冲液为校准试液,对该批样品进行检测,结果样品的pH值为5.7,符合标准规定要求。
2.3.2 溶液的颜色 参照2010年版《中国药典》二部附录XI A笫一法进行溶液颜色检测,结果表明,样品溶液浅于黄色9号标准比色液,符合标准规定要求。
2.3.3 炽灼残渣 根据标准,参照2010年版《中国药典》一部附录IX J对样品炽灼残渣进行检查,结果炽灼残渣为0.5% (g/ml),符合标准规定要求。
2.3.4 总固体 精密量取本品10ml置已恒重的蒸发皿中,于水浴上蒸干后,在105℃干燥3 小时,移置干燥器中冷却30min,精密称定重量,测得样品总固体为5.0% (g/ml),符合标准规定要求。
2.3.5 有关物质 依据2010年版《中国药典》一部附录IX S的要求,分别对蛋白质、树脂、草酸盐和钾离子进行测定,结果均符合药典规定要求。
2.3.6 热原 依据2010年版《中国药典》一部附录XIII A,依法检查,发现家兔升温明显。在排除外源性污染的可能性后再次重复热原检查,每次均取两支样品混匀作为供试液,结果两次结果符合规定,一次结果边缘,其原因可能是样品之间的质量不均一引起。按照2010年版《中国药典》一部附录“热原检查法”规定,热原检查无须复试即可直接判定为不合格。同时,中药注射液属于相对高危的注射剂,且该批样品在临床上已经出现“发热”情况,该品种也曾出现“发热”等有关报道。因此认为该批产品不符合标准规定要求。
2.3.7 其他检查 对该批样品的异常毒性、过敏反应、溶血与凝聚、无菌以及其他项(装量、可见异物)按照2010年版《中国药典》一部附录进行检查,均符合药典规定要求。品的渗透压摩尔浓度为288 mos mol/kg,不溶性微粒中10μm和25μm分别为298粒和7粒,均符合标准规定。
2.4 色谱对比及含量测定
2.4.1 色谱条件 照高效液相色谱法(中国药典2010年版一部附录VI D)试验,以Alltech PrevailTM Carbohydrate ES色谱柱为固定相,以乙腈-水为流动相,按表1进行梯度洗脱;检测波长为203nm。

表1 梯度洗脱表
2.4.2 供试品溶液的配置 取本品l ml,加50%乙腈稀释至约10ml,混匀,作为供试品溶液。
2.4.3 对照品溶液的配置 取人参皂苷Rgl对照品、人参皂苷Re对照品和人参皂苷Rb1对照品及五味子醇甲对照品适量,精密称定,加甲醇制成毎1ml分别含0.10mg、0.08mg、0.20mg 和0.02mg的混合溶液,摇匀即得。
2.4.4 典型指纹图谱 分别精密量取10 μl供试品溶液和对照品溶液,注入高效液相色谱仪,记录色谱图,测定。经过比较所测定和纪录的色谱图,生成标准指纹图谱。见图4。
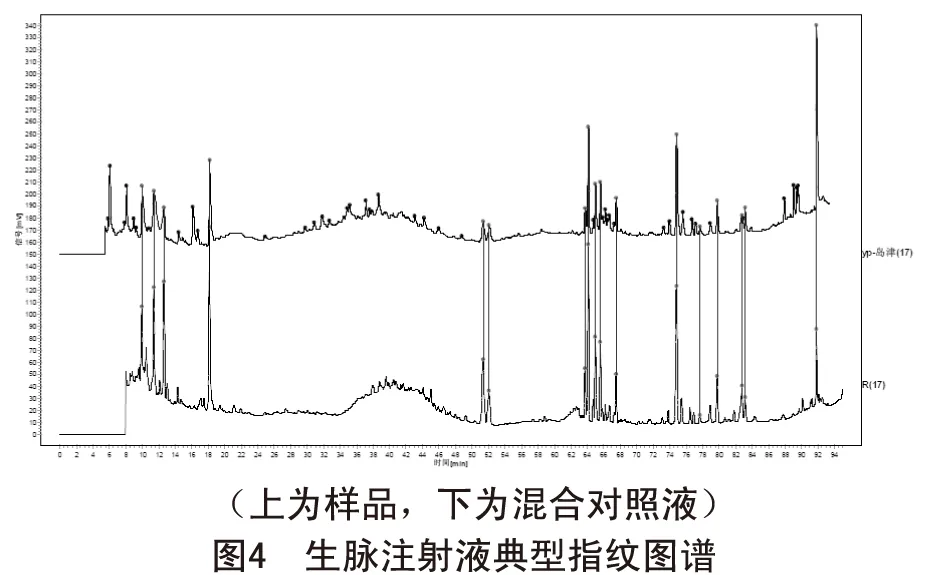
由图4可知,供试品指纹图谱在8~95min范围内,共有17个特征色谱峰,且特征色谱峰基本能达到基线分离。按《中药色谱指纹图谱相似度评价系统A版》以特征峰计算,供试品指纹图谱与对照指纹图谱的相似度为0.86。另外,对供试品色谱中峰面积高于Rb1峰面积5%的色谱峰进行积分,发现非特征峰面积之和为43%,符合标准规定低于50%的要求。
2.4.5含量测定 采用外标单点校正法测定该批样品中人参皂苷Rg1、Re和Rb1以及五味子醇甲的含量,平行测定三份,取平均值。该样品中每1ml含红参以人参皂苷Rg1、Re的总量计为0.20mg,符合标准规定不少于0.1mg的要求;以人参皂苷Rb1计为0.23mg,符合标准规定不少于0.1mg的要求;以人参皂苷Rg1、Re和Rb1的总量计为0.43mg,符合标准规定(0.2~0.7mg)的要求。五味子以五味子醇甲计,该批样品中每1ml含五味子为22.3μg,符合标准规定不低于3.0μg的要求。
3 讨论
3.1 整体质量评 药品的质量稳定、均一是保证有效性和安全性的前提。中药注射剂,尤其是复方中药注射剂与口服制剂相比,更应开展严格的品质评价研究,确保质量稳定,避免治疗中因质量不达标而影响药效或产生不良反应。研究依据2010版《中国药典》一部的要求,采用兔法对江苏苏中药业所生产的生脉注射液进行检测,在平行实验中,一次兔子体温明显升高,其他三次体温无明显变化,与国家食品药品监督管理局公布的结果一致。初步认为“发热”是由该批样品不均匀所致。此外,该批产品除热原不合格外,其他均符合标准规定要求。
3.2 热原不合格的原因分析 中药注射液的“热原”主要产于革兰氏阴性细菌的细胞壁,由脂多糖、磷脂、蛋白质等组成的复合物。而脂多糖是一种微生物代谢产物,是内毒素的主要成分,具有较强的热原活性。热原可以通过原料、溶剂、容器具带入,制备过程中污染,灭菌不彻底或包装不严也可产生热原[9]。原料带入的主要原因为原料质量不佳,存放不当,包装不好,贮存时间太长,受污染等。另外,注射用水等溶剂制备不严格、蒸馏水器结构不合理或注射用水贮存时间过长等,也有可能引入热原[10]。
由于原料等不可避免的给中药注射剂带来热原,随之也开发了诸多控制热源的技术[10],如超滤膜分离法[11]、活性炭吸附法[12]、蒸馏法、离子交换法、酸碱处理法、高温法以及反渗透等方法[13-14]除热原的方法。中药注射剂含有热原量稍高就可引起严重不良反应,甚至危害生命,因此企业应该越来越重视注射液中热原的控制。
3.3 教训与建议
3.3.1 品质评价 仅凭合格与不合格不能达到控制生脉注射剂安全,对于高危品种,特别是中药注射剂的品质评价应包含批内产品的均一性、同一厂家不同批次之间的均一性,这就对厂家提出了更高的生产要求。
3.3.2 对质量标准和抽样建议 通过对生脉注射液的全面分析,生脉注射液现行标准是可行的,对产品质量能起到一定的控制作用。但还应该完善和提高现行标准,对高危中药注射剂品种可以适当增加检查批次,减少或杜绝因批内和批间差异引起的质量问题。
3.3.3 加强监管 要求企业完全要按GMP相关要求进行生产检验,强化生产企业的技术能力,通过行政监管来促进生产企业检验技术的提高。
生脉注射液由红参、麦冬、五味子组成,其功效由药物相互作用、相互协调而共同体现 ,而不良反应的产生也是多方面因素的综合表现。因生脉注射液由多种中药成分组成,存在中药类注射液常见的缺点,而临床应用广泛且用量较大,如何在临床安全应用需要进行更深入的研究。
[1] 易艳,李春英,唐仁茂,等. 生脉注射液工艺改进前后类过敏反应比较[J]. 中国中药杂志,2012,37(13):1875-1879.
[2] 李廷谦,刘雪梅,冯敏,等. 生脉注射液临床应用及不良反应的系统评价 [J] . 中国中西医结合杂志,2009,29(11):965-969.
[3] 刘倩,秦媛媛,张媛,等. 高华不同来源生脉注射液体外细胞毒性的比较及原因分析[J]. 中国中药杂志,2012,37(5):643-647.
[4] 夏晶、王钢力、季申,等. HPLC测定生脉注射液中4种成分的含量[J].中成药,2006,28(1):27-31.
[5] 国家食品药品监督管理局.2012年药品不良反应监测年度报告[EB/OL].[2013-03-14] http://www.sda.gov.cn/WS01/CL0051/79058.html.
[6] 国家食品药品监督管理局.国家药品不良反应监测年度报告(2013年) [EB/OL].[2014-05-14 ] http://www.sda.gov.cn/WS01/CL0078/99794.html.
[7] 国家食品药品监督管理局.警惕生脉注射液的严重过敏反应,[EB/OL].[2012-01-10 ] http://www.sda.gov.cn/WS01/CL0078/68318.html.
[8] 国家食品药品监督管理局.关于江苏苏中药业集团股份有限公司生脉注射液质量问题的通告(2015年第12号),[EB/OL].[2015-04-24 ] http://news.sda.gov.cn/WS01/CL0050/117962.html.
[9] 徐维.中药注射液生产过程中热原控制探讨[J].临床合理用药,2012,5(8A):140-141.
[10] 刘春兰. 浅谈中药注射剂生产过程中热原的产生与处理[J]. 黑龙江医药,2011,24(4):58-570.
[11] 姜翠莲,史新元,王耀,等. 超滤去除清开灵注射液中热原的研究[J].北京中医药大学学报,2009,32(11):776-778.
[12] 范能全. 活性炭去除注射液中热原的工艺条件考察[J].中国药师2012,15(9): 1301-1303.
[13] 毕殿洲.热原及消除注射液中热原的方法[J].中国药学杂志,1979,14(3):102-105.
[14] 李奉勤,史东霞,薛艳朝,等. 中药注射剂生产过程中热原的防止与处理[J].中国现代中药,2006,8(12):31-32.
R284.1
A
1007-8517(2015)19-0029-03
2015.06.30)
