入住重症监护病房时非感染患儿动态监测C-反应蛋白、前降钙素和肾上腺髓质素前体预测医院感染的价值
2015-05-04陆国平陆铸今闫钢风蔡小狄张燕红
程 晔 陆国平 陆铸今 闫钢风 蔡小狄 胡 静 张燕红 贺 骏
·论著·
入住重症监护病房时非感染患儿动态监测C-反应蛋白、前降钙素和肾上腺髓质素前体预测医院感染的价值
程 晔 陆国平 陆铸今 闫钢风 蔡小狄 胡 静 张燕红 贺 骏
目的 通过动态监测炎症指标评价其对医院感染预测的价值,并寻找入住PICU后最易发生医院感染的时点。方法 以入住PICU时非感染患儿为研究对象;以在PICU中发生医院感染结局为医院感染组,余为非医院感染组;收集4个时点的3项炎症指标[CRP、PCT和肾上腺髓质素前体(pro-ADM)],分析炎症指标对医院感染的预测价值。绘制受试者特征工作(ROC)曲线,计算曲线下面积、敏感度和特异度等。结果 2014年10月1日至2015年2月28日入住复旦大学附属儿科医院PICU符合本研究纳入和排除标准的危重症患儿75例。医院感染组23例,非医院感染组52例,两组在一般情况、基础疾病和有创操作方面差异均无统计学意义(P均>0.05)。两组危重症患儿在PICU中均分别得到238个CRP、PCT和pro-ADM值,医院感染组与非医院感染组的3个炎症指标水平差异均有统计学意义(P均<0.05),最佳界值分别为21.3 mg·L-1、0.85 ng·mL-1和0.86 nmol·L-1,受试者特征工作(ROC)曲线下面积分别为0.739、0.767和0.839。入住PICU至医院感染发生的时间为(118.9±70.8)h,入住PICU至距医院感染发生最近1次采血时点间隔为(96.5±66.4)h,医院感染发生与其最近1次采血时点间隔为(23.6±21.9)h。3个炎症指标不同组合,CRP+PCT+pro-ADM、PCT+pro-ADM、CRP+PCT和CRP+pro-ADM预测医院感染ROC曲线下面积分别为0.891、0.885、0.882和0.879;敏感度均为91.3%,特异度44.2%~63.5%。结论 CRP、PCT和pro-ADM单项及其组合均对医院感染有较好预测价值,入住PICU 4 d左右是适宜的以炎症指标判断医院感染的时点。
C-反应蛋白; 前降钙素; 肾上腺髓质素前体; 儿童重症监护病房; 医院感染; 敏感度; 特异度
以C-反应蛋白(CRP)、前降钙素(PCT)、脂多糖(LPS)和白介素-6(IL-6)等炎症指标对危重症患儿的医院感染进行早期预测,是近期研究的热点和争议的焦点[1,2],单个时点采集炎症指标对医院感染进行预测可能是导致争议的原因之一[1]。肾上腺髓质素(ADM)是新近发现的被寄予很高期望的炎症指标。研究发现,在脓毒症时ADM能特异性地异常升高[3],起到调节免疫和抗感染的作用[4],对感染有着良好的预判功能,而与患者本身的基础疾病无关[5]。但ADM在循环中的半衰期短(仅20 min)[3],临床应用受限。ADM前体(pro-ADM)在血循环中结构稳定,容易测定,且能很好地反映ADM的水平[6]。本研究以复旦大学附属儿科医院(我院)PICU为研究现场,动态监测炎症指标,并评价其对医院感染的预测价值,试图寻找入住PICU后最易发生医院感染的时点。
1 方法
1.1 研究设计 以入住PICU时非感染患儿为研究对象;以在PICU中发生医院感染结局为医院感染组,余为非医院感染组;收集4个时点的CRP、PCT和pro-ADM指标,优化炎症指标对医院感染的预测。
1.2 诊断标准 ①本文医院感染诊断依据国家卫计委于2001年颁布的“医院感染诊断标准(试行)”[7]。②本文参照2005国际儿童脓毒症与器官功能不全会议提出的感染诊断标准,界定除外医院感染的急性感染性疾病[8]。
1.3 纳入标准 2014年10月1日至2015年2月28日收住我院PICU的连续危重症患儿。
1.4 排除标准 符合以下任意一项者予以排除:①急性感染性疾病患儿;②入住PICU时已经发生医院感染[7];③PICU住院时间<48 h;④体重<2.5 kg的患儿,中、重度贫血[9]的患儿,重度营养不良[10]的患儿;⑤高度怀疑免疫抑制疾病患儿。
1.5 伦理 本研究方案经过我院伦理委员会审核同意。
1.6 观察指标和时点 ①医院感染及其诊断时间(根据临床表现、体格检查、实验室及影像学检查,PICU中每天评估医院感染)。②3项炎症指标:CRP、PCT和pro-ADM及其采集时间。需要说明的是出于伦理考量,研究设计的采血时点尽可能服从于PICU中常规实验室检查采血时点。于入住PICU后4 h内采血(N1采血时点),分别于第1次采血后48 h左右(N2采血时点)、120 h左右(N3采血时点)、196 h左右(N4采血时点)采血,当病例诊断为医院感染即停止后续用于本文观察必须时点的采血。
1.7 截取病例信息 入住PICU时年龄、性别、体重和基础疾病诊断;入住PICU时是否存在有创操作(气管插管、深静脉置管、导尿管置管和胃管留置等);发生医院感染距入住PICU的时间,发生医院感染距最近1次采血时点间隔,入住PICU后距发生医院感染最近1次不论炎症指标是否大于阳性界值的采血时点间隔。
1.8 分组 ①以患儿是否发生医院感染分为医院感染组和非医院感染组;②将距发生医院感染最近1次的炎症指标纳入炎症指标医院感染组,并归入相应亚组即CRP医院感染亚组、PCT医院感染亚组和pro-ADM医院感染亚组;余纳入炎症指标非医院感染组,并相应归入CRP非医院感染亚组、PCT非医院感染亚组和pro-ADM非医院感染亚组。
1.9 炎性指标检测方法 CRP检测采用散射比浊法;PCT检测采用夹心法原理(罗氏全自动电化学发光免疫分析系统);pro-ADM检测采用 TRACETM技术(Time-Resolved Amplified Cryptate Emission)。
1.10 统计学方法 采用Excel软件建立数据库,采用SPSS 18.0软件进行统计学处理。基线计量数据非正态分布采用中位数描述,计数资料采用百分比表示。偏态分布数据比较采用秩和检验。有创操作单因素分析有统计学意义时进一步行Logistic回归。炎症指标医院感染组的指标为距诊断医院感染最近一次的相应炎症指标值,每例患儿的其余时点的指标取均数作为炎症指标非医院感染组;多个指标不同组合时,以任意一个指标大于正常参考值作为阳性事件;绘制受试者特征工作(ROC)曲线,计算曲线下面积、敏感度、特异度、阳性似然比和阴性似然比。P<0.05为差异有统计学意义。
2 结果
2.1 基线情况 研究期间符合纳入标准的危重症患儿234例,图1显示经排除标准筛选后75例进入分析。其中男50例(66.7%),女25例,平均年龄(3.6±3.6)岁,入PICU时体重(17.8±12.0)kg。医院感染组23例(医院感染发生率9.8%),其中肺炎18例,导管相关血流感染3例,尿路感染2例;非医院感染组52例。
表1显示:①两组在性别、入住PICU平均年龄、入住PICU时平均体重方面差异均无统计学意义(P均>0.05)。②原发病意外伤害占28.0%,重大手术后监护占25.3%,肿瘤性疾病占17.3%。两组在原发病的总体分布上差异无统计学意义(Z=7.343,P>0.05)。③4例无有创操作,存在1、2、3和4种有创操作分别为6、16、10和39例;接受深静脉置管术占88.0%,留置导尿管78.7%,留置鼻胃管76.0%,气管插管56.0%;两组有创操作单因素分析显示气管插管、留置导尿管和深静脉置管差异有统计学意义;两组单项操作多因素分析差异均无统计学意义(P均>0.05)。

1 研究对象的纳入和排除流程图
Fig 1 Flow chart of patient selection
2.2 3项炎症指标对医院感染的预测价值 75例危重症患儿入住PICU后得到CRP、PCT和pro-ADM值均分别为238个,表2显示,3项炎症指标医院感染组与炎症指标非医院感染组的不同亚组间差异均有统计学意义。表3和图2显示, CRP、PCT和pro-ADM预测医院感染的最佳界值分别为21.3 mg·L-1、0.85 ng·mL-1和0.86 nmol·L-1;pro-ADM、PCT 和CRP的ROC曲线下面积分别为0.839、0.767和0.739。
2.3 发生医院感染与入住PICU和采血时间的关系 医院感染组2/23例在入住PICU 48 h 内发生医院感染,为非PICU医院感染,21例纳入发生医院感染与入住PICU和采血时间的统计;该21例中有2例(9.5%)4个采血时点中3项炎症指标的水平均低于本文相应最佳界值,也纳入了发生医院感染与入住PICU和采血时间的统计。
入住PICU至医院感染发生的时间为(118.9±70.8)h(约5 d),入住PICU至距医院感染发生最近1次的采血时点间隔为(96.5±66.4)h(约4 d),医院感染发生时间与其最近1次采血时点间隔为(23.6±21.9)h(约1 d)。
2.4 发生医院感染的高发时段及相应界值 N2~N3采血时段医院感染发生率为16.4%(12/73)、N3~N4采血时段医院感染发生率为6.6%(4/61)、N4采血时段以后医院感染发生率为8.8%(5/57);由于N3~N4和N4采血时段后医院感染的发生例数较少,未进一步行相应的预测参数分析。N2 ~N3采血时段中得到CRP、PCT和pro-ADM值均为73个。表4显示,CRP、PCT和pro-ADM预测医院感染的最佳界值分别为19.0 mg·L-1、0.61 ng·mL-1和0.75 nmol·L-1;pro-ADM、CRP和PCT 的ROC曲线下面积分别为0.806、0.692和0.722。
表1 非医院感染组和医院感染组基线情况比较[M(P25,P75),n(%)]
Tab 1 Comparisons of the baseline between NI group and non-NI group[M(P25,P75),n(%)]
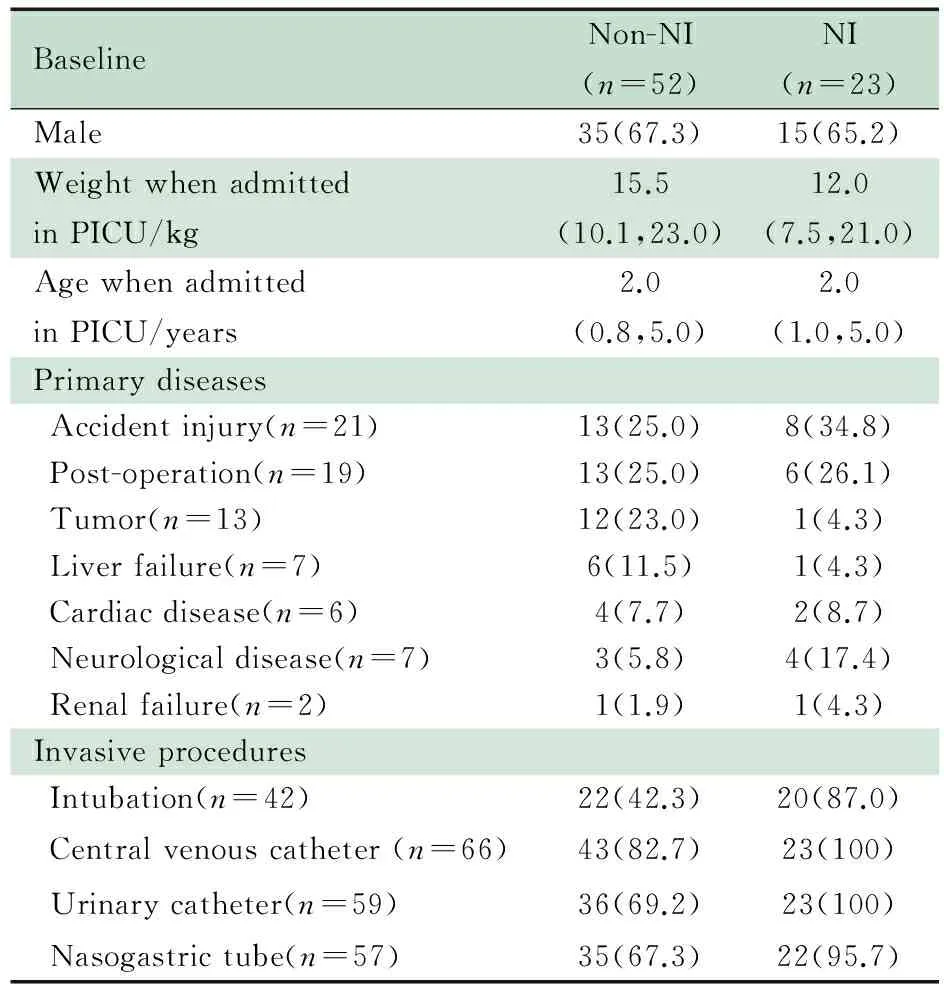
BaselineNon-NI(n=52)NI(n=23)Male35(67.3)15(65.2)WeightwhenadmittedinPICU/kg15.5(10.1,23.0)12.0(7.5,21.0)AgewhenadmittedinPICU/years2.0(0.8,5.0)2.0(1.0,5.0)PrimarydiseasesAccidentinjury(n=21)13(25.0)8(34.8)Post-operation(n=19)13(25.0)6(26.1)Tumor(n=13)12(23.0)1(4.3)Liverfailure(n=7)6(11.5)1(4.3)Cardiacdisease(n=6)4(7.7)2(8.7)Neurologicaldisease(n=7)3(5.8)4(17.4)Renalfailure(n=2)1(1.9)1(4.3)InvasiveproceduresIntubation(n=42)22(42.3)20(87.0)Centralvenouscatheter(n=66)43(82.7)23(100)Urinarycatheter(n=59)36(69.2)23(100)Nasogastrictube(n=57)35(67.3)22(95.7)
Notes Non-NI groupvsNI group, intubation:Z=12.902,P<0.001;urinary catheter:Z=4.524,P=0.033; nasogastric tube :Z=8.996,P=0.03
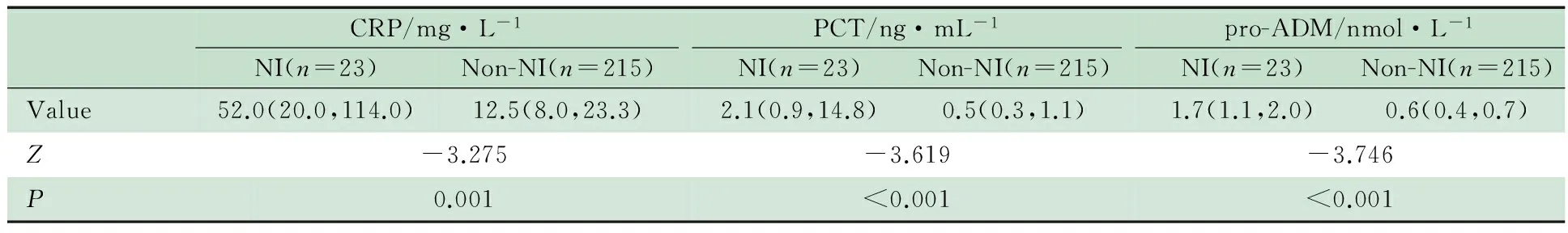
表2 3项炎性指标医院感染组和非医院感染组比较[M(P25,P75)]
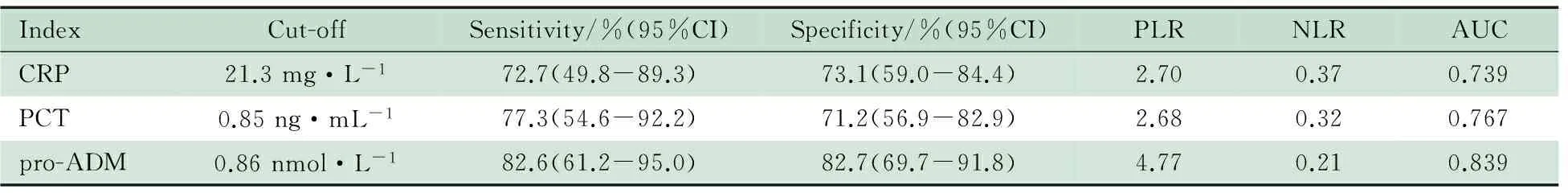
表3 75例危重症患儿4个采血时点3项炎症指标预测医院感染的最佳界值及参数
Notes PLR: positive likelihood ratio ; NLR:negative likelihood ratio
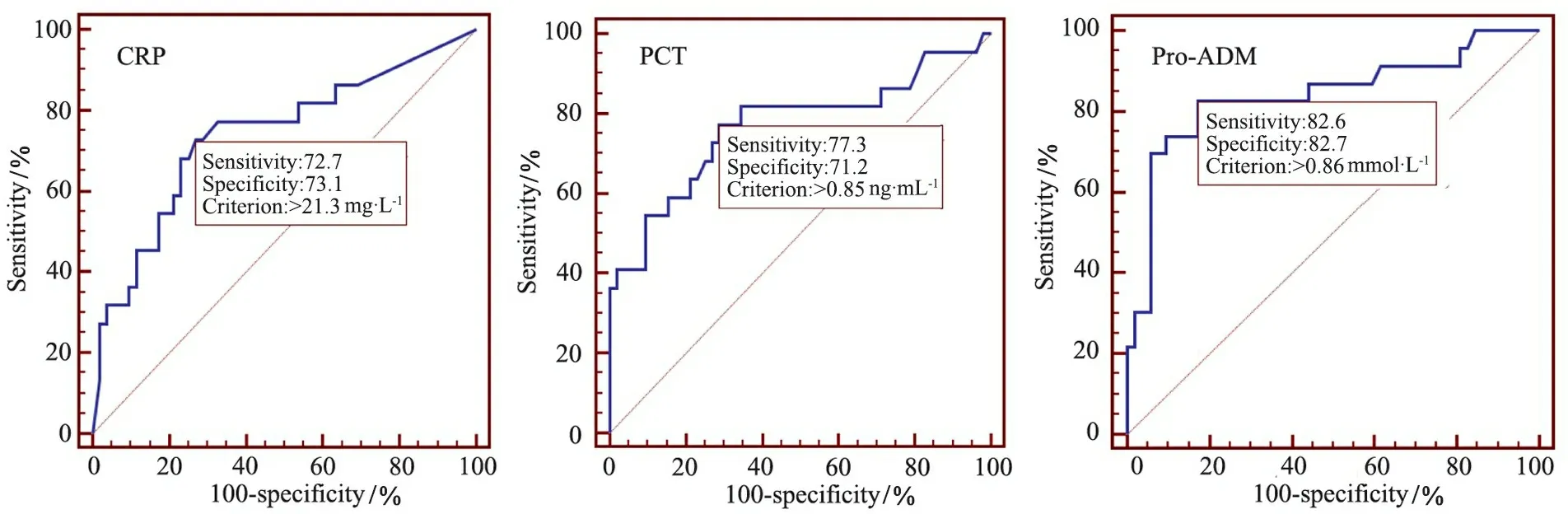
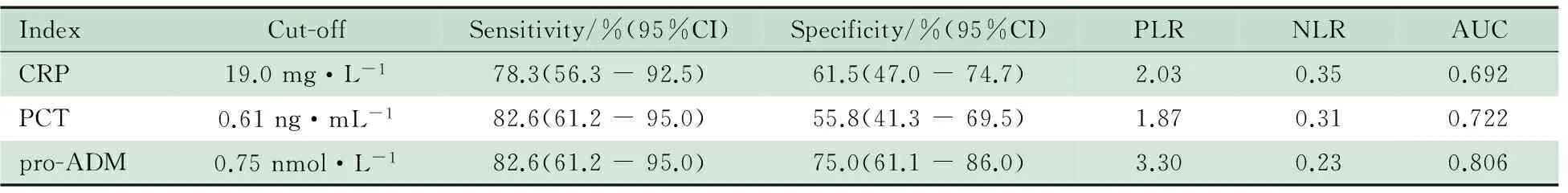
图2 CRP、PCT和pro-ADM预测医院感染的ROC曲线
Notes PLR: positive likelihood ratio ; NLR:negative likelihood ratio
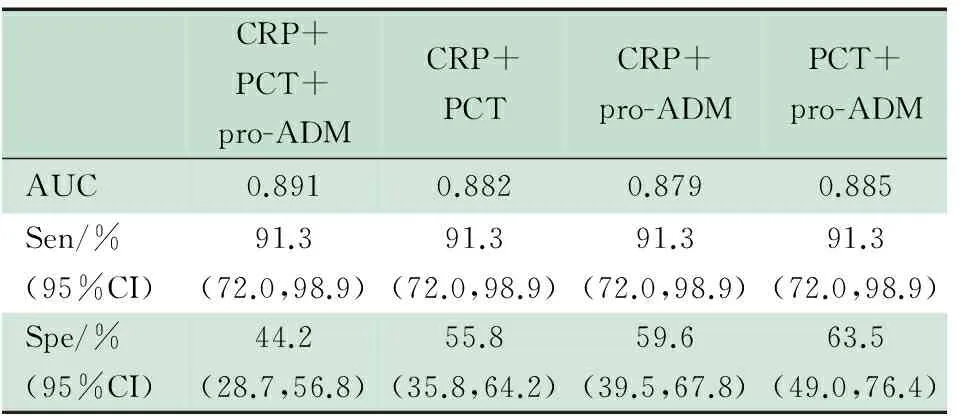
2.5 3项炎症指标的不同组合对医院感染的预测价值 表5显示,将整个研究阶段取得的3项炎症指标做不同组合,CRP+PCT+pro-ADM、PCT+pro-ADM、CRP+PCT和CRP+pro-ADM的不同组合预测医院感染ROC曲线下面积分别为0.891、0.885、0.882和0.879。敏感度均为91.3%,特异度44.2%~63.5%。
表5 3个炎性指标的不同组合对医院感染的预测参数
Tab 5 Different combinations of these 3 inflammatory markers to predict NI
CRP+PCT+pro-ADMCRP+PCTCRP+pro-ADMPCT+pro-ADMAUC0.8910.8820.8790.885Sen/%(95%CI)91.3(72.0,98.9)91.3(72.0,98.9)91.3(72.0,98.9)91.3(72.0,98.9)Spe/%(95%CI)44.2(28.7,56.8)55.8(35.8,64.2)59.6(39.5,67.8)63.5(49.0,76.4)
Notes Sen: sensitivity; Spe: specificity
3 讨论
医院感染所带来的高致残率、高致死率及高花费是全球PICU所面临的严峻问题[11~13]。来自儿科预防网站(Pediatric Prevention Network)的资料显示,发生医院感染的患儿较未发生者有着更长的PICU平均住院天数(8 dvs2 d)及平均住院时间(9.5 dvs4 d)[11]和更高的死亡风险(RR=3.4,95%CI:1.7~6.5)。尽管采取了加强医院管理、尽量减少不必要的有创操作等措施,但PICU医院感染的发生率仍居高不下。如果能早期预测医院感染的发生,在亚临床期就进行有效干预,就有可能及时控制医院感染,缩短住院时间,降低治疗费用。
本研究纳入我院晚近5个月PICU的234例患儿,为避免入组患儿已存在感染和在PICU容易发生感染的基础状态,设定了较为严格的排除标准,排除了入住PICU时存在急性感染、PICU住院时间<48 h、存在中重度贫血、重度营养不良、入住PICU时已发生医院感染和免疫抑制患儿共159例,最大程度上剔除因感染混杂因素对本文研究结果的影响。75例纳入分析的患儿,53.3%的患儿基础疾病为外科疾病,如重大手术后、意外伤害等。
本研究选择的3项炎症指标中CRP、PCT是PICU常规检测的指标,pro-ADM是一个新的炎症指标。既往CRP、PCT和pro-ADM可作为局限性感染(社区获得性肺炎等)和系统性感染(脓毒症等)的判定指标[14~16],鲜有作为医院感染预测指标的文献报道。CRP和PCT作为医院感染的判定指标一直存在较多争议,在创伤或外科术后早期[17,18]CRP和PCT均会异常升高,而与感染无关;pro-ADM相较于CRP和PCT有着更好的预测价值,特别是脓毒症或脓毒症休克时pro-ADM可特征性的异常升高[19],能消除CRP、PCT在炎症而非感染情况下升高的干扰。
感染是一个连续的过程,以入院中的一个时点的炎症指标来判定医院感染存在局限性,多个时点炎症指标的连续监测可相对客观地反映医院感染的实际状况[1]。本研究选择了4个时点采血行上述炎症指标动态监测。CRP、PCT等炎症指标大多在炎症反应发生的数小时内明显升高,若无感染发生,则持续24~72 h很快下降[20]。因此本研究N2~N3、N3~N4采血时间相隔72 h,能够较好体现炎症指标的变化与发生医院感染的时间关系。N1~N2采血时间相隔48 h,炎症指标反映的是入住PICU前医院感染的情况。需要说明的是,患儿入住PICU的时间是不受限制的,设计要求的4个采血时点可能有4~6 h的延误,如夜间入住PICU的患儿。
本研究医院感染组和非医院感染组入住PICU时有创操作,如气管插管、深静脉置管、导尿管留置单项有创操作的比例单因素分析差异有统计学意义,但本文75例PICU患儿中仅4例无有创操作,6例有1项有创操作,同时存在2~4项有创操作占86.7%(65/75),多项有创操作两组间差异无统计学意义,提示PICU基础情况可能对之后发生医院感染影响不大。Galia等[21]研究显示,小年龄、疾病的复杂程度、接受血管导管和导尿管置入均是医院感染发生的高危因素,气管插管不在高危因素之列。美国1项多中心研究显示,年龄并非是影响PICU医院感染的因素,而气管插管则是高危因素之一[1]。分析原因,①各研究纳入标准不同,Galia等[21]纳入心血管术后的患儿,美国多中心研究[1]包括了内科、外科患儿,本研究为入住PICU时非感染患儿;②对于医院感染的定义和检测方法不同[22],有研究以发生一个部位医院感染为结局(如本研究),也有以较长时段连续观察至多部位医院感染发生为结局;检测设备和方法也可能导致检测结果不尽相同;③采用单因素分析有创操作差异多有统计学意义,行多因素分析后差异多无统计学意义[21]。
本研究以临床诊断医院感染为结局,将诊断医院感染病例最近1次的炎症指标纳入炎症指标医院感染组,并归入相应亚组;将始终未诊断为医院感染病例所有的炎症指标纳入炎症指标非医院感染组,并归入相应亚组。结果显示,医院感染组与非医院感染组的不同炎症指标亚组间差异均有统计学意义,提示CRP、PCT和pro-ADM对医院感染均有预测作用。通过ROC曲线分别获得CRP、PCT和Pro-ADM预测医院感染的最佳界值,分别为21.3 mmol·L-1(敏感度72.7%,特异度73.1%)、0.85 ng·mL-1(敏感度77.3%,特异度71.2%)和0.86 nmol·L-1(敏感度82.6%,特异度82.7%)。显示3项炎症指标均有着较好的敏感度和特异度,其中Pro-ADM较CRP和PCT有更好的预测能力。
炎症指标预测医院感染除了要有预测界值,同时也需要清楚入住PICU的时间、连续的采血时间和诊断医院感染的时间。本文基于上述3个时间结点建立了预测医院感染的时间概念,①医院感染发生时间:反映的是入住PICU后医院感染高发时段;②医院感染发生与最近采血时点间隔:反映的是炎症指标阳性后多少时间内发生医院感染;③医院感染发生前最近采血时点距入住PICU间隔时间:反映的是在何时采血能获得对医院感染预测有意义的炎症指标。上述3个时间概念的建立,使得医院感染的预测成为可能。本文结果显示,入住PICU第5天左右是发生医院感染的高发期,入住PICU第4天炎症指标检测对未来24 h发生医院感染有较好提示意义。上述结论也可从临床上做出较合理的解释:①危重症患儿病程的第3~5天处于疾病的极期,可能存在相对的免疫抑制;危重症患者免疫功能监测结果显示,自入院第2天起CD3、CD4、NK细胞活性及IgM、补体C3等水平有明显降低,免疫抑制水平与疾病危重度呈正相关[23]。②危重症患儿大多存在多脏器功能不全或衰竭,胃肠道是最易受累的器官。在缺血缺氧或是全身炎症反应综合征后的48~72 h,由于肠道菌群正常生态平衡破坏,革兰阴性杆菌过度生长,也由于宿主的免疫防御系统受损,肠黏膜屏障受损,最易产生肠道菌群移位,肠源性感染是导致医院感染发生的重要因素[24]。③为明确诊断和脏器功能支持,危重症患儿入住PICU第3~5天是接受大量侵袭性操作时间,可能带来相应的继发性感染。④危重症患儿在疾病初期由于饥饿代谢与应激代谢并存,使能量与蛋白质消耗及需求增加,破坏了分解代谢和合成代谢之间的平衡,分解代谢大于合成代谢[25],导致免疫恶化。即便采取的营养支持,也很难满足正常代谢的需求[26]。
本研究N2采血时点为第1次采血后48 h左右,N3采血时点为于第1次采血后120 h左右,N2~N3采血时段(入住PICU的第2~5天)医院感染发生率最高(16.4%,12/73)、N3~N4采血时段(入住PICU第6~9天)医院感染发生率为6.6%(4/61)、N4采血时点(入住PICU第9天)以后医院感染发生率为8.8%(5/57)。同样也说明入住PICU第5天左右是医院感染的高发期。N2 ~N3采血时段CRP、PCT和pro-ADM最佳界值分别为19.0 mg·L-1、0.61 ng·mL-1和0.75 nmol·L-1,均低于整个疾病过程中CRP、PCT、Pro-ADM预测医院感染界值,进一步说明入住PICU第5天是医院感染高发期。
本研究将整个疾病过程中取得3项炎症指标界值做不同的组合,以检验对医院感染的预测作用,不论是3项或2项组合均比单项值有更好预测医院感染的价值,特别是敏感度有所提高,3项指标的组合仅略好于2项指标的组合,从临床实际与经济效益出发,可单独检测pro-ADM或联合CRP或联合PCT,能较好的对医院感染进行预测。
本研究不足与局限性:①医院感染诊断是每天进行1次,炎症指标不可能每天采血;②采血的时点至少有后延误4~6 h的可能,使得预测医院感染的时间只是粗略的估计;③观察至入住PICU 12 d左右,可能会遗漏在此后发生医院感染的患儿的相关信息;④医院感染定义从时间上表述有2个方面,一是入院48 h以后发生的医院感染,二是出院后48 h发生的感染,本文病例出PICU后未再进行医院感染的判断,可能有部分病例或在PICU后诊断医院感染。
[1]Becker KL,Snider R, Nylen ES. Procalcitonin assay in systemic inflammation, infection, and sepsis: clinical utility and limitations. Crit Care Med,2008,36(3):941-952
[2]utonelli M, Azoulay E, Bonten M, et al. Year in review in Intensive Care Medicine 2010: II. Pneumonia and infections, cardiovascular and hemodynamics, organization, education, haematology, nutrition, ethics and niscellanea. Intensive Care Med, 2011,37(2):196-213
[3]Beltowski J, Jamroz A. Adrenomedullin-What do we know 10 years since its discovery? Pol J Pharmacol,2004,56(1):5-27
[4]Marutsuka K, Nawa Y, Asada Y, et al. Adrenomed- ullin and proadrenomudullin N-terminal 20 peptide (PAMP) are present in human colonic epithelia and exert an antimicrobial effect. Exp Physiol,2001,86(5):543-545
[5]Potocki M, Breidthardt T, Reichlin T, et al. Midregional pro-adrenomedullin in addition to b-type natriuretic peptides in the risk stratification of patients with acute dyspnea: an observational study. Crit Care,2009,13(4):R122
[6] Struck J, Tao C, Morgenthaler NG, et al. Identification of an adrenomedullin precursor frag- ment in plasma of sepsis patients. Peptides,2004,25(8):1369-1372
[7]中华人民共和国卫生部.Diagnostic criteria for nosocomial infections(proposed). Natl Med J China(中华医学杂志), 2001,81(5):314-320
[8]Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med, 2005,6(1):2-8
[9]胡亚美,江载芳.诸福堂实用儿科学. 第七版(下册). 北京: 人民卫生出版社,2008. 1709
[10]胡亚美,江载芳.诸福堂实用儿科学. 第七版(上册). 北京: 人民卫生出版社,2008. 508
[11]Grohskopf LA, Sinkowita-Cochran RL, Garrett DO, et al. Pediatric Prevention Network: A national point-prevalence survey of pediatric intensive care unit-acquired infections in the United States. J Pediatr, 2002,140(4):432-438
[12]Urrea M, Pons M, Serra M, et al. Prospective incidence study of nosocomial infections in a pediatric intensive care unit. Pediatr Infec Dis, 2003,22(6):490-494
[13]Jordan GI, Arriourtua AB, Torre JA, et al. A national multicentre study on nosocomial infections in PICU. An Pediatr (Barc), 2012,69(1):35-45
[14]Uzzan B, Cohen R, Nicolas P, et al. Procalcitonin as a diagnostic test for sepsis in critically ill adults and after surgery or trauma: a systematic review and meta-analysis. Crit Care Med,2006,34(7):1996-2003
[15] Povoa P, Souza-Dantas VC, Soares M, et al. C-reactive protein in critically ill cancer patients with sepsis: influence of neutropenia. Crit Care, 2011,15(3) :R129
[16] Nierhaus A, Klatte S, Linssen J, et al. Mid-regional pro-adrenomedullin as a prognostic marker in sepsis: an observational study. Crit Care, 2005,9(6):R816-R824
[17] Sponholz C, Sakr Y, Reinhart K, et al.Diagnostic value and prognostic implications of serum procalcitonin after cardiac surgery: a systematic review of the literature. Crit Care, 2006, 10(5):R145
[18] Meisner M, Tschaikowsky K, Hutzler A, et al. Postoperative plasma concentrations of procalcitonin after different types of surgery. Intensive Care Med,1998, 24(7):680-684
[19]Nishio K, Akai Y, Murao Y, et al. Increased plasma concentrations of adrenomedullin correlate with relaxation of vascular tone in patients with septic shock. Crit Care Med, 1997, 25(6), 953-957
[20]Meisner M, Adina H, Schmidt J. Correlation of procalcitonin and C-reactive protein to inflammation, complications, and outcome during the intensive care unit course of multiple-trauma patients. Crit Care,2006,10(1):R1
[21]Grisaru-Soen G, Paret G, Yahav D, et al. Nosocomial infections in pediatric cardiovasular surgery patients: A 4-year survey. Pediatr Crit Care Med, 2009,10(2):202-206
[22]Dasgupta S, Das S, Chawan NS,et al. Nosocomial infections in the intensive care unit: Incidence, risk factors, outcome and associated pathogens in a public tertiary teaching hospital of Eastern India. Indian J Crit Care Med, 2015,19(1): 14-20
[23]Chen N(陈宁), Zhao HL, Cheng T. Observation of immunological function in critically ill patients in ICU. Clinical Medicine of China(中国综合临床),2008,24(4):356-358
[24]Magnotti LJ, Deitch EA. Burns, bacterial translocation, gut barrier function, and failure. J Burn Care Rehabil, 2005,26(5):383-391
[25]Xu Y(许媛). Practicalities of nutritional support in the critical illness. Chinese Journal of Clinical Nutrition(中国临床营养杂志),2008,16(4):199-202
[26]Li JS(黎介寿). 高分解代谢患者的营养支持. Nutional support in patients with hypermetabolism. Chin J Burns(中华烧伤杂志),2002,18(4):197-198
(本文编辑:张崇凡)
The value of monitoring C-reactive protein, procalcitonin and proadrenomedullin dynamically in predicting noscomial infection in PICU
CHENGYe,LUGuo-ping,LUZhu-jin,YANGang-feng,CAIXiao-di,HUJing,ZHANGYan-hong,HEJun
(DepartmentofEmergencyMedicine,Children′sHospitalofFudanUniversity,Shanghai201102,China)
LU Guo-ping,E-mail:13788904150@163.com
ObjectiveTo evaluate the utility of predicting nosocomial infection (NI) by monitoring dynamically the serum concentrations of C-reactive protein(CRP), procalcitonin (PCT) and plamsa proadrenomedullin (pro-ADM) and find the time-point liable for NI development in PICU.MethodsPediatric cases without infection were enrolled, and divided into two groups, the NI group was refered to the cases developing NI during the PICU stay, and the others were divided into non-NI group. The serum inflammatory mediators including CRP,PCT and plasma pro-ADM were detected at four time-points and were used to predict the occurrence of NI.ResultsA total of 75 pediatric cases in PICU of Children′s Hospital of Fudan University were enrolled from October 1, 2014 to February 28, 2015. Twenty-three cases were in NI group and other 52 cases were in non-NI group. There was no statistical difference for general features, primary diseases and invasive procedures between the two groups (P>0.05). A total of 238 blood CRP, PCT and pro-ADM specimens were respectively obtained for the two groups. There were statistical differences in the three inflammatory mediators between NI group and non-NI group, showing predicting significance for noscomial infection. The best cut-off values were 21.3 mg·L-1,0.85 ng·mL-1and 0.86 nmol·L-1,respectively and ROC curve areas were 0.739, 0.767 and 0.839, respectively. The period from admission to PICU to diagnosis of NI was(118.9±70.8)h, the period from diagnosis of NI to the nearest detecting time-point was(23.6±21.9)h, and the nearest detecting time-point of NI to the admission time was(96.5±66.4)h. The ROC curve areas of CRP+PCT+pro-ADM, CRP+PCT, CRP+pro-ADM and PCT+pro-ADM were 0.891, 0.885, 0.882 and 0.879, respectively and sensitivity was 91.3% and specificity ranged from 44.2% to 63.5%.ConclusionSingle and combined inflammatory mediators (CRP, PCT and pro-ADM) both have good value to predict NI in PICU. The 4thday admitted to PICU is the appropriate time-point to predict NI through detecting inflammatory mediators in blood.
C-reactive protein; Procacitonin; Proadrenomedullin; Pediatric intensive care unit; Nosocomial infection; Sensitivity; Specificity
复旦大学附属儿科医院重症医学科 上海,201102
陆国平,E-mail:13788904150@163.com
10.3969/j.issn.1673-5501.2015.02.011
2015-02-07
2015-04-03)
