新生儿惊厥诊断和治疗进展
2015-05-04马思敏周文浩
马思敏 杨 琳 周文浩
·讲座·
新生儿惊厥诊断和治疗进展
马思敏 杨 琳 周文浩
新生儿惊厥是中枢神经系统功能失调的重要表现。新生儿期的惊厥发生率远高于其后任何时期,并且80%的新生儿惊厥发生在生后1周内[1,2]。尽管目前电生理诊断技术的广泛应用,惊厥的诊断率已显著提高,但大多数研究报道采用临床表现来推测新生儿惊厥发生率,这可能导致了新生儿惊厥的发生率报道不一。国外报道新生儿惊厥的发生率足月儿为1‰~3‰,早产儿及低出生体重儿约为足月儿的10倍[3]。发生率明显不同主要因为诊断标准不同及新生儿惊厥轻微临床表现可能与非惊厥行为混淆。虽然连续性视频EEG监测是诊断新生儿惊厥的金标准,但大多数研究通过临床表现诊断惊厥,而EEG表现并未广泛被采用。所以目前新生儿惊厥的发生率远远被低估。新生儿惊厥的临床表现复杂多变,特别在早产儿中临床表现可以非常细微和不典型,因此观察者间的差异性较大。新生儿惊厥的EEG与临床表现相分离已被广泛认可[4]。
惊厥最常见于新生儿,且惊厥反复发作及惊厥持续状态在新生儿期发生的可能性明显升高。新生儿惊厥阈值降低反映其脑发育的不成熟性。新生儿脑发育兴奋系统暂时占优势[5]。如暂时性兴奋性氨基酸(主要为谷氨酸盐)受体过度表达及谷氨酸再摄取载体相对缺乏。这导致谷氨酸与突触后受体结合增强。另外,这些不成熟的谷氨酸受体更便于阴离子内流,细胞膜易于去极化并发生惊厥。而抑制性γ-氨基丁酸(GABA)通道在未成熟脑表达相对不足。实际上,在脑特定区域这些不成熟GABA可去极化(兴奋)而非超极化(抑制)。

1 新生儿惊厥的定义
新生儿惊厥是指生后28 d内(足月儿)或纠正胎龄44周内(早产儿)出现一种刻板的、阵发性发作的、引起神经功能(行为、运动和/或自主神经功能)改变的表现,伴或不伴异常同步大脑皮质放电的表现[7]。新生儿EEG所示惊厥被定义为一种突发的、重复的、进行性的和刻板的异常EEG表现,EEG振幅变化至少2μV,最短持续10 s[8]。

2 新生儿惊厥的分类
由于诊断上的困难,新生儿惊厥根据临床表现分为微小型,局灶性或多灶性阵挛型,局灶性或全身性强直型,局灶性、多灶性、全身性肌阵挛型,肌痉挛[10,11]。许多病例可发生不止一种类型的惊厥。
2.1 微小型 微小型是新生儿惊厥最常见的表现形式,多为一些过度的自主运动,可表现为眼部运动(阵发性斜视、眼球震颤、突然凝视、眨眼等),口-颊-舌运动(咀嚼、吸吮和咂嘴,常伴突然流涎增多、吐舌等),连续的肢体动作(踏步样、骑车样、拳击样、划船样或游泳样运动)或复杂的无目的性运动,交感神经功能异常(心率/呼吸大幅度有节律的波动、呼吸暂停、血压增高、阵发性面红或苍白等)。某些患儿刺激后可诱发或加重微小型惊厥的发作。由于这些运动由皮质下中枢控制,故发作时EEG常无相应变化,而且抗惊厥药物治疗效果常较差。
2.2 局灶性或多灶性阵挛型 阵挛型是指重复有节律的四肢、面部或躯干肌肉的快速收缩和缓慢放松运动,新生儿惊厥表现时节律更慢。可以为局灶性或多灶性表现,但一般无意识丧失。局灶性阵挛型常见原因是新生儿脑卒中,其他原因有颅内局灶性病灶、感染、蛛网膜下腔出血、局部外伤或代谢异常,EEG表现为局灶性的节律尖慢波,局灶性阵挛型的预后较好。多灶性阵挛型发作时出现多个肌群阵发性频繁地节律性抽搐,具有迁移性特点,常表现为身体同侧或双侧多个肢体或多个部位同时或先后交替、或快速从一侧发展至另一侧,无一定的顺序。这种四肢的随意阵挛样动作也经常出现在孕周<34周的正常早产儿中[12]。多灶性阵挛型惊厥时EEG可有多灶性脑电异常表现。新生儿阵挛型全身发作极为罕见,可能是由于未成熟脑不能将高同步放电同时传播至全脑。
2.3 局灶性或全身性强直型 强直型表现为持续肌肉收缩(数秒)而无重复特征,单侧肢体的持续姿势异常或躯干持续的非对称性的姿势异常。强直型惊厥常伴有强直性斜视、阵挛性动作、窒息和昏睡。强直型惊厥可以是局灶性或全身性。全身性强直型惊厥类似去大脑或去皮质姿势,最常见于弥漫性中枢神经系统功能不良或脑室内出血的早产儿。临床表现可不伴EEG改变。EEG背景多为多灶或广泛电压抑制,在某些病例可有明显异常的暴发抑制。强直型预后较差,而部分窒息后或缺氧后强直型发作患儿的预后较好。
2.4 局灶性、多灶性、全身性肌阵挛型 肌阵挛型是无节律且单一的四肢、面部或躯干肌肉的快速收缩,可无重复发作。肌阵挛型可以是局灶性、多灶性或全身性。局灶性和多灶性肌阵挛型惊厥常伴随EEG高尖波。全身性肌阵挛型惊厥EEG可表现为暴发抑制。典型肌阵挛惊厥常伴有弥漫性中枢神经系统病理改变,多提示严重脑功能损伤,常见原因有围生期窒息、先天性代谢异常、大脑发育不全或严重脑创伤,提示远期预后不良。
2.5 肌痉挛 肌痉挛是全身屈肌和(或)伸肌持续1~2 s的快速肌肉收缩。肌痉挛比强直发作持续时间短。EEG可见一个单一的、短暂的全身放电表现。
3 类惊厥样动作

新生儿惊厥通常是严重神经系统病理变化的一个临床表现,而类惊厥样的动作通常是良性的。如果存在病理性改变,抗惊厥治疗则是合理的。而如果过度使用抗惊厥药物治疗类惊厥样动作,可能会再次损伤中枢神经系统。因此,如类惊厥样动作存在潜在病理性基础,需要谨慎观察、鉴别和治疗,避免过度抗惊厥治疗。
早产、镇静药和呼吸系统疾病所致的非惊厥性呼吸暂停以及周期性呼吸,有时很难与新生儿惊厥性呼吸暂停区别。新生儿惊厥性呼吸暂停并不少见,但很少单独发作,大多数是惊厥表现的一部分。以下几点有助于鉴别:惊厥性呼吸暂停持续时间很少>20 s;惊厥性呼吸暂停早期心率常增快,一般不会引起心率下降;而非惊厥性呼吸暂停早期常伴心动过缓;惊厥性呼吸暂停常合并微小型惊厥类型如凝视、斜视和眼球震颤等;惊厥性呼吸暂停可有EEG放电,非惊厥性呼吸暂停无EEG异常表现,除非长时间呼吸暂停时有振幅下降。
4 新生儿惊厥的病因
新生儿惊厥的病因众多,不同病因的发病时间和预后大相径庭。只有明确新生儿惊厥的病因才能对症治疗,有效抗惊厥治疗。但新生儿惊厥常多种病因同时存在,判断惊厥发生的主要病因难度大。
新生儿惊厥危险因素[3]包括产前孕母因素:母亲孕龄>40岁,初产妇,糖尿病孕妇/妊娠期糖尿病孕妇;产前因素:胎儿窘迫,胎盘早剥,脐带脱垂,第二产程延时,孕妇发热,绒毛膜羊膜炎;新生儿因素:胎龄过小的早产儿,低出生体重儿,过期儿(孕>42周),男性。新生儿惊厥的常见病因[3, 12, 15]包括缺氧缺血性脑病、败血症(脑膜炎、脑炎)、颅内出血(脑室内出血、脑实质出血、蛛网膜下腔出血和硬膜下出血)、脑梗死和先天性脑发育畸形;少见病因有代谢性疾病(低血糖、低钙血症、低镁血症、低钠/高钠血症、高胆红素血症/胆红素脑病、高氨血症、高甘氨酸血症和维生素B6依赖症)、母亲吸毒/新生儿戒断综合征、良性非家族性新生儿惊厥、良性家族性新生儿惊厥和高血压。
生后<24 h惊厥发病常见病因包括:缺氧缺血性脑病、脑膜炎/败血症、硬膜下/蛛网膜下腔出血、脑室内出血、宫内感染、产伤、维生素B6缺乏、戒断综合征/药物作用等;生后24~72 h常见病因包括:脑膜炎/感染,早产儿主要为脑室内出血,足月儿主要为脑梗死、静脉栓塞和脑发育不良等;生后72 h至1周常见病因包括:在<72 h惊厥发病的各种原因的基础上还包括遗传代谢病、低钙血症、家族性新生儿惊厥;生后1~3周常见病因包括:<1周惊厥发病的各种原因的基础上还包括单纯疱疹病毒感染。
检索PubMed数据库中人类孟德尔遗传疾病数据库(OMIM)数据库(http://www.ncbi.nlm.nih.gov/omim),整理并归纳了可以在新生儿、婴儿期发病的以惊厥为主要表型的疾病,并针对其已知致病基因进行了相互关联性的分析(图1)。从图1中可以发现,已知致病基因相对集中在离子转运、神经元的形成及轴突化相关的通路之中。

1 在新生儿、婴儿期发病的以惊厥为主要表型的疾病已知致病基因相互作用图
注 每个椭圆形代表一个已知的致病基因,椭圆形之间的连线代表存在相互的关联性,可能处于相同的通路之中;孤立存在的椭圆形代表和其他的已知致病基因间尚无相互作用存在;椭圆之间的不同颜色连线代表不同类型的证据所证实的关联性,具体参见string网站(http://string.embl.de)的相关解释

4.1 新生儿良性家族性惊厥 新生儿良性家族性惊厥通常有新生儿惊厥家族史,生后1周内即出现惊厥,临床表现不一,典型患儿在生后2~3 d出现窒息、微小型自主运动、强直性动作、阵挛,一般生后15周内可自行消失。发作期EEG表现突然暂时全电压衰减,以后长时间泛化重复棘波和(或)尖波放电。良性家族性惊厥少有EEG稳定病灶或发作后期表现。发作间期可正常或偶尔暴发变化θ活动。发作间期神经系统检查、实验室和影像学检查正常。新生儿期惊厥次数及治疗与远期预后无关,大多数患儿远期预后良好。既往多认为这种疾病不需要积极抗惊厥治疗。

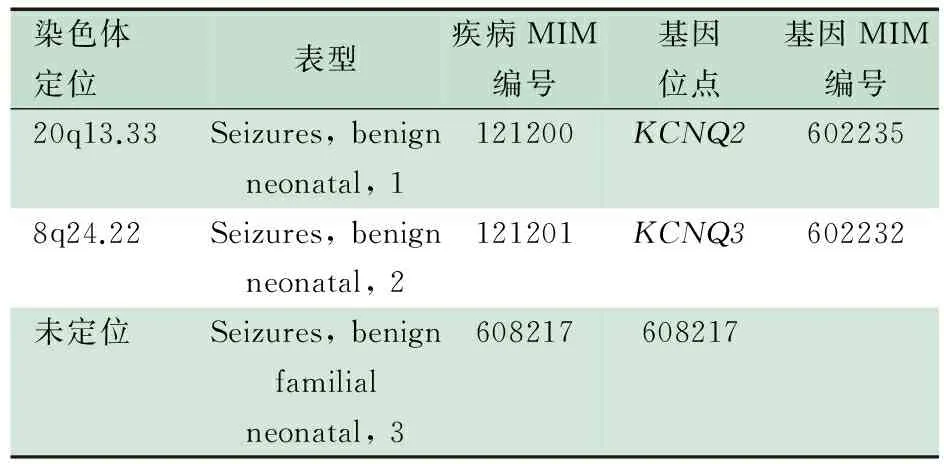
表1 新生儿良性家族性惊厥的分类
5 脑电生理检查
惊厥EEG为重复放电,包括频率、幅度和地形图表现,持续时间≥10 s。新生儿惊厥的EEG表现有其特殊性,表现多为局部性发作。另外,在脑病患儿EEG存在背景异常的非惊厥节律性变化。由于脑发育的不成熟,许多可疑的临床惊厥发作可以无脑电相关性,而许多EEG表现的惊厥也没有临床相关性,出现脑电-临床分离现象,常表现为多灶性和不同步的放电[22]。
长程视频EEG监测是新生儿惊厥的诊断金标准。Murray等[4]对51例足月高危儿生后6~72 h行12导联视频EEG监测,同时有经验的新生儿专业医生记录观察临床惊厥发作情况,结果表明其中9例发现EEG发作惊厥共526次,179次(34%)伴有视频EEG上同步的临床惊厥发作表现,然而临床医务人员仅记录到48次(9%)与EEG发作一致的临床惊厥表现。另外,在177次记录为可疑的临床惊厥发作中,只有48次(27%)伴随EEG惊厥发作。可见,视频EEG能够发现惊厥脑电发作与临床发作之间的关系,并有助于鉴别类似脑电发作的伪迹。
振幅整合脑电图(aEEG)监测脑功能对新生儿惊厥有一定的诊断意义。Shellhaas等[23]研究了851次由常规EEG监测到的新生儿惊厥,78%能够在aEEG的导联上观察到。但单独使用aEEG时,对惊厥检测的敏感度及特异度不高。Shah等[24]观察21例高危足月儿,进行单通道aEEG、2通道aEEG和aEEG联合2通道EEG监测与同步连续性常规EEG比较,aEEG联合2通道EEG的敏感度76%,特异度78%, 单通道aEEG或2通道aEEG的敏感度分别为27%和56%,且观察评判者之间的一致性较低。
表2 婴儿早期癫性脑病分子遗传学分类

表2 婴儿早期癫性脑病分子遗传学分类
疾病疾病MIM编号基因名称基因MIM编号EIEE1308350ARX300382EIEE2300672CDKL5300203EIEE3609304SLC25A22609302EIEE4612164STXBP1602926EIEE5613477SPTAN1182810EIEE6607208SCN1A182389EIEE7613720KCNQ2602235EIEE8300607ARHGEF9300429EIEE9300088PCDH19300460EIEE10613402PNKP605610EIEE11613721SCN2A182390EIEE12613722PLCB1607120EIEE13614558SCN8A600702EIEE14614959KCNT1608167EIEE15615006ST3GAL3606494EIEE16615338TBC1D24613577EIEE17615473GNAO1139311EIEE18615476SZT2615463EIEE19615744GABRA1137160EIEE20300868PIGA311770EIEE21615833NECAP1611623EIEE22300896SLC35A2314375EIEE23615859DOCK7615730EIEE24615871HCN1602780EIEE25615905SLC13A5608305EIEE26616056KCNB1600397EIEE27616139GRIN2B138252EIEE28616211WWOX605131
因此,对临床可疑新生儿惊厥以及脑损伤高危儿应予以连续性视频EEG监测,最好在生后24 h内监测。如果EEG正常,尤其临床怀疑惊厥发作时EEG正常,那么之后仅在临床持续发作时考虑EEG检查。几次发作时均无EEG变化,尤其发作间期背景正常,提示不是惊厥。一旦EEG捕捉到惊厥活动并予以抗惊厥治疗,须持续EEG监测,因抗惊厥药物只能控制临床惊厥发作,在EEG仍可存在已有的或未发现的惊厥[25]。理想做法是在记录最后1次惊厥发作后继续监测24~48 h。1周后复查EEG特别有预测价值。以后是否需要EEG检查以指导抗惊厥药物疗效和疗程仍存在争议。长程视频EEG对于新生儿惊厥的诊断和治疗有着较好的指导意义。
6 影像学检查
目前头颅超声是新生儿惊厥影像学检查的首选。除非有强烈指征需要神经外科介入治疗,如颅内出血等,否则很少选择头颅CT检查。头颅MRI被认为是最好的显像模式。Barnette等[26]通过对2006至2010年佛蒙特州-牛津协作网(Vermont Oxford Network,VON)生后3 d内确诊为新生儿脑病的4 171例新生儿(孕周≥36周或进行低温治疗)进行了头颅超声、CT和MRI检查的病例行回顾性分析,数据显示22.7%的患儿进行了头颅CT检查,而头颅超声和头颅MRI的比例分别是48.8%和65.5%。研究认为CT对于新生儿脑损伤的确诊不如头颅MRI敏感,且存在辐射。而头颅超声可行床旁检查,可以作为筛查性检查,而头颅MRI检查对于评估新生儿脑病更有价值。影像学检查可以辅助诊断一些新生儿惊厥的病因,例如Zellweger综合征存在多小脑回,这对于遗传咨询很重要。因此,目前神经影像学检查对公认的新生儿惊厥病因,如怀疑缺氧缺血性脑病、先天性代谢性疾病、脑发育异常、脑卒中等时,有一定的诊断价值和临床意义。

7 实验室检查
新生儿惊厥发作的时间性对其病因的判断有一定帮助,通过有序合理的时间相关性病因分析的过程可以寻找到大多数惊厥的病因。首次怀疑新生儿惊厥时应立即除外并纠正可能的有害因素,如低血糖、低血钙和低血镁等。确诊惊厥后应予以治疗,按照合理的途径寻找病因,明确病因来调整诊疗计划。检查包括详细的询问出生史、母孕史、喂养史、生长发育史、家族史;仔细检查有无畸形、创伤、皮肤损害或异常气味。神经系统检查包括准确描述惊厥临床特征,新生儿精神状态,颅神经检查,发作期间的活动、肌张力、原始反射和深浅反射。某些临床特征可能提示特殊病因,有助于快速做出病因诊断。之后需要选择特殊诊断方法寻找或确诊惊厥的病因,包括血液、脑脊液、EEG以及神经影像学检查。实验室检查的目的首先是为了迅速诊断和治疗以挽救生命,其次是为了尽可能减少脑损伤的进行性发展,从而降低存活儿远期神经系统后遗症。
在诊断代谢性疾病和感染时,循序渐进的实验室检查是相当重要的。一旦漏诊误诊,将会导致永久性的脑损伤。在新生儿惊厥初诊时为了鉴别代谢性原因和感染时,需要考虑的基本实验室检查项目[30]包括血糖,血清钠、钾、钙和镁,血气:pH、pCO2、BE、乳酸,血AST/ALT、尿素,血氨(特别是pCO2和乳酸低),血、尿氨基酸质谱(如家族中有类似病例者和/或肠内喂养同时出现惊厥),血常规,CRP和(或)其他炎症指标,血培养,血选择性病毒PCR,尿亚硝酸盐,尿培养,脑脊液细胞计数、培养、糖、乳酸、蛋白、选择性病毒PCR(巨细胞病毒、单纯疱疹病毒、肠道病毒、柯萨奇病毒B、埃可病毒)等。运用床旁纸片法血糖测试能够快速检测出低血糖。血气分析能够提示是否存在乳酸血症,以便进行下一步的代谢病检测,包括氨基酸质谱检测。由B群链球菌、大肠杆菌、李斯特菌、葡萄球菌和某些革兰阴性菌引起的细菌性脑膜炎常常也会导致新生儿惊厥发生。一些高度怀疑细菌性脑膜炎所致惊厥的新生儿需要进行的实验室检查项目包括全血细胞计数和炎症指标,腰椎穿刺进行细胞分析和培养。单纯疱疹病毒和巨细胞病毒引起的脑膜脑炎也需要早期诊断和治疗,现在用PCR方法可以快速明确,以避免延迟抗病毒治疗导致的不良预后。有时眼科检查也能提供一些感染或代谢性疾病的依据,如TORCH感染等。如果基本的实验室检查未能发现阳性情况,则需要进一步的实验室检查来发现新生儿惊厥的罕见原因。新生儿惊厥的罕见病因实验室检查[30]包括,维生素相关的惊厥:维生素B6相关(盐酸吡哆醇和磷酸吡哆醛)、亚叶酸缺乏(亚叶酸相关惊厥和大脑叶酸缺乏)、维生素H缺乏(生物素缺乏、羧酸盐缺乏);能量缺陷:GLUT-1(葡萄糖转运体缺陷)、脑肌酸缺乏症。存在畸形特征时,实验室检查还应该包括细胞分子遗传学的技术(染色体核型分析、aCGH和基因测序等)予以明确病因。
8 治疗

新生儿惊厥治疗的首选是去除惊厥的可能病因。其目的是尽快通过治疗潜在的病因来控制惊厥,但这是相当困难的。因为往往很难找到惊厥的确切病因,甚至有些通过积极的治疗并不能完全控制惊厥发作。一般新生儿惊厥用常规抗惊厥药疗效不如年长儿童,尤其是脑电-临床分离的惊厥,即使大剂量多种抗惊厥药联用疗效仍较差。对大剂量药物的风险-效益比还存在争议,尤其需要权衡惊厥对不成熟脑的直接损伤及大剂量药物对发育中脑的影响。因此新生儿抗惊厥药物治疗存在较大的争议。一些临床学者认为新生儿惊厥发作时快速有效的抗惊厥治疗能够减少生理和代谢紊乱,从而避免中枢神经系统的再次损伤[31~33]。一些学者则认为在抗惊厥治疗前需要衡量抗惊厥药物治疗的利弊,特别是在一些明确惊厥原因的新生儿中(如低钙血症、低镁血症或低血糖症)[34]。尽管目前新生儿惊厥治疗缺少相关循证指南,但学者们一致认为频繁惊厥发作或惊厥持续状态应立即控制惊厥,以确保维持心肺功能正常。
目前多种抗惊厥药物的适用人群不包括新生儿,在新生儿中应用属于超说明书使用,需要获得伦理的审核,并向患儿家长交代由此带来的利益和风险,在权衡利弊的情况下使用,并密切观察使用期间的不良事件。
8.1 传统抗惊厥药物
8.1.1 苯巴比妥 苯巴比妥是目前新生儿惊厥常用的一线抗惊厥药[35,36],不仅可以控制惊厥发作,还能降低脑代谢率。其静脉使用初次负荷量为15~20 mg·kg-1,可根据情况逐渐加量至最大量40 mg·kg-1,该剂量时新生儿惊厥的有效控制率约为77%[37]。Boylan等[38]的一项小样本RCT研究中,11/22例(50%)EEG确诊的新生儿惊厥苯巴比妥40 mg·kg-1单药治疗时控制了惊厥发作。部分新生儿由于镇静后减少了异常运动,但此时脑内仍有异常放电,出现了脑电-临床分离现象,产生苯巴比妥有效假象[39],这也可能造成了文献报道有效率的差异。因此提倡应用更大剂量,但Sarkar等[40]研究发现对亚低温治疗前使用苯巴比妥治疗新生儿惊厥并不能改善新生儿病死率和异常脑损伤的MRI表现,但并未做远期的评估,可能增加药物剂量对心肺抑制的危险超过治疗的益处。
苯巴比妥由肝脏代谢、肾脏排泄,因此肝肾功能不全时应适量减量。在肝功能损害的窒息新生儿用常规剂量可使血药浓度增高,镇静可持续数日。因此对严重窒息、肝功能损害的新生儿用最大负荷量苯巴比妥后,仍有惊厥者应加用二线镇静效果稍低的药物如苯妥英钠。苯巴比妥作为肝酶诱导剂,可加速其他药物及本身的代谢。在联合用药控制惊厥发作时需监测药物血药浓度和相互作用。
8.1.2 苯妥英钠 苯妥英钠是新生儿惊厥的二线用药,一般用于苯巴比妥无效时[12]。苯妥英钠负荷量为15~20 mg·kg-1,维持量为4~8 mg·kg-1·d-1。当负荷量达到20 mg·kg-1仍未控制惊厥时,应改用其他药物[41]。苯妥英钠由肝脏代谢、肾脏排泄,肝肾功能损害时应适当减量。常见不良反应包括低血压、心动过缓和心律不齐,静脉使用时局部漏出可导致严重的皮肤损伤等。磷苯妥英钠为一种含有磷酸盐的苯妥英钠,其代谢和排泄与苯妥英钠相似,但比后者更稳定,不良事件发生率低,国外临床更常用,国内不用[42,43]。Kriel等[42]报道了2例静脉使用磷苯妥英钠治疗难治性惊厥的低出生体重儿的成功案例。但是目前仍缺少大样本磷苯妥英钠治疗新生儿惊厥的研究。
8.1.4 利多卡因 利多卡因抗惊厥作用具有浓度依赖性[47]。低浓度时能够有效抑制惊厥的临床发作以及EEG发作,而高浓度时可引起惊厥。半衰期为90~100 min,主要通过肝肾代谢排出。Malingre等[48]使用静脉利多卡因治疗新生儿惊厥,剂量为首次10 min内给予2 mg·kg-1的负荷量,随后第1个12 h以6 mg·kg-1·h-1持续静脉给药,第2个12 h以4 mg·kg-1·h-1持续静脉给药,最后1个12 h以2 mg·kg-1·h-1持续静脉给药,治疗有效率为76%,且未发生心律失常。主要不良反应为心律失常、高钾血症、肝肾功能损害等。
8.2 新型抗惊厥药物

左乙拉西坦口服吸收迅速完全,血浆蛋白结合率低,呈线性动力学特征,药物相互作用少,半衰期长[52]。2/3的左乙拉西坦以原型从肾脏排泄,1/3代谢为无活性成分以及被乙酰水解酶分解[53]。Merhar等[54]通过18例新生儿惊厥患儿单用左乙拉西坦后药动学平均半衰期为8.9 h,清除率为1.21 mL·min-1·kg-1,较年长儿半衰期增加,而清除率更低。Sharpe等[55]对18例足月儿惊厥予左乙拉西坦单用,其药动学特征为生后第1天平均清除率为0.7 mL·min-1·kg-1,而第7天上升为1.33 mL·min-1·kg-1。半衰期则第1天的18.5 h下降为第7天的9.1 h。但这些研究由于样本量均不大,缺乏大样本的药动学研究。
左乙拉西坦在成人和儿童中有良好的安全性[56]。Glauser等[57]对4~16岁儿童部分发作型惊厥左乙拉西坦治疗进行了多中心双盲安慰剂RCT,研究显示不良反应主要为嗜睡、意外伤害、呕吐、厌食、神经紧张、鼻炎、咳嗽和咽炎等。治疗组中有23%的患儿出现嗜睡,而安慰剂组为11%,但不会引起治疗中断。左乙拉西坦在新生儿惊厥治疗中也是相对安全的,除了嗜睡外,未观察到其他明显不良反应[54,55, 58]。

8.2.2 布美他尼 布美他尼是一种快速起效和失效的袢利尿剂,在近30年美国新生儿科作为常规利尿剂使用[60]。布美他尼为钠-钾-氯共转运体抑制剂,可提高细胞内氯离子浓度,在低浓度时即可抑制钠-钾-氯共转运体的活性,从而减少或逆转GABA的去极化作用,造成神经元冲动的减少[61~63]。而且,低体温时布美他尼可增加苯巴比妥在新生大鼠体内的抗惊厥活性[64,65],提示苯巴比妥与布美他尼联合用药可能作为新生儿惊厥治疗的方法,并可能增强临床上缺氧缺血性脑病新生儿亚低温治疗的神经保护作用。
布美他尼药动学研究聚焦在治疗心肺疾病中液体过多的新生儿人群中,包括重症足月儿和早产儿[60, 66~68]。布美他尼在婴儿中的半衰期较成人长。Lopez-Samblas等[69]对14例新生儿(11例早产儿和3例足月儿)在生后1周内静脉使用布美他尼,剂量分别为0.05 mg·kg-1(8例)和0.1 mg·kg-1(6例),血浆清除率为0.2~1.0 mL·min-1·kg-1,半衰期是4~19 h。约40%布美他尼通过肾脏排泄,剩余的通过P450酶经肝脏代谢[70]。Pressler等[71]对14例EEG证实惊厥的缺氧缺血性脑病新生儿将布美他尼作为添加治疗,并不能改善惊厥的控制情况,而11例存活儿中有3例出现了耳毒性的不良反应。

托吡酯的蛋白结合率不高并且呈线性动力学特征。大约70%的药物通过尿液原型清除。Manitpisitkul等[79]研究显示,1~24月龄患儿使用剂量为3~25 mg·kg-1·d-1托吡酯时,呈线性动力学特征,且与肌酐清除率、年龄和体重无关,提示1~24月龄患儿可耐受25 mg·kg-1·d-1托吡酯。新生儿药动学研究资料有限。Filippi等[80]在一项小型的2期临床试验中将足月儿随机分为轻度或深度全身亚低温治疗72 h,所有患儿接受托吡酯口服治疗3 d,剂量为5 mg·kg-1·d-1。13例深度亚低温治疗患儿中的11例托吡酯血药浓度在参考范围5~20 mg·L-1内,2例超过了上限。低温治疗患儿较常温患儿表现出较慢的吸收和清除能力。托吡酯目前仅有口服剂型,这在禁食新生儿中的使用受到了限制。然而,静脉剂型的成人患者或健康志愿者临床试验提示其具有较好耐受性[81]。


8.3 其他 也有维生素B6、磷酸吡哆醛、亚叶酸等作为难治性新生儿惊厥的治疗[12]。
9 结束语
新生儿惊厥存在一些有争议的问题。目前关于新生儿惊厥的临床诊断存在“临床-脑电分离”现象,仅凭临床表现或EEG显示惊厥均存在其局限性,因此到底仅临床表现的惊厥或仅EEG所示惊厥能不能认为是真性的惊厥发作?而对于新生儿惊厥的抗惊厥治疗原则并不统一,疗效的判别也众说纷纭,如何规范抗惊厥治疗以及监测抗惊厥药物的疗效、何时停药,仍有待研究。

从某种意义上讲,由于新生儿惊厥这类疾病位于新生儿科、神经科的交叉之间,既往并没有得到足够的关注和充分的研究,相信随着临床上对于此类患儿关注度的提升,并借助影像学、电生理学以及分子遗传学技术的不断进展,会对这一类新生儿常见的神经系统功能异常有更为详尽、全面的理解和阐述,最终实现分子病因学的诊断及针对病因靶点进行有针对性的干预治疗,为此类患儿提供最高质量的医疗诊治。
[1]Lanska MJ,Lanska DJ,Baumann RJ, et al. A population-based study of neonatal seizures in Fayette County, Kentucky. Neurology, 1995, 45 (4): 724-732
[2]Glass HC,Pham TN,Danielsen B, et al. Antenatal and intrapartum risk factors for seizures in term newborns: a population-based study, California 1998-2002. J Pediatr, 2009, 154 (1): 24-28
[3]Vasudevan C,Levene M. Epidemiology and aetiology of neonatal seizures. Semin Fetal Neonatal Med, 2013, 18 (4): 185-191
[4]Murray DM,Boylan GB,Ali L, et al. Defining the gap between electrographic seizure burden, clinical expression and staff recognition of neonatal seizures. Arch Dis Child Fetal Neonatal Ed, 2008, 93 (3): 187-191
[5]Jensen FE. Neonatal seizures: an update on mechanisms and management. Clin Perinatol, 2009, 36 (4): 881-900
[6]Uria-Avellanal C,Marlow N,Rennie JM. Outcome following neonatal seizures. Semin Fetal Neonatal Med, 2013, 18 (4): 224-232
[7]Volpe JJ. Neurology of the newborn. 2nd ed. Philadelphia:Elsevier, 1987
[8]Abend NS,Wusthoff C J. Neonatal seizures and status epilepticus. J Clin Neurophysiol, 2012, 29 (5): 441-448
[9]Nardou R,Ferrari DC,Ben-Ari Y. Mechanisms and effects of seizures in the immature brain. Semin Fetal Neonatal Med, 2013, 18 (4): 175-184
[10]Mizrahi EM,Kellaway P. Characterization and classification of neonatal seizures. Neurology, 1987, 37 (12): 1837-1844
[11]Mizrahi EM,Clancy RR. Neonatal seizures: early-onset seizure syndromes and their consequences for development. Ment Retard Dev Disabil Res Rev, 2000, 6 (4): 229-241
[12]Kanhere S. Recent advances in neonatal seizures. Indian J Pediatr, 2014, 81 (9): 917-925
[13]Huntsman RJ,Lowry NJ,Sankaran K. Nonepileptic motor phenomena in the neonate. Paediatr Child Health, 2008, 13 (8): 680-684
[14]Orivoli S,Facini C,Pisani F. Paroxysmal nonepileptic motor phenomena in newborn. Brain Dev, 2015
[15]Loman AM,ter Horst HJ,Lambrechtsen FA, et al. Neonatal seizures: aetiology by means of a standardized work-up. Eur J Paediatr Neurol, 2014, 18 (3): 360-367
[16]Schroeder BC, Kubisch C, Stein V, et al. Moderate loss of function of cyclic-AMP-modulated KCNQ2/KCNQ3 K+ channels causes epilepsy. Nature, 1998,396(6712):687-690
[17]Singh NA, Westenskow P, Charlier C, et al. KCNQ2 and KCNQ3 potassium channel genes in benign familial neonatal convulsions: expansion of the functional and mutation spectrum. Brain,2003,126(Pt 12):2726-2737
[18]Soldovieri MV, Boutry-Kryza N, Milh M, et al. Novel KCNQ2 and KCNQ3 mutations in a large cohort of families with benign neonatal epilepsy: first evidence for an altered channel regulation by syntaxin-1A. Human Mut, 2014,35(3):356-367
[19]Wickenden AD, Yu W, Zou A, et al. Retigabine, a novel anti-convulsant, enhances activation of KCNQ2/Q3 potassium channels. Mol Pharmacol, 2000,58(3):591-600
[20]Kato M, Saitoh S, Kamei A, et al. A longer polyalanine expansion mutation in the ARX gene causes early infantile epileptic encephalopathy with suppression-burst pattern (Ohtahara syndrome). Am J Hum Genet, 2007,81(2):361-366
[21]Deprez L, Jansen A, De Jonghe P. Genetics of epilepsy syndromes starting in the first year of life. Neurology,2009,72(3):273-281
[22]Sanchez RM,Jensen FE. Maturational aspects of epilepsy mechanisms and consequences for the immature brain. Epilepsia, 2001, 42 (5): 577-585
[23]Shellhaas RA,Clancy RR. Characterization of neonatal seizures by conventional EEG and single-channel EEG. Clin Neurophysiol, 2007, 118 (10): 2156-2161
[24]Rennie JM,Chorley G,Boylan GB, et al. Non-expert use of the cerebral function monitor for neonatal seizure detection. Arch Dis Child Fetal Neonatal Ed, 2004, 89 (1): F37-40
[25]Shellhaas RA. Continuous long-term electroencephalography: The gold standard for neonatal seizure diagnosis. Semin Fetal Neonatal Med, 2015
[26]Barnette AR,Horbar JD,Soll RF, et al. Neuroimaging in the evaluation of neonatal encephalopathy. Pediatrics, 2014, 133 (6): 1508-1517
[27]Weckhuysen S,Ivanovic V,Hendrickx R, et al. Extending the KCNQ2 encephalopathy spectrum: clinical and neuroimaging findings in 17 patients. Neurology, 2013, 81(19): 1697-1703
[28]Weeke LC,Van Rooij LG,Toet MC, et al. Neuroimaging in neonatal seizures. Epileptic Disord, 2015
[29]Ramantani G,Maillard LG,Bast T, et al. Epilepsy in Aicardi-Goutieres syndrome. Eur J Paediatr Neurol, 2014, 18 (1): 30-37
[30]Hallberg B,Blennow M. Investigations for neonatal seizures. Semin Fetal Neonatal Med, 2013, 18 (4): 196-201
[31]Bernes SM,Kaplan AM. Evolution of neonatal seizures. Pediatr Clin North Am, 1994, 41 (5): 1069-1104
[32]Mizrahi EM. Acute and chronic effects of seizures in the developing brain: lessons from clinical experience. Epilepsia, 1999, 40(S1):42-50
[33]Glass HC,Kan J,Bonifacio SL, et al. Neonatal seizures: treatment practices among term and preterm infants. Pediatr Neurol, 2012, 46 (2): 111-115
[34]Evans D,Levene M. Neonatal seizures. Arch Dis Child Fetal Neonatal Ed, 1998, 78 (1): F70-75
[35]Bartha AI,Shen J,Katz KH, et al. Neonatal seizures: multicenter variability in current treatment practices. Pediatr Neurol, 2007, 37 (2): 85-90
[36]Carmo KB,Barr P. Drug treatment of neonatal seizures by neonatologists and paediatric neurologists. J Paediatr Child Health, 2005, 41 (7): 313-316
[37]Gilman JT,Gal P,Duchowny MS, et al. Rapid sequential phenobarbital treatment of neonatal seizures. Pediatrics, 1989, 83 (5): 674-678
[38]Boylan GB,Rennie JM,Chorley G, et al. Second-line anticonvulsant treatment of neonatal seizures: a video-EEG monitoring study. Neurology, 2004, 62 (3): 486-488
[39]Boylan GB,Rennie JM,Pressler RM, et al. Phenobarbitone, neonatal seizures, and video-EEG. Arch Dis Child Fetal Neonatal Ed, 2002, 86 (3): F165-170
[40]Sarkar S,Barks JD,Bapuraj JR, et al. Does phenobarbital improve the effectiveness of therapeutic hypothermia in infants with hypoxic-ischemic encephalopathy? J Perinatol, 2012, 32 (1): 15-20
[41]Granelli SL,McGrath JM. Neonatal seizures: diagnosis, pharmacologic interventions, and outcomes. J Perinat Neonatal Nurs, 2004, 18 (3): 275-287
[42]Kriel RL,Cifuentes RF. Fosphenytoin in infants of extremely low birth weight. Pediatr Neurol, 2001, 24 (3): 219-221
[43]Fischer JH,Patel TV,Fischer PA. Fosphenytoin: clinical pharmacokinetics and comparative advantages in the acute treatment of seizures. Clin Pharmacokinet, 2003, 42 (1): 33-58
[44]Andre M,Boutroy MJ,Dubruc C, et al. Clonazepam pharmacokinetics and therapeutic efficacy in neonatal seizures. Eur J Clin Pharmacol, 1986, 30 (5): 585-589
[45]Castro Conde JR,Hernandez Borges AA,Domenech Martinez E, et al. Midazolam in neonatal seizures with no response to phenobarbital. Neurology, 2005, 64 (5): 876-879
[46]Sirsi D,Nangia S,LaMothe J, et al. Successful management of refractory neonatal seizures with midazolam. J Child Neurol, 2008, 23 (6): 706-709
[47]Tulloch JK,Carr RR,Ensom MH. A systematic review of the pharmacokinetics of antiepileptic drugs in neonates with refractory seizures. J Pediatr Pharmacol Ther, 2012, 17 (1): 31-44
[48]Malingre MM,Van Rooij LG,Rademaker CM, et al. Development of an optimal lidocaine infusion strategy for neonatal seizures. Eur J Pediatr, 2006, 165 (9): 598-604
[49]Kim J,Kondratyev A,Gale K. Antiepileptic drug-induced neuronal cell death in the immature brain: effects of carbamazepine, topiramate, and levetiracetam as monotherapy versus polytherapy. J Pharmacol Exp Ther, 2007, 323 (1): 165-173
[50]Forcelli PA,Janssen MJ,Vicini S, et al. Neonatal exposure to antiepileptic drugs disrupts striatal synaptic development. Ann Neurol, 2012, 72 (3): 363-372
[51]Stettner M,Dehmel T,Mausberg AK, et al. Levetiracetam exhibits protective properties on rat Schwann cells in vitro. J Peripher Nerv Syst, 2011, 16 (3): 250-260
[52]Loiacono G,Masci M,Zaccara G, et al. The treatment of neonatal seizures: focus on Levetiracetam. J Matern Fetal Neonatal Med, 2014, 1-6
[53]Patsalos PN. Clinical pharmacokinetics of levetiracetam. Clin Pharmacokinet, 2004, 43 (11): 707-724
[54]Merhar SL,Schibler KR,Sherwin CM, et al. Pharmacokinetics of levetiracetam in neonates with seizures. J Pediatr, 2011, 159 (1): 152-154
[55]Sharpe CM,Capparelli EV,Mower A, et al. A seven-day study of the pharmacokinetics of intravenous levetiracetam in neonates: marked changes in pharmacokinetics occur during the first week of life. Pediatr Res, 2012, 72 (1): 43-49
[56]Shorvon SD,Lowenthal A,Janz D, et al. Multicenter double-blind, randomized, placebo-controlled trial of levetiracetam as add-on therapy in patients with refractory partial seizures. European Levetiracetam Study Group. Epilepsia, 2000, 41 (9): 1179-1186
[57]Glauser TA,Ayala R,Elterman RD, et al. Double-blind placebo-controlled trial of adjunctive levetiracetam in pediatric partial seizures. Neurology, 2006, 66 (11): 1654-1660
[58]Shoemaker MT,Rotenberg JS. Levetiracetam for the treatment of neonatal seizures. J Child Neurol, 2007, 22 (1): 95-98
[59]Grosso S,Franzoni E,Coppola G, et al. Efficacy and safety of levetiracetam: an add-on trial in children with refractory epilepsy. Seizure, 2005, 14 (4): 248-253
[60]Ward A,Heel RC. Bumetanide. A review of its pharmacodynamic and pharmacokinetic properties and therapeutic use. Drugs, 1984, 28 (5): 426-464
[61]Dzhala VI,Talos DM,Sdrulla DA, et al. NKCC1 transporter facilitates seizures in the developing brain. Nat Med, 2005, 11 (11): 1205-1213
[62]Dzhala VI,Brumback AC,Staley KJ. Bumetanide enhances phenobarbital efficacy in a neonatal seizure model. Ann Neurol, 2008, 63 (2): 222-235
[63]Ben-Ari Y,Khalilov I,Kahle KT, et al. The GABA excitatory/inhibitory shift in brain maturation and neurological disorders. Neuroscientist, 2012, 18 (5): 467-486
[64]Liu Y,Shangguan Y,Barks JD, et al. Bumetanide augments the neuroprotective efficacy of phenobarbital plus hypothermia in a neonatal hypoxia-ischemia model. Pediatr Res, 2012, 71 (5): 559-565
[65]Cleary RT,Sun H,Huynh T, et al. Bumetanide enhances phenobarbital efficacy in a rat model of hypoxic neonatal seizures. PLoS One, 2013, 8 (3): e57148
[66]Aranda JV,Turmen T,Sasyniuk BI. Pharmacokinetics of diuretics and methylxanthines in the neonate. Eur J Clin Pharmacol, 1980, 18 (1): 55-63
[67]Marshall JD,Wells TG,Letzig L, et al. Pharmacokinetics and pharmacodynamics of bumetanide in critically ill pediatric patients. J Clin Pharmacol, 1998, 38 (11): 994-1002
[68]Pacifici GM. Clinical pharmacology of the loop diuretics furosemide and bumetanide in neonates and infants. Paediatr Drugs, 2012, 14 (4): 233-246
[69]Lopez-Samblas AM,Adams JA,Goldberg RN, et al. The pharmacokinetics of bumetanide in the newborn infant. Biol Neonate, 1997, 72 (5): 265-272
[70]Sullivan JE,Witte MK,Yamashita TS, et al. Pharmacokinetics of bumetanide in critically ill infants. Clin Pharmacol Ther, 1996, 60 (4): 405-413
[71]Pressler RM,Boylan GB,Marlow N, et al. Bumetanide for the treatment of seizures in newborn babies with hypoxic ischaemic encephalopathy (NEMO): an open-label, dose finding, and feasibility phase 1/2 trial. Lancet Neurol, 2015
[72]Turmen T,Thom P,Louridas AT, et al. Protein binding and bilirubin displacing properties of bumetanide and furosemide. J Clin Pharmacol, 1982, 22 (11-12): 551-556
[73]Walker PC,Shankaran S. The bilirubin-displacing capacity of bumetanide in critically ill neonates. Dev Pharmacol Ther, 1988, 11 (5): 265-272
[74]Shank RP,Gardocki JF,Streeter AJ, et al. An overview of the preclinical aspects of topiramate: pharmacology, pharmacokinetics, and mechanism of action. Epilepsia, 2000, 41(S1):3-9
[75]Rakhade SN,Zhou C,Aujla PK, et al. Early alterations of AMPA receptors mediate synaptic potentiation induced by neonatal seizures. J Neurosci, 2008, 28 (32): 7979-7990
[76]Koh S,Jensen FE. Topiramate blocks perinatal hypoxia-induced seizures in rat pups. Ann Neurol, 2001, 50 (3): 366-372
[77]Zhao Q,Hu Y,Holmes GL. Effect of topiramate on cognitive function and activity level following neonatal seizures. Epilepsy Behav, 2005, 6 (4): 529-536
[78]Glier C,Dzietko M,Bittigau P, et al. Therapeutic doses of topiramate are not toxic to the developing rat brain. Exp Neurol, 2004, 187 (2): 403-409
[79]Manitpisitkul P,Shalayda K,Todd M, et al. Pharmacokinetics and safety of adjunctive topiramate in infants (1-24 months) with refractory partial-onset seizures: a randomized, multicenter, open-label phase 1 study. Epilepsia, 2013, 54 (1): 156-164
[80]Filippi L,la Marca G,Fiorini P, et al. Topiramate concentrations in neonates treated with prolonged whole body hypothermia for hypoxic ischemic encephalopathy. Epilepsia, 2009, 50 (11): 2355-2361
[81]Clark AM,Kriel RL,Leppik IE, et al. Intravenous topiramate: safety and pharmacokinetics following a single dose in patients with epilepsy or migraines taking oral topiramate. Epilepsia, 2013, 54 (6): 1106-1111
[82]Valencia I,Fons C,Kothare SV, et al. Efficacy and tolerability of topiramate in children younger than 2 years old. J Child Neurol, 2005, 20 (8): 667-669
[83]Veggiotti P,Longaretti F,Signorini S, et al. Topiramate efficacy in an infant with partial seizures refractory to conventional antiepileptic drugs. Seizure, 2004, 13 (4): 241-243
[84]Silverstein FS,Ferriero DM. Off-label use of antiepileptic drugs for the treatment of neonatal seizures. Pediatr Neurol, 2008, 39 (2): 77-79
[85]Novotny E,Renfroe B,Yardi N, et al. Randomized trial of adjunctive topiramate therapy in infants with refractory partial seizures. Neurology, 2010, 74 (9): 714-720
[86]Glass HC,Poulin C,Shevell MI. Topiramate for the treatment of neonatal seizures. Pediatr Neurol, 2011, 44 (6): 439-442
[87]Ritchie MD, de Andrade M, Kuivaniemi H. The foundation of precision medicine: integration of electronic health records with genomics through basic, clinical, and translational research. Front Genet, 2015,6:104
[88]Dalen Meurs-van der Schoor C, van Weissenbruch M, van Kempen M, et al. Severe Neonatal Epileptic Encephalopathy and KCNQ2 Mutation: Neuropathological Substrate? Front Pediatr, 2014,2:136
[89]Weckhuysen S, Ivanovic V, Hendrickx R, et al. Extending the KCNQ2 encephalopathy spectrum: clinical and neuroimaging findings in 17 patients. Neurology,2013,81(19):1697-1703
[90]Weckhuysen S, Mandelstam S, Suls A, et al. KCNQ2 encephalopathy: emerging phenotype of a neonatal epileptic encephalopathy. Ann Neurol, 2012,71(1):15-25
[91]Sadewa AH, Sasongko TH, Gunadi, `et al. Germ-line mutation of KCNQ2, p.R213W, in a Japanese family with benign familial neonatal convulsion. Pediatr Int, 2008,50(2):167-171
[92]Miceli F, Soldovieri MV, Ambrosino P, et al. Genotype-phenotype correlations in neonatal epilepsies caused by mutations in the voltage sensor of K(v)7.2 potassium channel subunits. Proc Natl Acad Sci U S A, 2013,110(11):4386-4391
(本文编辑:张崇凡)
10.3969/j.issn.1673-5501.2015.02.009
复旦大学附属儿科医院新生儿科 上海,201102
周文浩,E-mail:zwhchfu@126.com
2015-03-12
2015-04-01)
