两种左侧乳腺癌保乳术后FIF和DMPO-IMRT结合照射技术的剂量学比较
2015-05-02张怀文钟晓鸣
张怀文 刘 松 钟晓鸣
乳腺癌是女性最常见的恶性肿瘤之一,其发病率约占全身各种恶性肿瘤的7% ~10%[1]。据抗癌协会报道,近年来我国以每年3% ~4%的速度增长,已成为严重危害妇女身心健康的杀手。随着我国医疗技术和质量的不断提高,保乳手术加术后放化疗的综合疗法已成为早期乳腺癌的标准治疗手段。由于患者乳腺外形差别较大及乳腺不同部位宽度的不同,临床常用的普通两侧切线野放疗存在靶区剂量分布不均匀,心、肺等危机器官剂量偏高的问题。调强放疗在改善剂量分布及降低正常组织放疗剂量方面有明显优势,但却增加了正常组织低剂量照射区域,使得对侧肺和对侧乳腺的受照剂量略有增加。我们采用Pinnale39.6三维治疗计划系统设计FIF技术和DMPO-IMRT技术两者相结合的照射方式,从靶区剂量分布、剂量分布适形度和均匀性及心脏、肺及对侧乳腺受量等方面比较两种治疗计划优缺点,希望为早期乳腺癌保乳术后临床选择最佳治疗计划进行推广提供参考依据。现将结果报告如下。
1 资料与方法
1.1 病例选择
随机选取2010年1月至2014年12月我院放射治疗科收治的I期左侧乳腺癌保乳术后患者30例。入组标准:要求患者均已接受乳腺肿块切除术或区段切除术加同侧腋窝淋巴结清扫术,病理证实手术切缘均为阴性,且均无脉管瘤栓等高危因素,腋窝清扫均未见淋巴结转移,术后分期均为pTlNOM0;30例均为女性,年龄27~65岁,所有患者无既往心脏疾病史以及呼吸系统疾病史。术后上肢锻炼充分,满足治疗体位。放射治疗均在手术切口完全愈合、伤口内无积液情况下进行。且患者心肺功能基本正常,无放疗禁忌症。
1.2 体位固定和CT扫描
在Nucletron Simulix型模拟定位机下,患者仰卧及患侧上肢外展90°上举的治疗体位,采用Med-Tec250乳腺托架固定,充分暴露患侧乳腺,参考激光定位标记相应参考点,并在前正中线、腋中线、第一前肋水平以及乳腺皱折下2 cm等处用铅丝包绕。在自由呼吸状态下通过Philips Brilliance 64排螺旋CT行自由平静呼吸CT扫描,扫描范围为锁骨上至乳腺皱折下5 cm,以完整包括全部邻近正常组织器官如肺、心脏、肝脏、对侧乳腺等,扫描层厚取5 mm。扫描结束后将CT模拟定位图像资料通过医院专用局域网传输到Pinnacle39.6三维放射计划系统工作站。
1.3 靶体积与危及器官勾画
将传入3DTPS的乳腺癌患者的CT模拟定位图象进行三维重建。为避免人为误差,所有患者靶区及危机器官均由同一位专业放疗医师在Philips Pinnacle39.6三维放疗计划系统的医生工作站根据ICRU第50、62号报告勾画放射治疗靶区。临床靶体积CTV定义为完整乳腺组织、胸肌间淋巴结和乳房下的胸壁淋巴引流区,前界取皮肤表面下0.5 cm;计划靶体积PTV指在CTV的基础上内界、外界各外扩0.8 cm,上、下界各外扩1.2 cm,前界同 CTV,后界外扩0.5 cm,但不包括肺组织。同时定义各危险器官OARS:包括双侧肺、心脏、脊髓、对侧乳腺。
1.4 计划的设计和实施
由专业放射物理师在Philips Pinnacle39.6三维放疗计划系统的物理师工作站根据放疗医师确认后的靶区设计照射。针对每位患者分别设计两套不同角度的FIF与IMRT相结合放疗照射技术计划。采用瑞典医科达公司Precise直线加速器的6MV光子线进行计划设计。处方剂量统一设为5 000 cGy,分25次照射,每次200 cGy,每天一次,每周5次。两种计划均要求95%的PTV体积达到5 000 cGy的处方剂量;同时要求危及器官剂量限量:脊髓Dmax<3 000 cGy;患侧肺V20<25%,Dmean<1 500 cGy;对侧肺 Dmax<1 000 cGy,V5<15%;全肺 V20<20%;心脏 V30<10%,V40<5%;对侧乳腺 Dmax<1 000 cGy,Dmean<800 cGy。
FIF与DMPO-IMRT相结合技术流程如下:①将靶区PTV照射总处方剂量5 000 cGy分为两部分,其中FIF技术照射4 000 cGy,IMRT技术照射剩余1 000 cGy;即将每次照射的处方剂量200 cGy分为两部分,其中FIF技术照射160 cGy,IMRT技术照射剩余的40 cGy。②FIF技术照射4 000 cGy的剂量:按照靶区两切线方向作为FIF技术的主野入射方向,首先将常规切线野去除楔形滤过板后对靶区均匀外扩0.5 cm的边界,再将乳腺靶区靠近空气侧照射野的MLC向皮肤外侧外扩1.5 cm,保证靶区不会因呼吸运动产生漏照,同时,将靠近肺组织侧MLC内缩0.2 cm,以尽可能减小肺组织照射体积。然后按内外切线野等剂量权重进行计算。依次选择不同水平的高剂量区在内外切线野方向上设置子野。利用MLC逐级遮挡乳腺靶区中的高剂量,使子野中相应高剂量区域逐渐下降同时保证不产生新的高剂量区。相反,如果靶区中有剂量不足区域,则通过给予1~2个子野进行补量从而使乳腺靶区可以得到较为均匀的剂量分布。③方案Ⅰ中IMRT技术照射剩余1 000的剂量:分别在PTV上部及PTV下部设置1~2个与步骤②中的机架角度错开约5~10度的野,在FIF照射剂量开启的情况下,设置最小照射子野数目、最小子野面积、照射剂量和迭代次数等优化参数对剩余剂量进行优化,增加靶区剂量均匀性降低正常组织并发症。④方案Ⅱ中IMRT技术照射剩余1 000的剂量:分别设计一个水平方向和垂直方向角度射野(即0°和90°),在FIF照射剂量开启的情况下,设置最小照射子野数目、最小子野面积、照射剂量和迭代次数等优化参数对剩余剂量进行优化,增加靶区剂量均匀性降低正常组织并发症。为了缩短计划设计及患者治疗时间,两种设野方法均采用子野直接优化算法(DMPO)设计模式,设定条件为子野数目小于30、子野面积不小于8 cm2及跳数不小于8 Mu。
1.5 治疗计划的分析评估
根据DVH体积剂量直方图比较两种照射方式的靶区均匀性指数、适形度指数及相关正常组织体积剂量的差异。计划靶区的评价参数:①靶区平均剂量Dmean、最大剂量Dmax、最小剂量Dmin;②均匀性指数(HI)[2]为最大剂量与处方剂量的比值,HI反应靶区内剂量的均匀性。计算公式为HI=D5%/D95%,其中D5%、D95%分别表示5%、95%体积的靶区所接受照射的最低剂量,其值越大表明PTV内部剂量分布均匀性越差。③适形度指数(CI)[3-4]用来评价靶区与参考等剂量曲面的适形程度,计算公式为CI=(Vt,ref/Vt)×(Vt,ref/Vref),Vt,ref为 95% 的处方剂量所覆盖的计划靶体积,Vt为总的计划靶体积,Vref为95%的剂量所覆盖的所有体积,CI值为0~1,CI值越接近1,表示适形度越好。危及器官的评价参数:患侧肺:Dmean、V5、V10、V15、V20、V25、V30、V40、V50;健 侧 肺:Dmax、Dmin、Dmean、V5、V10;心脏:Dmean、V5、V10、V15、V20、V25、V30、V40、V50;健侧乳腺:Dmax、Dmin、Dmean、V5、V10;脊髓:Dmax、Dmin、Dmean。[Vx表示接受 XGy照射的体积占整个体积的比例(%)]。
1.6 统计方法
应用SPSS 17.0软件建立数据库,并对计划所得数据进行录入和分析。定量资料采用均数±标准差±s)表示。对于服从正态分布的数据,用单因素方差进行分析;而对不服从正态分布的数据,用非参数秩和检验进行分析。以P<0.05为差别有统计学意义。
2 结果
2.1 靶区内剂量分布、HI、CI的比较
方案Ⅰ和Ⅱ治疗方式的 PTV(max,min,mean)、靶区的均匀性指数(HI)和适形度指数(CI)见表1。从表1中可以看出,在满足95%等剂量曲线对靶区PTV的剂量覆盖的前提下,两种计划方式靶区的最大、最小、平均剂量以及靶区均匀性指数、适形度指数等方面差异均没有统计学意义(P>0.05)。
表1 2组治疗计划靶区剂量、适形指数和不均匀指数比较±s)
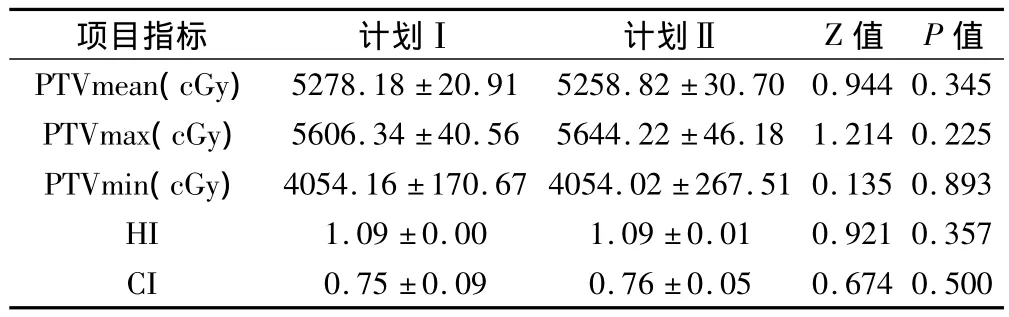
表1 2组治疗计划靶区剂量、适形指数和不均匀指数比较±s)
项目指标 计划Ⅰ 计划Ⅱ Z值 P值PTVmean(cGy)5278.18 ±20.91 5258.82 ±30.70 0.944 0.345 PTVmax(cGy) 5606.34 ±40.56 5644.22 ±46.18 1.214 0.225 PTVmin(cGy) 4054.16 ±170.67 4054.02 ±267.51 0.135 0.893 HI 1.09 ±0.00 1.09 ±0.01 0.921 0.357 CI 0.75 ±0.09 0.76 ±0.05 0.674 0.500
2.2 危及器官受照剂量和体积比较
心脏受照剂量体积对比:两组调强治疗方式心脏受到照射剂量和受照体积参数见表2。两种方式心脏接受的照射剂量仅仅在V5上可以看出计划Ⅰ心脏接受的受照体积明显小于计划Ⅱ,差异具有统计学意义(P<0.05)。而在其他方面,两者均没有明显差异,无统计学意义(P >0.05)。
左肺受照剂量体积对比:两组调强治疗方式患侧左肺接受的剂量和受照体积参数见表2。两种计划的左肺受照平均剂量Dmean、以及高剂量照射区域V40、V50等处两者之间差异无统计学意义;但在左肺接受的低剂量照射体积V5、V10、V15及中剂量照射体积V20、V25、V30计划Ⅰ明显小于计划Ⅱ,差异具有统计学意义(P<0.05)。两组计划均可以较好的满足临床上对肺组织的器官限量要求。
右肺受照剂量体积对比:两组调强治疗计划健侧右肺的剂量和受照体积参数见表2。两种计划的右肺接受的照射平均剂量 Dmean、Dmax、Dmin差异不明显,没有统计学意义(P>0.05)。但由于计划Ⅰ中调强部分仍然是以切线设野方式为主,这在一定程度上减轻了对右侧肺组织的误照射,所以在V5处右肺接受照射体积明显小于计划Ⅱ(P<0.05),因此对健侧右肺的保护中计划Ⅰ与计划Ⅱ相比具有显著优势。
右侧乳腺受照剂量体积对比:两组调强治疗计划右侧乳腺的剂量和受照体积参数见表2。在切线野布野过程中两种计划方式均优先考虑到对右侧乳腺的保护,所以两种方式右侧乳腺接受的照射剂量都非常低。两种计划的右侧乳腺接受的照射剂量D、V5等方面差异不具有统计学意义(P>0.05)。
脊髓受照剂量体积对比:两组调强治疗计划脊髓的剂量参数见表2。脊髓接收的最小剂量在两组计划间基本相当,差异无统计学意义(P>0.05);而最大剂量及平均剂量上计划Ⅱ要高于计划Ⅰ,差异具有统计学意义(P <0.05)。
表2 2组治疗计划危机器官受照剂量体积对比s,%)

表2 2组治疗计划危机器官受照剂量体积对比s,%)
器官 Ⅰ Ⅱ Z值 P值心脏Dmean 431.66 ±168.80 678.42 ±145.22 1.753 0.080 V5 23.69 ±11.05 55.87 ±16.34 2.023 0.043 V10 11.98 ±7.48 18.36 ±6.22 1.214 0.225 V15 8.07 ±6.42 6.17 ±3.14 0.405 0.686 V20 7.18 ±5.40 3.04 ±1.94 1.483 0.138 V25 5.12 ±4.97 2.36 ±1.66 1.483 0.138 V30 4.30 ±4.41 1.92 ±1.53 1.355 0.176 V40 2.76 ±3.19 0.98 ±0.89 1.214 0.225 V50 0.81 ±1.39 0.04 ±0.05 1.214 0.225患侧左肺Dmean 1036.08 ±85.31 1007.94 ±550.09 0.674 0.500 V5 35.02 ±14.11 58.24 ±9.21 2.023 0.043 V10 22.20 ±10.56 32.41 ±2.70 2.023 0.043 V15 18.21 ±9.23 25.54 ±0.98 2.023 0.043 V20 15.49 ±8.23 20.13 ±1.32 2.023 0.043 V25 13.56 ±7.41 17.12 ±1.66 2.023 0.043 V30 11.86 ±6.60 14.79 ±1.70 2.023 0.043 V40 8.35 ±4.80 10.42 ±1.31 1.753 0.080 V50 2.69 ±2.40 1.91 ±1.05 0.944 0.345健侧右肺Dmax 657.28 ±285.96 874.35 ±133.68 0.730 0.465 Dmin 5.76 ±1.23 12.60 ±1.48 1.826 0.068 Dmean 38.46 ±16.59 180.90 ±22.00 1.826 0.068 V5 0.47 ±0.66 5.08 ±3.04 2.023 0.043 V10 0.00 ±0.00 0.00 ±0.00 0.000 1.000健侧右乳Dmax 560.05 ±138.82 668.18 ±123.83 1.095 0.273 Dmin 2.13 ±0.91 12.83 ±14.77 1.461 0.144 Dmean 94.95 ±74.47 297.73 ±17.78 1.826 0.068 V5 1.62 ±3.63 5.11 ±5.98 1.096 0.273 V10 0.00 ±0.00 0.00 ±0.00 0.000 1.000脊髓Dmax 37.50 ±11.93 128.44 ±104.02 2.023 0.043 Dmin 7.96 ±4.18 13.82 ±9.87 1.753 0.080 Dmean 19.00 ±8.43 41.20 ±8.95 2.023 0.043
3 讨论
保乳术后放射治疗不但可以有效降低局部复发风险,而且可以降低远处转移率和提高生存率及生活质量[5-6]。保乳手术后的传统的照射方式为切线野对穿照射,但乳腺近似半球的不规则外形导致乳腺不同部位源皮距差别大,使得靶区内剂量分布不均,容易产生放射性皮肤、肺和心脏的损伤。如何在提高靶区剂量的同时进一步减少全乳照射副反应仍是人们关注与研究的热点问题[7-8]。
由于乳腺附着于胸壁外,活动度较大,特别是随着手臂上举程度不同位置变化很大,有研究表明最大前后方向误差为0.5 cm[9]。且实际治疗中还需考虑由呼吸运动对靶区剂量的准确性的影响[10]。本研究两种射野方式中第一阶段4 000 cGy剂量所采用的野中野技术是以3D-CRT切线野为基础的一种正向调强技术。它将常规切线野去除楔形滤过板后对靶区均匀外扩0.5 cm的边界,再将乳腺靶区靠近空气侧照射野的MLC向皮肤外侧外扩1.5cm,保证靶区不会因呼吸运动产生漏照,同时,将靠近肺组织侧MLC内缩0.2 cm,以尽可能减小肺组织照射体积。但由于其子野数目较少,不能完全消除靶区剂量均匀性差的问题。第二阶段1 000 cGy采用DIMO-IMRT技术照射通过预先设定多项物理目标函数,来满足临床对靶区剂量均匀性、靶区适形指数要求,同时进一步降低心脏、肺等正常组织受照剂量。研究表明,方案Ⅰ与Ⅱ都可以实现良好靶区的覆盖率,剂量均匀分布的临床要求。且两者在靶区内剂量分布、HI、CI的方面两者相近,差异不明显。
放射性肺损伤是乳腺癌放疗中的一个重要的并发症,主要表现为急性放射性肺炎和放射性肺纤维化[11]。其发生率与肺组织受照体积和剂量大小具有显著相关性,肺组织的V5、V10的受照体积是放射性肺炎的重要影响因素。有研究显示,当肺的 V10大于50%时,肺的并发症概率可达20%[12]。要降低放疗肺损伤的发生率就必须在控制患侧肺V20以上的受照体积的同时尽可能降低V5、V10的受照体积。在患侧肺方面,方式Ⅰ中左肺接受的低剂量照射体积V5、V10、V15及中剂量照射体积 V20、V25、V30计划Ⅰ明显小于计划Ⅱ,差异具有统计学意义。在计划设计第一阶段野中野部分,两种方式都充分考虑了射野方向对肺组织的影响,通过将靠近肺组织侧MLC内缩减少肺组织的照射。但是在第二阶段,计划Ⅰ采用的是沿原切线野偏离5~10度的布野方式,这样可以更充分提高靶区剂量的同时避免过多的肺组织被误照射。而方式二由于调强部分采用的是垂直和水平野照射,故有部分肺组织被纳入到照射野当中。而对于健侧右肺而言,受照剂量主要为叶片间的X线散射漏射导致。且因为方式Ⅰ中方法没有设置水平野从而较好的避开了右侧肺组织,因此方式Ⅰ的健侧右肺低剂量V5为0.47±0.66 明显小于方式Ⅱ的5.08 ±3.04。
放射诱发心脏病是指在放疗中心脏因照射所致损伤的一组临床和病理情况,其发生与心脏受照体积有关并存在剂量-效应关系[13]。当心脏接受的照射剂量<3 000 cGy时,放射性心脏病的发生率明显下降,并且V30占的体积越小,调强放疗引起的冠状动脉缺血症状的发生率越低。本研究中两种方式的V30没有差别,但是所占体积都非常小,两种方式都可以较好的保护心脏组织。
而对侧健康乳腺受到较小剂量照射,则是健侧乳腺癌诱发的重要因素之一。有学者等[14]研究证实健侧乳腺受到2.9到4.3 Gy的照射剂量后有可能发生健侧乳腺二重癌,主要是由于在乳腺癌放疗中相当部分体积的对侧乳腺组织将接受到较高的照射剂量所致。Di Betta等[15]研究主张采用5 Gy的低剂量作为对周边健康组织的优化辐射防护剂量。Kaufman等[16]报道乳腺癌术后放疗可能增加肺发生二重癌的风险。本研究中计划Ⅱ组对侧乳腺Dmean都明显小于5 Gy,V5较低分别仅为1.62 ±3.63、5.11 ±5.98 且两者差异不具备统计学意义,两者都可以有效的预防对侧乳腺出现第二原发癌的风险。
综上所述,从物理学角度来讲,当处方剂量为50 Gy时,与计划Ⅱ相比,计划Ⅰ在提高乳腺癌靶区剂量分布适形度和均匀性的同时可以更好的降低肺和心脏、脊髓等危及器官的照射剂量和照射体积进而减少并发症的发生率。因此,计划I是乳腺癌保乳术后FIF与DMPO-IMRT结合技术中更好的照射方式。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002〔J〕.CA Cancer JClin,2005,55(2):74-108.
[2] Zhong-Hua Ning,Jin-Ming Mu,Jian-Xue Jin,et al.Single arc volumetric-modulated arc therapy is sufficient for nasopharyngeal carcinoma:a dosimetric comparison with dual arc VMAT and dynamic MLC and step-and-shoot intensitymodulated radiotherapy〔J〕.Radiother Oncol,2013,8(1):237-246.
[3] 张怀文,邓益杰,丁生苟,等.左侧乳腺癌根治术后两种常用放疗计划剂量学比较〔J〕.中华肿瘤防治杂志,2015,22(12):964-968.
[4] 张怀文,丁生苟,胡海芹,等.直肠癌术后3种5野调强放疗计划比较〔J〕.广东医学,2013,34(1):103-105.
[5] Early Breast Cancer Trialists'Collaborative Group(EBCTCG),Darby S,McGale P,et al.Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death:meta-analysis of individual patient data for 10801 women in 17 randomised trials〔J〕.Lancet,2011,378(9804):1707-1716.
[6] Lewin AA,Derhagopian R,Saigal K,et al.Accelerated partial breast irradiation is safe and effective using intensitymodulated radiation therapy in selected early-stage breast cancer〔J〕.Int J Radiat Oncol Biol Phys,2012,82(5):2104-2110.
[7] 姚 晖,邱健健,王 芸,等.乳腺癌保乳术后部分乳腺三种放疗计划的剂量学比较〔J〕.中华放射医学与防护杂志,2014,34(5):358-361.
[8] 洪 卫,冉 立,卢 冰,等.乳腺癌改良根治术后放疗降低患侧肺受量的剂量学研究〔J〕.中华放射医学与防护杂志,2011,31(6):684-687.
[9] 赵于飞,张红雁,程 勇,等.乳腺癌保留乳房术后应用图像引导放射治疗效果探讨〔J〕.蚌埠医学院学报,2012,37(1):20-24.
[10] 王 玮,李建彬,王素贞,等.基于4D-CT测定的保乳术后全乳调强放疗靶区位移的相关性研究〔J〕.中华肿瘤放射防护杂志,2011,31(6):664-667.
[11] 李胜业,戴安伟,费明来,等.左侧乳腺癌保乳术后调强放疗与三维适形放疗的剂量学比较〔J〕.实用癌症杂志,2012,27(5):524-526.
[12] Yorke ED,Jackson A,Rosenzweig KE,et al.Correlation of dosimctric factors and radiation pneumonitis for non small cell lung cancer patients in a recently completed dose escalation study〔J〕.Int J Radiat Oncol Biol Phys,2005,63(3):672-682.
[13] Taylor CW,McGale P,Povall JM,et al.Estimating cardiac exposure from breast cancer radiotherapy in clinical practice〔J〕.Int JRadiatOncol Biol Phys,2009,3(4):1061-1068.
[14] X Fisher,SG,Emami,B.Risk of second primary cancer in the contra lateral breast in women treated for early-stage breast cancer:A population-based study〔J〕.Int J Radiat Oncol Biol Phys,2003,56(4):1038-1045.
[15] Di Betta E,Fariwlli L,Bergantin A,et al.Evaluation of the peripheral dose in stereotactic radiotherapy and radio-surgery treatments〔J〕.Med Phys,2010,37(7):3587-3594.
[16] Kaufman EL,Jacobson JS,Hershman DL,et al.Effect of breast cancer radiotherapy and cigarette smoking on risk of second primary lung cancer〔J〕.J Clin Oncol,2008,26(3):392-398.
