高效液相色谱法测定藤茶中二氢杨梅素和杨梅素含量
2015-05-02陈图锋高文华
陈图锋,高文华*,唐 敏
(1.汕头大学 分析测试中心,广东 汕头 515063;2.汕头大学 化学系,广东 汕头 515063)
高效液相色谱法测定藤茶中二氢杨梅素和杨梅素含量
陈图锋1,2,高文华1,2*,唐 敏2
(1.汕头大学 分析测试中心,广东 汕头 515063;2.汕头大学 化学系,广东 汕头 515063)
目的:建立以高效液相色谱法同时测定藤茶中二氢杨梅素和杨梅素含量的方法。方法:采用高效液相色谱法。色谱柱为SUPELCO Discovery C18HPLC Column (25cm×4.6mm,5μm);流动相为甲醇-0.03%磷酸溶液,采用梯度洗脱,流速为0.8mL·min-1,杨梅素和二氢杨梅素检测波长分别为373nm和290nm。结果:藤茶中二氢杨梅素和杨梅素分别在0.15~94.0mg·L-1(R2=1)和0.62~77.50mg · L-1(R2=0.999 7)浓度范围内有良好线性关系;平均加标回收率分别为89.7%、93.5%,RSD<4.5%。结论:该法简便、快速、准确,可用于藤茶的质量标准研究及其质量控制。
藤茶;二氢杨梅素;杨梅素;高效液相色谱法;含量测定
藤茶(Ampelopsisgrossedentata)又名山甜茶、眉茶、白茶、龙须茶、溪黄草等,属于葡萄科蛇葡萄属中的显齿蛇葡萄,是一种野生藤本植物[1]。研究表明,黄酮类化合物是藤茶的主要活性成分[2-3],含量高达38%以上,其中二氢杨梅素与杨梅素含量最高[4]。二氢杨梅素具有清除自由基、抗氧化、抗血栓、抗肿瘤、降低血脂和血糖水平,提高SOD活性等特殊功效[5]。杨梅素具有抗肿瘤、降低神经毒性、降血糖、保肝护肝、抗突变、预防龋齿等多种药理活性[6-7]。
目前文献报道对于藤茶的质量监控仅以测定二氢杨梅素含量为主,主要有HPLC[8]和紫外-可见分光光度法[9]。紫外-可见分光光度法适于大类成分的含量测定,如总黄酮、总蒽醌、总生物碱等。本试验采用HPLC-DAD双波长同时检测二氢杨梅素和杨梅素含量,以期为藤茶质量标准的建立和进一步开发利用提供科学依据。
1 材料与方法
1.1 仪器
Agilent1100高效液相色谱仪,G1315B DAD检测器,ChemStation for LC 3D Rev.A.10.01[1635]工作站,METTLER TOLEDO AL204电子天平,Millipore Milli-Q50 纯水器,上海科导超声仪器SK2200HP超声波水浴,上海大普仪器PHS-3CA型精密酸度计。
1.2 试剂
甲醇(TEDIA);乙醇(国药集团化学试剂有限公司);丙酮(广东西陇化工);石油醚(30~60℃)(国药集团化学试剂有限公司);乙酸(广州试剂三厂);磷酸(国药集团化学试剂有限公司);藤茶样品(恩施绿神(中港合资)生物制品有限公司);杨梅素对照品(阿拉丁,批号:21487);二氢杨梅素对照品(中国医学科学研究院药物研究所);甲醇为色谱纯,其它试剂均为分析纯。
1.3 色谱条件
色谱柱:SUPELCO Discovery C18HPLC Column (25cm×4.6mm,5μm);流动相:甲醇-0.03%磷酸,梯度洗脱(0min,甲醇-0.03%磷酸比例为12∶88,25min比例为65∶35;30~40min,比例为12∶88);流速:0.8 mL·min-1;柱温:35 ℃;波长:二氢杨梅素(290nm)、杨梅素(373nm);进样量:5μL。在上述色谱条件下进行测定,二氢杨梅素和杨梅素的色谱见图1。
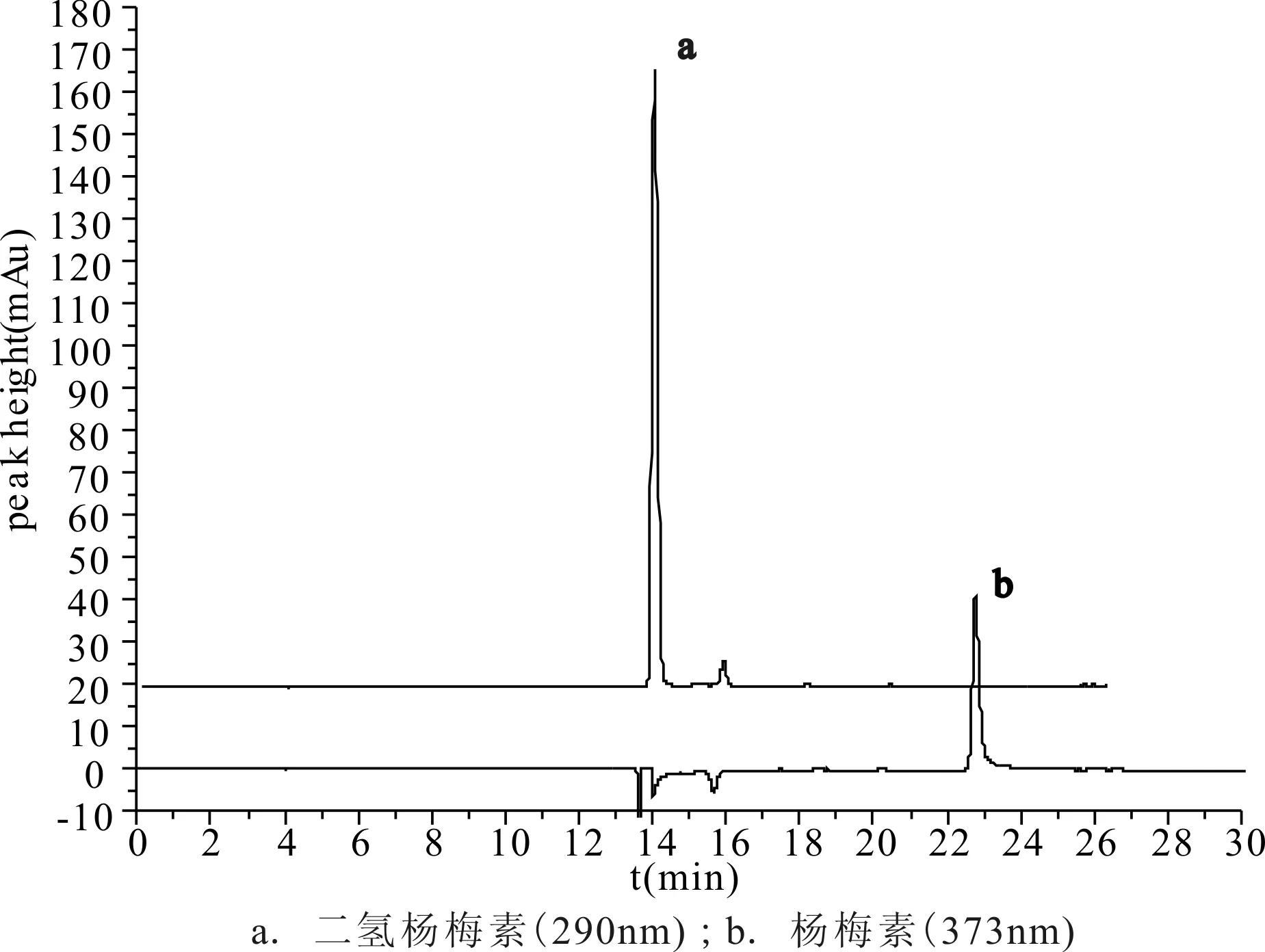
图1 二氢杨梅素、杨梅素对照品色谱
1.4 标准溶液的配制
精确称取杨梅素1.55mg,二氢杨梅素1.88mg,分别置于10mL容量瓶中,甲醇定容至刻度,杨梅素标准母液浓度为155mg· L-1,二氢杨梅素标准母液浓度为188mg·L-1,待用。
分别量取上述配制好的杨梅素标准母液和二氢杨梅素标准母液各5mL,置于10mL容量瓶中,甲醇定容至刻度。得杨梅素77.5mg· L-1、二氢杨梅素94mg·L-1的混合标准母液,待用。
1.5 样品处理
1.5.1 杨梅素待测液 取样品藤茶,精确称量0.500g,置于10mL容量瓶中,用甲醇定容至刻度。超声提取30min,过0.45μm的滤膜过滤,此为杨梅素待测液。
1.5.2 二氢杨梅素待测液 取0.5mL“1.5.1”项中制备的杨梅素待测液于50mL容量瓶中,用甲醇稀释至刻度,过0.45μm的滤膜过滤,此为二氢杨梅素待测液(由于藤茶中二氢杨梅素含量较高,所以需要稀释)。藤茶样品色谱见图2。
2 结果与讨论
2.1 样品处理条件的选择
称取0.5g的藤茶样品,置于10mL容量瓶中,分别比较了甲醇、乙醇、石油醚、丙酮等提取溶剂,结果表明,以甲醇作为提取溶剂,超声提取时间为30min,可获得良好的提取效果。
2.2 色谱条件的优化和选择
2.2.1 最适波长选择 对二氢杨梅素峰和杨梅素峰在200~400nm波长范围内进行紫外扫描。结果表明二氢杨梅素在205nm和290nm 处吸收值高,而杨梅素在208nm和373nm 处吸收值高,考虑到在205nm和208nm处样品的干扰较大,因此选择290nm作为二氢杨梅素的检测波长,373nm作为杨梅素的检测波长。
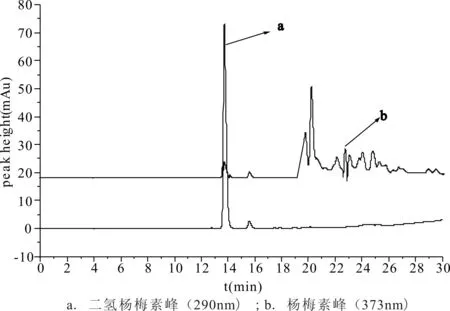
图2 藤茶样品色谱
2.2.2 流动相的选择 杨梅素和二氢杨梅素在不同pH值下具有不同的稳定性[10-11],当pH≥9.0时二氢杨梅素会因处于碱性环境而发生自动氧化作用,生成了其它成分;杨梅素在碱性条件下稳定性极差。所以本实验选用乙酸-甲醇和磷酸-甲醇作为流动相,并对pH=2.0、2.5、3.3、4.4、5.5、6.4时的谱图进行比较。结果表明采用甲醇-0.03%磷酸,0.03%磷酸pH值为2.5较好。
2.3 标准曲线及相关系数
根据“1.4”项中配制好的混合标准母液浓度,逐级稀释配制成杨梅素、二氢杨梅素浓度为(77.5mg· L-1,94.0mg·L-1) (15.5mg·L-1,18.8mg·L-1),(3.1mg·L-1,3.76mg·L-1),(0.62mg·L-1,0.752mg·L-1),(0.124mg·L-1,0.150 4mg·L-1)的混合标准溶液,依次从低浓度到高浓度,按“1.3”项色谱条件进行测定,每一浓度连续测定3次,以峰面积平均值Y为纵坐标,浓度X为横坐标,绘制标准曲线,得杨梅素回归方程:Y=14.104X -10.055(R2=0.999 7),二氢杨梅素回归方程:Y=15.27X +0.991 4(R2=1),表明杨梅素在0.62~77.50mg·L-1、二氢杨梅素在0.15~94.00mg·L-1范围内具有良好线性关系。
2.4 最低检出限
2.4.1 杨梅素最低检出限 取杨梅素浓度为0.62mg·L-1的混合标准溶液3mL于5mL容量瓶中,按“1.3”项中色谱条件进行测定,测得信噪比为3时,杨梅素最低检出限为20mg·kg-1。
2.4.2 二氢杨梅素最低检出限 取二氢杨梅素浓度为0.15mg·L-1混合标准溶液,按“1.3”项中色谱条件进行测定,测得信噪比为3时,二氢杨梅素的最低检出限为240mg· kg-1。
2.5 回收率试验
向空白样品中加入3种浓度的混合标准溶液,按照前述处理方法进行实验,每个水平重复测定3次,得到其回收率,见表 1。

表1 加标回收率测定结果
实验表明,高、中、低浓度的加标回收率均在88.00%以上,RSD<4.5%,符合要求。
2.6 精密度试验
取“2.3”项中杨梅素、二氢杨梅素分别为(15.5mg·L-1,18.8mg·L-1)的标准混合溶液进行精密度检测,按照上述色谱条件连续进样10次,测得峰面积。分别得到杨梅素和二氢杨梅素的相对标准偏差RSD为2.93%、1.17%,符合要求。
2.7 藤茶中杨梅素和二氢杨梅素含量的测定
采用本方法对藤茶样品进行检测,最终测得杨梅素含量为6.73mg·g-1,二氢杨梅素含量为135.2mg·g-1。
3 结论
藤茶中杨梅素和二氢杨梅素分别在0.62~77.50mg·L-1和0.15~94.00mg·L-1浓度范围内有良好的线性关系;平均加样回收率分别为93.5%、89.7%,RSD<4.5%。结果表明该方法操作简便、快速、准确,可为藤茶质量标准的建立和进一步开发利用提供科学依据。
[1] 中国科学院植物研究所.中国高等植物图鉴补编(第二册)[M].北京:科学出版社,1979:353.
[2] 李刚,郑作文.藤茶总黄酮含药血清对2215细胞分泌乙肝病毒HBsAg和HBeAg的影响研究[J].中国药房,2008,19(18):1366.
[3] 李刚,郑作文,唐云丽.藤茶总黄酮体外抗人肝癌细胞作用研究[J].中国药房,2008,19(9):652.
[4] 覃沽萍,许学键,李剑江.广西瑶族藤茶化学成分的研究[J].天然产物研究与开发,1997,9(4):41.
[5] 杨学敏,陈立峰.二氢杨梅素的生物活性研究进展[J].中医药报,2008,14(12):86-89.
[6] 张秀娟,黄清玲,季宇彬.杨梅素的药理活性研究进展[J].天津药学,2008,20(5):57-60.
[7] 臧宝霞,金鸣,吴伟,等.杨梅素对血小板活化因子拮抗的作用[J].药学学报,2003,38(11):831-833.
[8] 何桂霞,裴刚,杨伟丽,等.HPLC测定藤茶不同采收时期及不同部位的二氢杨酶素含量[J].中成药,2004,26(3):210-212
[9] 陈绩光,王玫馨,蔡沛祥,等.无刺根中蛇葡萄素和杨梅素的含量测定[J].中药材,1997,20(1):23-24.
[10] 何桂霞,裴刚,李斌,等.二氢杨梅素的稳定性研究[J].中国新药杂志,2007,16(22):1888-1890.
[11] 王志江.杨梅素的稳定性研究[J].广东微量元素科学,2008,15(10):37-40.
(责任编辑:宋勇刚)
Content Determination of Dihydromyricetin and Myricetin in Leaves ofAmpelopsisGrossedentataby HPLC
Chen Tufeng1,Gao Wenhua1,2*,Tang Min2
(1.Analysis & Testing Center,Shantou University,Guangdong 515063, China; 2.Department of Chemistry, Shantou University, Guangdong 515063, China )
Objective:To develop a method for the content determination of dihydromyricetin(DMY) and myricetin(MY)in leaves ofAmpelopsisgrossedentata.Methods:HPLC method was adopted.The separation was performed on SUPELCO Discovery C18 (25cm×4.6mm,5μm)column with 0.03% phorsphoric acid-methanol as mobile phase at flow rate of 0.8 mL·min-1.The detection wavelength of MY was set at 373 nm,and that of DMY was set at 290 nm. Results:The linear range was 0.15~94mg·L-1(R2=1)for DMY and 0.62~77.50mg·L-1(R2=0.999 7) for MY with average recovery of 89.7% and 93.5%,RSD<4.5%. Conclusion:The method is simple,fast,accurate aprovide the basis for the quality standard of leaves ofA.grossedentata.
Leaves ofAmpelopsisgrossedentata;Dihydromyricetin;Myricetin;HPLC;Content Determination
2014-08-20
广东省自然科学基金资助项目(S2011010005208);广东省教育厅科技创新项目(2013KJCX0078)
陈图锋(1978-),男,广东省汕头大学分析测试中心助理工程师,研究方向为分析化学。
高文华(1968-),男,博士,广东省汕头大学教授,研究方向为分析化学。E-mail: whgao@stu.edu.cn
R284.1
A
1673-2197(2015)01-0028-02
10.11954/ytctyy.201501014
