植物源血管紧张素转换酶抑制剂的研究进展
2015-04-29蒋丹等
蒋丹等

摘要血管紧张素转换酶抑制剂(Angiotensin converting enzyme inhibitors,ACEI)通过肾素-血管紧张素系统(RAS)和激肽释放酶-肽酶系统(KKS),抑制血管紧张素II的生成,减少缓激肽的降解,从而达到降血压的目的;植物来源的天然化合物具有来源广泛、结构多样、特异性高、毒性低等特点,因而从植物中筛选安全有效的ACEI成为研究热点。在此综述了血管紧张素转换酶(ACE)的活性测定方法以及植物来源的不同结构类型的ACEI研究进展。
关键词ACE活性测定;ACEI;植物源化合物
中图分类号R282.71文献标识码A文章编号0517-6611(2015)29-023-04
截止至2013年5月,我国高血压患者人数已突破3.3亿,每3名成人中有1人患高血压,其常见并发症是脑卒中、心脏病及肾病,严重影响我国人民健康。高血压治疗目标是通过降压治疗使患者的血压达标(即血压<140/90 mmHg),最大限度地降低心血管发病和死亡危险。血管紧张素转换酶抑制剂(Angiotensin converting enzyme inhibitors,ACEI)是常用的降压药,治疗高血压的效果是明确的,尤其对高血压伴充血性心力衰竭、心肌梗死后、左心功能不全、糖尿病肾病、蛋白尿者有益。一系列大规模随机对照临床试验结果表明,长期应用ACEI治疗高血压,可明显降低脑卒中及心血管事件的发生率。目前,开发和应用ACEI作为降压药备受关注。ACEI的主要来源是化学合成、蛋白水解肽和植物提取物。合成法制备的ACE抑制剂成药较早,且发展很快,药效强劲,降压效果明显,但此类药副作用明显,常见有低血压症、肾功能损害、高血钾症、咳嗽、血管神经性水肿、皮疹、味觉障碍等。天然来源的ACEI具有结构多样、来源广泛、毒性较低等特点,笔者在此对ACE活性的测定方法及ACEI的结构类型进行综述,为高效低毒植物来源ACEI开发提供理论基础。
1ACE活性测定方法
1.1体外活性检测
目前对体外血管紧张素转化酶的活性测定方法有分光光度法、高效液相色谱法(HPLC)、荧光法和毛细管电泳法(CE)等。
1.1.1分光光度法測定。
1971年,Cushman等建立了紫外分光光度法测定ACE抑制剂的活性。分光光度法测酶活是以马尿酰-组氨酰-亮氨酸(HHL)或马尿酰-甘氨酰-甘氨酸(HGG)为底物,底物被ACE分解产生马尿酸和二肽,根据测定的马尿酸或二肽的含量结合所得马尿酸标准曲线推算出ACE活力[11-12]。1981年Hurst等建立了动力学方法检测血清ACE活力,ACE催化底物HHL裂解,释放出的马尿酸与呈色剂在383 nm处有吸收,根据吸光度A求出ACE活力。骆琳等[14]建立了高通量ACE活性测定的96孔板法,该方法以呋喃丙烯酰三肽(FAPGG)为模拟底物,通过340 nm处吸光值的下降衡量ACE的活性,最多可同时检测96个样品,上机分析时间仅需10 s,且该方法重性好、精密度高。采用分光光度法测酶活性具有设备简单、价格低廉且重复性好的特点,是目前普遍采用的方法。
1.1.2高效液相色谱法。
高效液相色谱法可将底物HHL或HGG与产物马尿酸完全分离,通过测定马尿酸的生成量来评价ACE活性并计算抑制率。Wu等用C18色谱柱、梯度洗脱的方法成功分离了ACE的反应产物与底物,建立了ACE酶活测定方法。洪韫嘉等以含0.1%甲酸和0.1%三乙胺的乙睛-水(22∶78,V/V)为流动相进行等度洗脱,在8 min内完成了分析检测,缩短了分析时间,该方法可用于ACEI的快速筛选。苑园园等用乙睛-水(20∶80,V/V,含0.5‰甲酸)为流动相,流速1 ml/min,检测波长为228 nm,柱温35 ℃,在7 min内即可实现底物和产物的完全分离,分析速度快、操作简便。采用高效液相色谱法测定ACE酶活,相比分光光度法具有灵敏度高、重现性好、准确度高、分析时间短等特点,但缺点是需要大型设备。
1.1.3荧光检测法。
荧光检测法用修饰后的酶底物作为荧光探针,通过检测催化作用前后底物的荧光信号变化来判断,该方法适用于成分复杂的反应体系中,酶活较低时就可以充分利用荧光法高度灵敏的优势。ACE水解产物的组氨酰部分在碱性条件下与邻苯二甲醛反应生成荧光物,潘曦等用荧光光度法检测该荧光物,从而测得ACE活性。荧光检测法灵敏度高,酶活较低时可采用此方法,但该方法设备投入较高而限制了其应用。
1.1.4毛细管电泳法。
毛细管电泳法是以弹性石英毛细管为分离通道,以高压直流电场为驱动力,依据样品中各组分之间淌度和分配行为上的差异而实现分离的电泳分离分析方法。目前,用于ACE活性检测的方法和毛细管区带电泳法和毛细管胶束电动色谱法(MECC)。
Zhang 等采用毛细管区带电泳法测定了ACE的体外活性,建立了分析ACE活性的新方法,但未将生成物His-Leu和底物His-His-Leu完全分离。而高效毛细管电泳测定法解决了毛细管区带电泳生成物分不开的缺点,用50 mmol/L pH 8.3 磷酸缓冲液(含1%的SDS)将HHL和HL完全分离,7 min即可完成分析过程。
徐小华等建立了MECC法快速测定ACE活性的方法,通过对电压的分析、上样时间的选择、电极缓冲体系的调整,最后确定了电压8.1 kV、上样时间1 s、缓冲体系为pH 90 20 mmol/L 硼酸盐缓冲液(含50 mmol/L SDS)时,分离效果最好。刘阳等用与徐小华等类似的条件,分析了人血清中血管紧张素转换酶的活性,该法缓冲液是20 mmol/L pH 9.0 硼酸-硼酸盐缓冲液(含50 mmol/L的SDS),压力进样3 s、电压16 kV、电泳时间7.5 min,5 min内即实现了HHL与马尿酸的分离。刘猛等在临床试验中采用了刘阳等的方法,测定受试患者血清ACE活性。毛细管电泳法具有分离速度快、分离效果高、重现性好、样品用量少的优点;但价格相对比较昂贵,且操作要求高、难度大,限制了该方法的使用推广。
1.1.5酶偶联法。
金化民等提出了用酶偶联法测定血管紧张素转化酶的方法,前步反应与Cushman等法一致,以Hip-Gly-Gly为底物,生成Hip和双甘肽Gly-Gly,加入L-γ-谷氨酰-3-羧基-4-硝基苯胺(GGCN)和γ-谷氨酰基转移酶(GGT),催化GGCN与Gly-Gly偶联,产生的3-羧基-4-硝基苯胺于410 nm检测,此方法操作简便、重复性好,适用于手工操作。
1.2体内活性检测
研究表明,体外检测活性很高的ACEI,体内检测却不一定有抑制活性。这是因为经过消化道内酶的分解后,一些具有活性的物质可能会被降解而失去活性,因此体内检测是评价ACEI功效的一个必要手段。
动物试验是评价降血压物质效果的有效方法。用ACEI检测的动物试验可分两类,一类是以原发性高血压大鼠为试验对象,通过口服和静脉注射不同剂量的ACEI来测定动脉收缩压的大小,并与对照组进行比较;另一类是对己经麻醉的大鼠通过静脉注射六甲铵,再给其注射ACEI,通过与对照组进行比较,研究ACE抑制剂的活性。
体内检测持续时间长、成本高,使其广泛应用受到限制,对于ACEI的开发来说,一般是先利用体外检测方法进行高通量、低成本、快速准确的筛选,再通过体内检测方法实现产品的工业化。
2植物来源的ACEI
近年来,从植物中筛选药效高、毒性小的ACEI备受关注,研究者陆续发现植物中多酚、黄酮、生物碱等化学成分能抑制ACE活性,可能成为有效的降血压药物。
2.1多酚类
多酚是多元酚类化合物,广泛地存于各种蔬菜、水果和天然药用植物中,具有抗氧化、抗肿瘤、降血脂、美容减肥等多种功效,并对多种酶的抑制作用。
丹参是益气活血和治疗心脑血管疾病的常用中药,其有效成分主要是脂溶性的丹参酮和水溶研究了酸枣仁、何首乌、绞股蓝、金银花等8味中药对ACE的抑制作用,并对ACE抑制率最高(87.3%)的金银花提取物进行了分离,发现其主要成分是绿原酸,但对纯的绿原酸是否具有ACE抑制活性未进行验证。王艺璇等研究了不同品种、成熟度的苹果多酚对ACE活性的影响,发现未成熟的苹果多酚含量高,ACE抑制活性更强。
2.2黄酮类
黄酮类化合物是具有2-苯基色原酮结构的一类化合物,其羟基化合物以游离和糖苷的形式广泛分布于植物界,具有抗氧化、抗病毒、降血糖、降血脂等药理作用。
朱福等研究发现醋柳总酮黄酮(TFH)及其单体槲皮素(Que)、异鼠李素(Isor)对培养的兔主动脉平滑肌细胞(ASMC)ACE活性及血管紧张素Ⅱ(AngⅡ)生成有显著持久的抑制作用,且持续时间较卡托普利明显延长,对血浆ACE活性及AngⅡ 生成也有短暂抑制作用,这可能是其降压及保护心血管的重要机制之一。刘发等研究了红花(Carthamus tinctorius L.)中的红花黄素的降压作用,发现红花黄素对自发性高血压大鼠具有明显的降压作用,其作用可能是通过抑制肾素-血管紧张素系统实现的。Ovaskainen等分析指出原花青素低聚体对ACE活性有很强的抑制作用,其中尤以二聚体和六聚体作用最为显著。Lacaille-Dubois等通过体外筛选的方法研究原伞木、天蚕蛾物种和锐刺山楂中的不同组分和化合物对ACE的抑制作用,发现黄酮和原花青素在0.33 mg/ml的浓度下具有显著的ACE抑制活性。
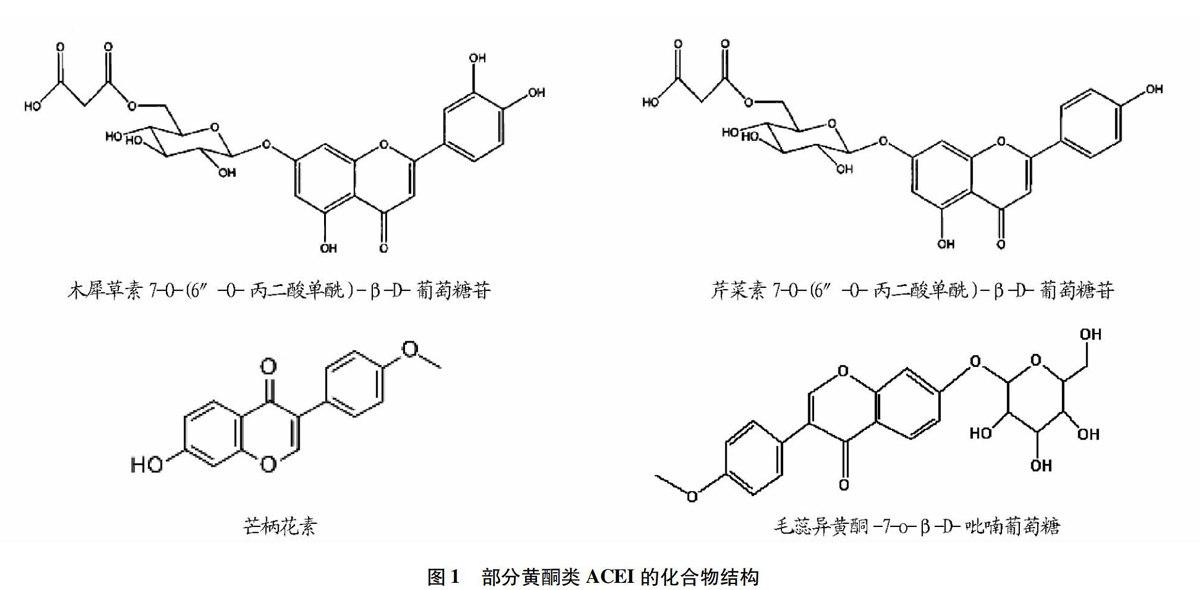
近年来,研究者陆续发现了多种黄酮类化合物对ACE有抑制作用,黄酮类ACE抑制剂如表1所示,部分黄酮类化合物的结构如图1所示。
43卷29期蒋 丹等植物源血管紧张素转换酶抑制剂的研究进展
2.3生物碱
生物碱是科学家研究最早的一类生物活性天然产物,它指的是具有碱性和显著生物活性的含氮有机化合物。钩藤碱是茜草科植物钩藤的主要成分,具有降低血压力、抗心律失常等作用,临床用于治疗高血压、支气管哮喘、癫痫等疾病。王珺颖从平贝母中分离得到3个甾类生物碱(去氢贝母碱、贝母碱和贝母素)均对ACE有抑制活性,测得这3个化合物的IC50分别为165.0、312.8、526.5 μmol/L,这是甾类生物碱对ACE具有抑制作用的首次报道。龙吉美
等在研究钩藤碱对阿霉素诱导的大鼠肾损伤的作用机制过程中发现,钩藤碱能增强超氧化物歧化酶活性,调控血管
紧张素受体,血管紧张素转换酶和血管紧张素原mRNA的表达。李运伦研究还发现钩藤碱和异钩藤碱能够抑制血管紧张素Ⅱ介导的血管平滑肌增殖,因此可能对防治高血压血管重塑具有积极的意义。
2.4萜类
萜类化合物是广泛存在于自然界的天然烃类化合物,由异戊二烯分子聚合衍生而生,具有祛痰、止咳、驱风、发汗、驱虫、镇痛等功效。灵芝三萜是灵芝中的重要活性成分,具抗肿瘤、抗病毒、抑制血管紧张素转换酶、抗氧化等活性。另外,栀子总环烯醚萜苷、樟芝三萜等均能够抑制ACE的活性,是潜在的降血压药物。
2.5其他
近来年,很多学者均致力于植物源ACEI的研究和开发,李小多等比较了32种中药对ACE的抑制作用,并对抑制作用最强的枸杞进一步分离,得到2种化合物,一种东莨菪糖苷类物质,另一种是莨菪亭,其中东莨菪糖苷类物质对ACE的抑制率达96.67%。 Tsai等用不同溶剂提取荞麦的不同部位,发现普通荞麦壳的50%乙醇提取部分有较强的ACE抑制活性,但没有对抑制ACE活性成分进行进一步分离。
3展望
近年國内外学者对植物源ACEI进行了大量研究,筛选出种类繁多、抑制性强的ACEI,从植物中分离ACE抑制剂主要集中在活性药物种类和活性部位的筛选,但其中的构效关系与作用机理尚不明确,且很多植物中的活性成分含量较低,难以大量分离提取。因此,在寻找具有ACEI活性的植物资源、获得新型ACEI的同时,应明确其作用机理。同时,可通过计算机模拟技术筛选更高效无毒的抑制剂,或利用生物化学方法对先导化合物进行改造以获得更稳定高效的ACEI成为今后研究的方向。
参考文献
[1] 周婷玉.我国高血压患者人数逾3.3亿 3个成人中有1个[EB/OL].(2013-05-05)[2015-05-25].http://news.xinhuanet.com/health/2013-05/05/c_124664261.htm
[2] PEDROCHE J,YUST M M,GIRON C J,et al.Utilisation of chickpea protein isolates for production of peptides with angiotensin I-converting enzyme(ACE)-inhibitory activity[J].Journal of the science of food and agriculture,2002,82(9):960-965.
[3] 田清青,曾伟秀,赵昕,等.溶剂诱导相变萃取-分光光度法测定血管紧张素转化酶活性[J].高等学校化学学报,2012,33(11):2417-2421.
[4] 刘华欣,曹立春,张晓刚.血管紧张素转化酶的分光光度法测定及临床意义[J].吉林医学院学报,1998,18(3):87-88.
[5] 高玲,喻雄文,姚真荣,等.血管紧张素转移酶紫外分光光度法的方法学评价[J].热带医学杂志,2011,11(1):87-89.
[6] 吴伟伟,于伟,江国永,等.高效液相色谱法测定蛋白肽对血管紧张素转化酶的抑制活性[J].饲料与畜牧,2011(8):53-56.
[7] 洪韫嘉,肖晓峰,陈波,等.用HPLC法从中药中筛选血管紧张素转化酶抑制剂[J].天然产物研究与开发,2008,20(4):728-730,755.
[8] 邢艳珑,毛相朝,王舒,等.应用荧光分析法检测酶的研究进展[J].生物工程学报,2009,25(12):1765-1769.
[9] 辛志宏,马海乐,吴守一.高效毛细管电泳测定血管紧张素转化酶抑制剂captopril的活性[J].药学学报,2003,38(11):834-845.
[10] ZHANG R,XU X,CHEN T,et al.An assay for angiotensin-converting enzyme using capillary zone electrophoresis[J].Anal Biochem,2000,280(2):286 -290.
[11] CUSHMAN D W,CHEUNG H S.Spectrophotometric assay and properties of the angiotensin-I-converting enzyme of rabbit lung[J].Biochem Pharmacol,1971,20:1637-1648.
[12] 苑园园,于宏伟,田益玲,等. 酶法制备牡蛎ACE抑制肽的条件优化[J]. 中国食品学报,2013(3):115-121.
[13] HURST P L,LOVELL-SMITH C J.Optimi zed assay for serum an-giotensin-convertin g enz yme acti vity[J].Clin Chem,1981, 27(12):2048-2052.
[14] 骆琳,丁青芝,马海乐.96孔板法用于高通量血管紧张素转化酶抑制剂体外检测[J].分析化学,2012(1):129-134.
[15] WU J P,ALUKO R E,MUIR A D.Improved method for direct high-performance liquid chromatography assay of angiotensin-converting enzyme-catalyzed reactions[J].J Chromatogr A,2002,950:125-130.
[16] 苑园园,崔同,苏旭东,等.高效液相色谱法快速检测血管紧张素转换酶抑制活性[J].食品科学,2012(22):196-199.
[17] 邢艳珑,毛相朝,王舒,等.应用荧光分析法檢测酶的研究进展[J].生物工程学报,2009,25(12):1765-1769.
[18] 潘曦,查艳.荧光光度法测定血管紧张素转换酶[J].贵阳医学院学报,1998,23(1):82-83.
[19] 徐小华,张蓉真,盛思梅,等.毛细管胶束电动色谱法测定血管紧张素转化酶的活性[J].色谱,2001,19(1):68-70.
[20] 刘阳,张颖冬,葛剑青.毛细管电泳测定人血清中血管紧张素转换酶活性[J].中华检验医学杂志,2004(8):20-22.
[21] 刘猛,张颖冬,赵康仁,等.血管紧张素转换酶及其基因多态性与血管性痴呆和阿尔茨海默病的关系研究[J].中国实用内科杂志,2007(13):1028-1030.
[22] 金化民,张茨,陈葳,等.酶偶联法测定血清血管紧张素转化酶[J].中华医学检验杂志,1998(21):362-365.
[23] 沈要林,朱志伟,曾庆孝.血管紧张素转化酶抑制剂抑制率的测定方法[J].食品科技,2007(3):212-216.
[24] 许金光,杨智超,刘长江,等.血管紧张素转化酶抑制肽的研究进展[J].食品工业科技,2011,32(5):425.
[25] 王洋,陈涛,潘霖,等.液质联用技术在丹参成分分析中的应用[J].中草药,2014(23):3494-3502.
[26] 高小平,徐大勇,邓义龙,等.从丹参中筛选血管紧张素转换酶抑制剂[J].中国中药杂志,2004(4):75-78.
[27] 曹晓钢,于刚,叶小利,等.中药提取物及活性部位抑制血管紧张素转化酶活性的研究[J].食品与药品,2009(1):20-23.
[28] 王艺璇,王世平,马丽艳.苹果多酚提取物对血管紧张素转化酶活性的抑制[J].中国农学通报,2012(6):257-261.
[29] 李丹,彭成,谢晓芳.黄酮类化合物治疗糖尿病及其并发症的研究进展[J].中国实验方剂学杂志,2014(11):239-242.
[30] 朱福,章茂顺,王家良,等.醋柳总黄酮对兔血管紧张素转换酶的抑制作用[J].中国临床药学杂志,2000,9(2):95-98.
[31] 刘发,魏苑,杨新中,等.红花黄素对高血压大鼠的降压作用及对肾素-血管紧张素的影响[J].药学学报,1992(10):785-787.
[32] OVASKAINEN M L,TORRONEN R,KOPONER J,et al.Procyanidinstructure Defines the extent and property of angiotensin I converting enzyme inhibition[J].Biochimie,2006,88(3/4):359-365.
[33] LACAILLEDUBOIS M A,FRANCK U,WAGNER H.Search for potential Angiotensin Converting Enzyme(ACE)-inhibitors from plants[J].Phytomedicine,2001,8:47-52.
[34] 宋瑞霞,余静,杨丽丽,等.甘肃黄芪毛蕊异黄酮对血管内皮细胞ACE,ACE2表达的影响[J].中国药学杂志,2008(8):594-597.
[35] 张因皎,赵钰岚,邹文韬,等.HPLC法测定不同产地杭白菊中3种抑制血管紧张素转化酶活性的黄酮化合物含量[J].药物分析杂志,2010(3):456-459.
[36] 张爱莲,戚华溢,叶其,等.爵床的化学成分研究(英文)[J].应用与环境生物学报,2006(2):170-175.
[37] 凌冰,张兰兰,哈木拉提,等.金鸡菊黄酮对高血压小鼠的血压和肾素-血管紧张素系统的影响[J].中药药理与临床,2013(2):80-83.
[38] 李秀麗,宋瑞霞,余静,等.四种黄芪黄酮类化合物单体对血管内皮细胞功能的保护作用[J].兰州大学学报(医学版),2011(4):1-5,9.
[39] 王珺颖.平贝母中抑制血管紧张素转换酶的生物碱[J].国外医药(植物药分册),2004(5):208.
[40] 龙吉美,黄德彬,李魁武,等.钩藤碱对阿霉素诱导的大鼠肾损伤的作用及其机制[J].中国病理生理杂志,2012(10):1887-1891.
[41] 李运伦.钩藤碱和异钩藤碱抑制血管紧张素Ⅱ诱导血管平滑肌细胞增殖及相关机制[J].中国药理学通报,2008,24(1):53-58.
[42] 付立忠,吴学谦,李明焱,等.灵芝品种子实体多糖和三萜含量分析与评价[J].中国食用菌,2009(4):38-40.
[43] 李晔,朱忠敏,姚渭溪,等.灵芝三萜类化合物的研究进展[J].中国中药杂志,2012(2):165-171.
[44] 卢金凤,向靓,黄薇,等.栀子总环烯醚萜苷对脑出血大鼠内皮屏障的影响[J].中药药理与临床,2012(3):48-51.
[45] SONG T Y,YEN G C.Protective effects of fermented filtrate from Antrodiacamphorata in submerged culture against CCl4-induced hepatic toxicity in rats[J].J Agric Food Chem,2003,51(6):1571-1577.
[46] LIU D Z,LIANG Y C,LIN S Y,et al.Antihypertensive activities of solid-state culture of Taiwanofungus camphoratus(Chang-chih)in spontaneously hypertensive rats[J].Biosci Biotechnol Biochem,2007,71(1):23-30.
[47] 李小多,李学刚,张波,等.抑制血管紧张素转化酶的中药及活性成分的研究[J].食品工业科技,2013(1):49-52.
[48] TSAI H,DENG H,TSAI S,et al.Bioactivity comparison of extracts from various parts of common and tartary buckwheats:evaluation of the antioxidant-and angiotensin-converting enzyme inhibitory activities[J].Chemistry central journal 2012,6:78-82.
