饮用水有机提取物对大鼠氧化应激及免疫功能的影响*
2015-04-28桂晓玲岑延利杨光红敖云霞王士然
桂晓玲,岑延利,杨光红*,敖云霞,李 骞,王士然
(贵州医科大学 公共卫生学院,贵州 贵阳 550004)
目前我国水环境污染状况不容乐观。由于工业废水、生活污水的大量排放及饮用水氯化消毒副产物的生成,使饮用水有机物污染成为了重要的公共卫生问题。水体中的有机物分布广泛,具有毒性大、难降解、生物富集等特点,能够通过长期积累达到危害人类及其他生物的水平,主要干扰神经系统、免疫系统、生殖系统功能等,有的还能在组织内部改变和破坏细胞的DNA 结构,产生致癌作用[1]。课题组的前期调查发现,某地饮用水存在有机物污染,居民存在不孕不育、消化系统慢性病相对高发等健康问题[2]。课题组萃取当地饮用水有机污染物,复制动物模型后证实该地饮用水有机污染物具有致突变性和雄性生殖毒性[3-4]。本实验将在课题组既往研究基础上,从氧化应激和免疫功能的角度研究当地饮用水有机污染物对机体的损害,为当地饮用水卫生学评价及肝脏毒性影响提供实验依据。
1 材料与方法
1.1 主要实验试剂与仪器 免疫球蛋白(IgM、IgG、IgA)试剂盒与补体(C3、C4)试剂盒(中生北控生物科技股份有限公司),超氧化物歧化酶(Superoxide Dismutase,SOD)测试盒、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)测试盒、丙二醛(Malond-ialdehyde,MDA)测试盒(南京建成生物工程有限公司)。二氯甲烷、甲醇(色谱纯,美国TEDIA 公司),XAD-2 大孔树脂(粒度60-80 目,美国TEDIA 公司),玉米油(美国Sigma 公司)。主要实验仪器有RE-3000 型旋转蒸发仪(上海亚荣生化仪器有限公司),SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸公司),SC-1 型离心机(美国KOCOUR 公司),AR1530/C 电子天平(美国奥斯豪公司),721 分光光度计(山东高密彩虹分析仪器有限公司),AU400 型全自动生化分析仪(日本奥林巴斯公司),酶标仪(美国Thermo 公司)。
1.2 水样采集及有机物提取 于2012 年7 ~9 月(丰水期)采集G 市某地管网末梢水水样20 000 L,利用固相萃取法提取水样中有机污染物[5]。将挥干浓缩后的有机提取物用玉米油定容至50 L/mL(每1 mL 溶液中含有50 L 水的有机提取物),于4℃冰箱保存,备用。
1.3 动物模型制备 清洁级(Sprague Dawley)SD大鼠40 只,雌雄各半,体质量80 ~100 g,由中国人民解放军第三军医大学提供,合格证号SCXK(渝)2012-0003。染毒前适应性饲养1 周,清洁级动物房相对湿度50%-70%,温度(23±2)oC。40 只SD 大鼠按随机区组法分为对照组、高中低剂量组4 组,每组10 只,雌雄各半。对照组给予玉米油、其余低中高剂量组根据参考文献[6]分别给予5、20 及80 L/kg 进行灌胃染毒,灌胃体积为10 mL/kg,1 次/d,每周染毒5 d,连续12 周。最后一次染毒结束后,用0.9%戊巴比妥钠麻醉大鼠,采集股动脉血与肝脏,制备血清及肝匀浆,于-80℃冰箱保存备用。
1.4 抗氧化酶、氧化产物、免疫球蛋白及补体检测取已制备的血清和肝匀浆。采用黄嘌呤氧化酶法测定血清与肝匀浆中SOD 活性。采用微量酶标法测定血清及肝匀浆中GSH-Px 的活性。采用硫代巴比妥酸(TBA)法测定血清及肝匀浆MDA 的含量。采用透射比浊法检测血清免疫球蛋白(IgM、IgG、IgA)与补体(C3、C4)的含量。
1.5 统计学方法 采用SPSS 17.0 软件进行数据分析。实验数据以均数±标准差表示,组间比较采用单因素方差分析(one-way ANOVA),组间两两比较用LSD 检验或Games-Howell 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 大鼠血清及肝组织SOD、GSH-Px 活力及MDA 含量 与对照组相比,血清SOD 活力在低剂量组明显升高、高剂量组明显降低,GSH-Px 活力在高剂量组明显下降,MDA 含量在中、高剂量组均明显升高;肝组织SOD 活力仅在高剂量组降低,GSH-Px 活力则在中、高剂量组都显著降低,MDA含量在中、高剂量组均明显升高,差异有统计学意义(P <0.05)。见表1。
表1 大鼠血清及肝组织SOD、GSH-Px 活力及MDA 含量(n=10Tab.1 The enzyme activities of SOD,GSH-Px in rat serum and liver tissues exposed to organic extracts from drinking water(n=10)
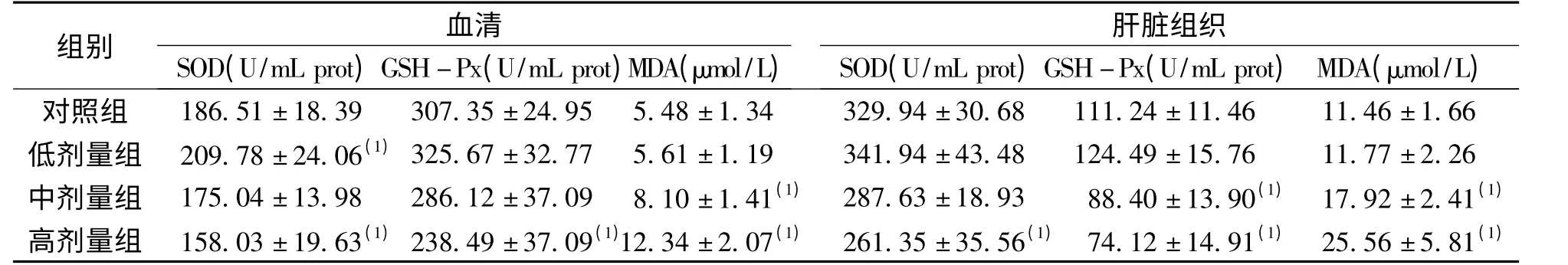
表1 大鼠血清及肝组织SOD、GSH-Px 活力及MDA 含量(n=10Tab.1 The enzyme activities of SOD,GSH-Px in rat serum and liver tissues exposed to organic extracts from drinking water(n=10)
(1)同类型样本对照组比较,P <0.05
组别SOD(U/mL prot)GSH-血Px清(U/mL prot)MDA(μmol/L)SOD(U/mL prot)GSH-肝Px脏(U组/m织L prot)MDA(μmol/L)对照组 186.51±18.39 307.35±24.95 5.48±1.34 329.94±30.68 111.24±11.46 11.46±1.66低剂量组 209.78±24.06(1)325.67±32.77 5.61±1.19 341.94±43.48 124.49±15.76 11.77±2.26中剂量组 175.04±13.98 286.12±37.09 8.10±1.41(1) 287.63±18.93 88.40±13.90(1) 17.92±2.41(1)高剂量组 158.03±19.63(1)238.49±37.09(1)12.34±2.07(1) 261.35±35.56(1) 74.12±14.91(1) 25.56±5.81(1)
2.2 大鼠免疫功能 随着染毒剂量的增加,中、高剂量组的IgM 含量较对照组明显升高,差异有统计学意义(P <0.05);IgA、IgG、C3及C4则无明显改变,差异无统计学意义(P >0.05)。见表2。
表2 饮用水有机提取物对大鼠免疫功能的影响(n=10Tab.2 The effect of organic extracts from drinking water on rat immune function

表2 饮用水有机提取物对大鼠免疫功能的影响(n=10Tab.2 The effect of organic extracts from drinking water on rat immune function
(1)同指标对照组比较,P <0.05
组别 n IgA免疫球蛋I白gG(×10-3)IgM C3补体(×10-3)C4对照组 10 0.22±0.13 1.30±2.60 10.40±4.20 47.00±7.00 7.60±2.00低剂量组 10 0.23±0.18 2.00±1.00 10.00±4.00 54.30±10.00 7.80±2.00中剂量组 10 0.24±0.19 1.80±0.70 86.00±5.00(1) 54.90±9.60 9.00±3.30高剂量组 10 0.28±0.13 1.70±0.60 103.80±2.90(1)59.10±3.30 9.40±3.90
3 讨论
有研究认为,在饮用水有机污染物的肝毒性机制研究中,脂质过氧化作用可能发挥了重要作用[7]。正常生理状态下,机体产生自由基与清除自由基的能力处于动态平衡状态,当机体自由基产生过多时,机体的抗氧化酶可清除多余的自由基,以保证细胞内环境的稳定,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害,其主要的抗氧化酶有SOD、GSH-Px 等。MDA 是脂质过氧化的产物,反映了脂质过氧化的程度。因此,联合测定SOD、GSH-Px 及MDA 可以反映外源化学物对机体氧化系统的损害程度。本实验发现,低剂量饮用水有机物接触均可诱导SOD 及GSH-Px 活力升高,而中、高剂量接触则可抑制肝组织及血清的SOD、GSH-Px 活力。其原因可能为肝细胞受到自由基攻击后,作为一种自身保护性机制,肝脏内抗氧化酶活性代偿性增加;但随着染毒剂量的增大,产生的自由基过多,消耗大量抗氧化酶,致SOD、GSH-Px 含量减少,活性降低。因此,中、高剂量组MDA 相应升高(P <0.05)。提示该地饮用水有机污染物随接触剂量增加,可抑制大鼠肝脏抗氧化酶的活性、削弱其阻断脂质过氧化链锁反应的能力,从而导致大鼠肝脏的氧化损伤加剧。这可能是该地饮用水有机污染物致肝脏毒性的重要机制之一。这与罗皓等[8]的氯化饮水有机提取物对HepG2 细胞具有明显的脂质过氧化作用相一致。本研究还发现,同一染毒剂量组中,血清中抗氧化酶活性及氧化产物水平与肝组织中各指标的变化趋势一致,提示血清学氧化应激指标可在今后饮用水有机污染物暴露人群肝脏氧化损伤的动态监测中进行应用。
血清免疫球蛋白IgG、IgA、IgM 是体液免疫的分子基础,行使特异性免疫功能。其中IgG 是生物体液内最主要的免疫球蛋白[9],由于IgG 较其他类球蛋白更易扩散到血管外的间隙内,因而在结合补体、增强免疫细胞吞噬病原微生物和中和细菌毒素的能力方面,具有重要作用,能有效地抗感染,这是对机体有利的一面,但某些自身免疫病,如自身免疫性溶血性贫血、血小板减少性紫癜、红斑狼疮以及类风湿的自身抗体都是IgG,一旦它与相应的自身细胞结合,反而加强了组织损伤作用。IgA 在血清中的含量仅次于IgG,按其免疫功能又分为血清型及分泌型两种,血清型IgA 虽有IgG 和IgM 的某些功能,但在血清中并不显示重要的免疫功能。IgM 在免疫球蛋白中分子量最大,通常称为巨球蛋白,IgM 是初次体液免疫应答中最早出现的抗体,是机体抗感染抗损伤的“先头部队”;血清中检出IgM 提示新近发生感染或出现新的损伤,可用于感染或新发损伤的早期诊断[10]。除此之外,IgG、IgA、IgM 还可激活补体(C3、C4)传统途径,参与机体的非特异性免疫[11]。本研究将饮用水有机提取物亚慢性染毒SD 大鼠后,发现中、高剂量组IgM 含量明显升高(P <0.05);IgA、IgG、C3及C4各染毒组与对照组比较,差异均无统计学意义(P >0.05),表明该地饮用水有机提取物作为外源性抗原进入大鼠机体后,大鼠即启动免疫应答,IgM 抗体含量明显升高。提示该地饮用水有机提取物主要诱导机体免疫系统的初次免疫应答增强,而对机体的再次免疫应答及非特异性免疫无明显诱导作用。
饮用水有机污染物暴露导致的氧化损伤、免疫应答异常可能成为消化系统疾病相对高发的重要原因之一。但由于本实验为动物实验,尚需进一步的进行人群流行病学调查进行支撑。
[1]沈成文,齐国艳,周慧民.工业废水等有机污染物污染水源所致危害分析[J].中国实用医药,2010(28):264-265.
[2]王士然,杨光红,张爱华,等.G 市某地水源水和管网末梢水水质检测分析[J].贵阳医学院学报,2014(2):187-190.
[3]徐文零,杨光红,王士然,等.G 市某区管网末梢水有机污染物对大鼠精子形态的影响[J].贵阳医学院学报,2013(2):134-137.
[4]杨光红,王士然,张爱华,等.G 市某区管网末梢水中有机提取物对雄性大鼠生殖激素分泌水平的影响[J].环境与职业医学,2013(5):342-345.
[5]曹贤文,杜海荣,张荣,等.不同预处理消毒饮用水中非挥发性有机提取物对HepG2 细胞的损伤作用[J].环境与职业医学,2010(4):198-202.
[6]李骞,敖云霞,杨光红,等.饮用水有机提取物致大鼠肝脏DNA 及蛋白质氧化损伤的研究[J].现代预防医学,2014(22):4138-4140.
[7]聂木海,张全新,朱伟,等.饮用水有机提取物对大鼠脂质过氧化影响[J].现代预防医学,2008(8):1551-1553.
[8]罗皓,杨慧,陈佳佳,等.饮水消毒副产物DCN 对HepG2 细胞的脂质过氧化作用[J].实用预防医学,2015(2):162-164.
[9]张时超,黄爱全,侯娅慧,等.IgG 在人肝细胞肝癌中的表达及其临床意义[J].中国医学创新,2014(18):23-26.
[10]宋秦伟,朱汝南,邓洁,等.血清特异性抗体检测在儿童呼吸道病毒感染病原诊断中应用的探讨[J].中华儿科杂志,2012(6):440-444.
[11]廖吕燕,马玉芳,李健,等.“芪苓”制剂多糖对环磷酰胺免疫损伤小鼠肠道菌群的影响[C].中国畜牧兽医学会2010 学术年会暨第二届中国兽医临床大会,2010.
