高磷、高钙诱导人血管平滑肌细胞钙化的研究
2015-04-28傅碧玲邹世海翁俊雄邓柳霞
傅碧玲,邹世海,彭 鑫,翁俊雄,邓柳霞
(深圳市宝安区人民医院 肾脏内科,广东 深圳 518101)
终末期肾脏病(end stage renal disease,ESRD)患者首位死亡原因是心血管疾病(cardiovascular disease,CVD)。心血管事件的增加与患者普遍存在血管钙化尤其是冠脉血管钙化或心瓣膜钙化相关,而血管的钙化又与高磷血症、钙磷代谢紊乱密切相关,高达83%慢性肾脏病(chronic kidney disease,CKD)5 期患者有不同程度的血管钙化,71%的CKD 患者存在明显的颈动脉和股动脉钙化斑块。血磷浓度每升高0.3 229 mmol/L,患者血管钙化风险上升61%,心血管事件发生率增加31%,心血管死亡风险增加50%[1]。高磷是矿物质代谢紊乱的核心[2],并认为血磷干预优先于甲状旁腺激素(PTH)。目前对于高钙、高磷导致血管钙化的机制尚未完全明确,如何进行有效干预,措施亦有限[3]。故本研究将人血管平滑肌细胞在体外模拟高钙、高磷条件下培养,观察成骨细胞标志物及原有平滑肌细胞标志物表达有无变化,探讨高钙、高磷与血管平滑肌细胞表型转分化、钙化的关系及分子机制,并用阻断剂进行干预,为钙磷代谢紊乱的治疗提供新理论依据和靶点。
1 材料与方法
1.1 材料
无内毒素人血清白蛋白(HSA)购自Sigma 公司(美国),高糖DMEM 培养基购买自Hyclone 公司(法国),胰蛋白酶(Trypsin)购自Amresco 公司(美国),胎牛血清购自中国杭州四季青公司,鼠抗α-SMA 抗体、鼠抗山羊Cbfα1 多克隆抗体、鼠抗骨钙素抗体购自中杉金桥生物技术有限公司,RTPCR 试剂盒购自TaKaRa 公司(日本),ZVAD-FMK购自Tocris Cookson 公司,其它试剂为国产分析纯。
1.2 人脐动脉平滑肌细胞的培养
采用植块贴壁法获取人原代脐血管平滑肌细胞。无菌条件下获取健康胎儿脐带约20 cm,置于无菌DMEM 培养液中,于分娩后2 h 内送至细胞培养室。用无菌PBS 反复冲洗脐带至冲净为止,用眼科镊尽量去除血管外膜的结缔组织,再剪开血管,冲洗血管壁数次,用湿棉签轻轻刮除血管内皮,将处理好的中膜放入另一无菌小烧杯中。用眼科剪将中膜剪成约0.5 ~1 mm3大小的小块,接种于25 mL 塑料培养瓶中,加入4 mL 含20%胎牛血清的DMEM 培养液,37 ℃,95% 空气-5% CO2培养。0.25%胰蛋白酶消化、传代,传代后用含10%胎牛血清的DMEM 培养液培养。采用形态学及免疫组化a-SMA 染色方法进行平滑肌细胞鉴定。实验用第5 ~10 代细胞。
1.3 实验分组
将细胞以105/孔接种于6 孔细胞培养板中,细胞长至80%融合时更换细胞培养基分组培养。以CaCl2,NaH2PO4调节培养液中钙(Ca)、磷(P)浓度,分为以下4 组:对照组(1.4 mmol/L P,2.0 mmol/L Ca);高磷组(2.0 mmol/L P;2.0 mmol/L Ca);高钙组(1.4 mmol/L P;2.8 mmol/L Ca);高磷+高钙组(2.0 mmol/L P;2.8 mmol/L Ca)。以换用培养液当天定义为第0 天,培养至第12 天,隔天换液。
1.4 人血管平滑肌细胞核心结合因子α1(Cbfα1)、骨钙素、α-平滑肌肌动蛋白(α-SMA)蛋白质的表达
收集各组第12 天细胞,裂解后取上清液,测定蛋白浓度,取30 μg 细胞总蛋白配成等体积等量,于沸水中煮5 min,10% SDS-聚丙烯酰胺电泳分离,电转移蛋白至硝酸纤维素膜膜上,5%无脂奶粉封闭,一抗孵育杂交过夜,分别为α-SMA 单克隆抗体(1∶1 000)、Cbfα1 多克隆抗体(1∶500)、骨钙素多克隆抗体(1∶500),洗膜后在过氧化物酶标记的抗鼠IgG 中孵育1 h,最后用化学发光法以X 线片自显影显示结果。图像经BioRad 公司的图像分析软件Quantity One 对特异性条带进行灰度扫描分析,求得各组蛋白电泳条带灰度与内参GAPDH 的比值,反映为Cbfα1、骨钙素、α-SMA 表达含量变化,从而对目的蛋白进行半定量比较。实验重复3次。
1.5 Cbfα1、骨钙素、α-SMA mRNA 的表达
收集各组细胞,提取细胞总RNA,以RT-PCR法得到扩增产物,PCR 产物电泳及分析:凝胶在UVP 凝胶成像系统中扫描观察结果、拍照,分析电泳带灰度,计算Cbfα1、骨钙素、α-SMA mRNA 特异性扩增带灰度与内参GAPDH 扩增带灰度之比值,即为Cbfα1、骨钙素、α-SMA mRNA 相对表达量。实验重复3 次。
1.6 ZAVD-FMK 对高磷培养的人脐动脉平滑肌细胞钙化的干预
将细胞以105/孔接种于6 孔细胞培养板中,细胞长至80%融合时更换细胞培养基分组培养。以CaCl2,NaH2PO4调节培养液中钙(Ca)、磷(P)浓度,分为以下3 组:对照组为正常钙、磷组(1.4 mmol/L P,2.0 mmol/L Ca);高磷高钙组(2.0 mmol/L P;2.8 mmol/L Ca);高磷高钙+ZAVD-FMK 组(2.0 mmol/L P;2.8 mmol/L Ca;10 μmol/L ZAVD-FMK)。收集各组第12 天细胞,按照1.4 项下方法检测Cbfα1、骨钙素蛋白质的表达。
1.7 统计学处理
所有数据均代表3 次以上重复实验的结果,计量资料以均数±标准差)表示,采用SPSS 13.5 统计软件分析,组间比较采用单因素方差分析(One-Way ANOVA),P <0.05 为具有统计学意义。
2 结果
2.1 血管平滑肌细胞的鉴定
血管植块贴壁培养7 d 左右,有少许平滑肌细胞开始从植块周边迁出;第14 天时,植块周围形成明显的平滑肌细胞生长晕,并围绕植块边缘呈束状向外放射延伸,细胞呈长梭形,胞质丰富,均质透明,可隐约看到细丝。细胞有较多的突起,核卵圆居中,可见1 ~2 个核仁。经过3 ~4 周培养,植块的生长晕不断扩大,彼此融合,细胞密集呈束状放射状排列,形成典型的“峰、谷”样生长特征。免疫组化α-SMA 染色显示细胞胞浆内α-SMA 表达丰富,呈细丝状沿细胞纵轴排列。95%细胞α-SMA表达为阳性,纯度符合试验要求。
2.2 Cbfα1、骨钙素、α-SMA 表达
与对照组相比,高钙组、高磷组、高磷+高钙组中Cbfα1、骨钙素蛋白的表达均明显增加(P <0.05),其中,高磷+高钙组Cbfα1 的表达为对照组的(3.46±0.44)倍,骨钙素的表达为对照组的(2.92±0.38)倍;与对照组相比,高钙组、高磷组、高磷+高钙组α-SMA 的表达均明显减低(P <0.05),其中高磷+高钙组α-SMA 表达较对照组降低(59.61±4.98)%。见图1。
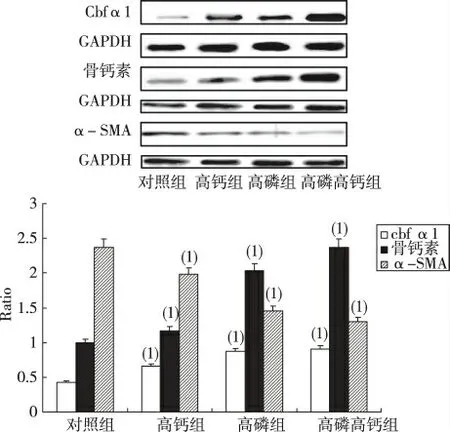
图1 人平滑肌细胞Cbfα1、骨钙素、α-SMA蛋白表达(Western blot,第12 天)Fig.1 The protein expression of Cbfα1,osteocalcin and α-SMA of VSMCs on 12th day
2.3 Cbfα1、骨钙素、α-SMA mRNA 表达
与对照组相比,高钙组、高磷组、高钙+高磷组Cbfα1、骨钙素mRNA 的表达均显增加(P <0.05),其中,高钙+高磷组Cbfα1 的表达为对照组的(2.12±0.78)倍,骨钙素的表达为对照组的(2.37±0.65)倍;与对照组相比,高钙组、高磷组、高钙+高磷组α-SMA 的表达均明显减低(P <0.05),其中高钙+高磷组α-SMA 表达较对照组降低(45.12±3.22)%。见图2。
2.4 ZAVD-FMK 干预高磷+高钙培养条件下VSMCs Cbfα1、骨钙素蛋白的表达
与对照组相比,高磷+高钙组Cbfα1、骨钙素的表达均显增加(P <0.05);与高磷+高钙组相比,使用ZAVD-FMK 干预后,Cbfα1 表达降低(33.06±4.12)%,骨钙素的表达降低(35.92±3.38)%。见图3。
3 讨论
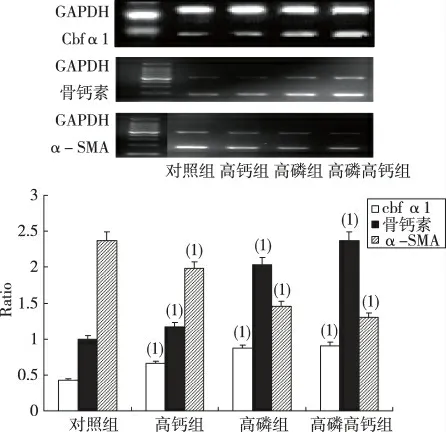
图2 平滑肌细胞Cbfα1、骨钙素、α-SMA mRNA表达(Western blot,第12 天)Fig.2 The mRNA expression of Cbfα1,osteocalcin and α-SMA of VSMCs on 12th day
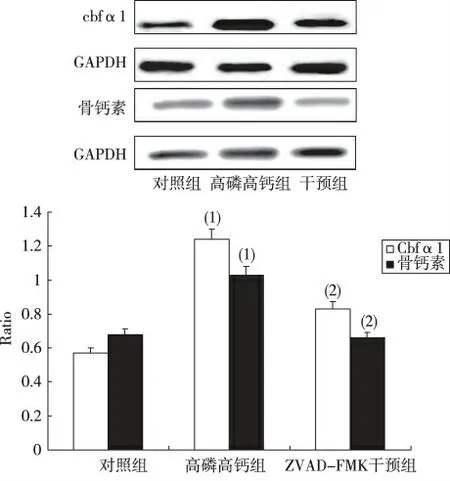
图3 ZVAD-FMK 干预时人平滑肌细胞中Cbfα1、骨钙素蛋白质表达影响(Western blot,第12 天)Fig.3 The protein expression of Cbfα1,osteocalcin and α-SMA of VSMCs with intervention of ZVAD-FMK on 12th day
高磷血症是全因死亡及心血管死亡的独立危险因素[4]。临床上如何保持钙磷代谢平衡,CKDMBD 治疗时机问题等,都是亟待解决的难点[5]。故本研究旨在通过体外实验观察高磷如何参与血管钙化,并探讨其可能的分子机制。血磷升高通过多种途径触发血管钙化[6-7]:(1)介导VSMCs 细胞转录因子Runx2 的表达,从而使VSMCs 向成骨细胞分化;(2)导致VSMCs 细胞凋亡或坏死后产生的基质囊泡是血管钙化的起始点;(3)同时抑制血管壁中VSMC 向破骨细胞的分化,使得血管钙化无法逆转;(4)诱发骨细胞对FGF23 的过表达最终造成血管钙化。而本研究侧重于观察人血管平滑肌细胞在体外模拟高钙、高磷条件下培养,其成骨细胞标志物及原有平滑肌细胞标志物表达发生变化的情况,从而探讨高钙、高磷与血管平滑肌细胞表型转分化、钙化的关系。
Cbfα 1 是成骨细胞分化的必需转录因子,多种成骨相关蛋白基因的启动子具有Cbf α 1 结合位点,如OPN,骨钙素,ColI 等。骨钙素是成骨细胞合成并分泌的,比较稳定,临床上常通过血清骨钙素了解新形成的成骨细胞的活动状态。骨钙素的出现,表明表达成骨细胞表型的细胞在血管钙化的发生过程中起中心作用,与血管钙化直接相关。本研究通过对VSMCs 在高钙、高磷条件下是否表达参与骨形成的蛋白Cbfα-1、骨钙素,继而发生平滑肌细胞向成骨样细胞的转化,进而促进血管钙化,在细胞水平进行了探讨。采用人原代VSMCs,在高磷和(或)高钙的条件下培养12 d,Western blot 及RT-PCR 的结果均显示,成骨细胞的标志蛋白Cbfα-1、骨钙素表达增强,而肌成纤维细胞的特异性标志物α-SMA 表达下降。Cbfα 1、下游蛋白骨钙素等的表达增加提示VSMCs 出现了成骨细胞的特征,α-SMA 表达下降,提示VSMCs 逐渐丧失血管平滑肌细胞的特性,并向成骨细胞转化。
因此本研究结果证实了高钙、高磷可导致人VSMCs 细胞转化为成骨样细胞,这可能是ESRD患者发生血管钙化的机制之一。那么,如何阻断钙化的进程,已有不少学者作出有益的探讨。Zavaczki E[8]的研究表明硫化氢可以抑制高磷所致的钙化和VSMC 向成骨细胞的转分化。也有研究证实,凋亡可以促进血管平滑肌细胞钙化。本试验发现,运用凋亡抑制剂(caspase 抑制剂)ZAVD-FMK,可以一定程度上抑制高磷和(或)高钙培养所致的血管平滑肌细胞表现转分化(或钙化),提示高磷培养促细胞钙化与其促凋亡作用相关。
综上所述,本实验体外研究模拟了细胞处于高磷和(或)高钙的条件下,通过α-SMA、Cbfα 1、骨钙素等蛋白表达的变化,间接证实了VSMCs 发生表型的转分化,使用非特异性的caspase 抑制剂ZAVD-FMK 可以干预这一进程。表明钙化的发生与血管平滑肌细胞凋亡及成骨分化有关。提示,在临床上治疗CKD-MBD 需率先从钙磷代谢紊乱着手,并为其治疗提供新的靶点和思路。
[1]Eddington H,Hoefield R,Sinha S,et al.Serum phosphate and mortality in patients with chronic kidney disease[J].Clin J Am Soc Nephrol,2010(12):2251-2257.
[2]Tonelli M,Pannu N,Manns B.Oral phosphate binders in patients with kidney failure[J].N Engl J Med,2010(14):1312-1324.
[3]Palit S,Kendrick J1.Vascular calcification in chronic kidney disease:role of disordered mineral metabolism[J].Curr Pharm Des,2014(37):5829-5833.
[4]Toussaint ND.Phosphate in early chronic kidney disease:associations with clinical outcomes and a target to reduce cardiovascular risk[J].Nephrology (Carlton),2012(5):433-444.
[5]Martin KJ,González EA.Prevention and control of phosphate retention/hyperphosphatemia in CKD-MBD:what is normal,when to start,and how to treat?[J].Clin J Am Soc Nephrol,2011(2):440-446.
[6]Liu XF.The mechanisms of high-phosphate-induced vascular calcification in patients with chronic kidney disease[J].Sheng Li Ke Xue Jin Zhan,2014(1):21-26.
[7]Kendrick J,Chonchol M.The role of phosphorus in the development and progression of vascular calcification[J].Am J Kidney Dis,2011(5):826-834.
[8]Zavaczki E.Hydrogen sulfide inhibits the calcification and osteoblastic differentiation of vascular smooth muscle cells[J].Kidney Int,2011(7):731-739.
