贵阳地区224 例哮喘儿童IL-17A-152G/A 位点基因多态性及与哮喘易感性的研究*
2015-04-28夏梦青朱晓萍
曾 艳,李 波,杨 俊,夏梦青,朱晓萍**
(1.贵州医科大学 儿科学教研室,贵州 贵阳 550004;2.贵州医科大学附院 儿科,贵州 贵阳 550004)
支气管哮喘(简称哮喘)在儿童中的患病率呈逐年上升趋势[1],该病是一种慢性气道炎症性疾病,由多种细胞及细胞因子参与,以气道炎症和气道重塑为主要病理特征,慢性炎症与气道高反应性相关,气道高反应性可导致反复喘息发作、呼吸困难、胸闷和咳嗽(尤其是在夜间和凌晨)。白细胞介素-17(IL-17)是一种前炎性细胞因子,是T 淋巴细胞诱导的炎性反应的早期启动因素,能诱导和激活中性粒细胞在呼吸道的募集,为明确IL-17 基因与贵阳地区儿童哮喘的相关性,本研究采用病例对照的方法、PCR-RFLP 技术检测技术,探讨IL-17A基因-152G/A 位点的多态性及其与贵阳地区儿童哮喘发病的相关性。
1 材料与方法
1.1 研究对象与分组
哮喘组为2012 年11 月~2015 年1 月确诊支气管哮喘的患儿224 例,符合儿童支气管哮喘诊断与防治指南诊断标准[2],男152 例,女72 例,平均(6.11±3.27)岁。对照组为同期门诊健康体检儿童150 例,男93 例,女57 例,平均(5.61±3.55)岁,对照组儿童均排除哮喘病史、家族哮喘、过敏性疾病史和其他过敏性疾病史。两组儿童均在贵阳居住半年以上,采血前4 周内未静脉使用糖皮质激素,且均无血缘关系。
1.2 主要仪器及试剂
Eppendorf 聚合酶链反应(PCR)仪(德国艾本德公司),BeckmanDU640 型核酸蛋白分析仪(Beckman 公司),G:BOX 凝胶成像系统(基因有限公司),DNA 提取试剂盒和2×Taq PCR MasterMix[天根生化科技(北京)有限公司],引物合成(北京鼎国生物技术有限责任公司),PdmⅠ内切酶(赛默飞世尔科技),500 bp DNAMarker[宝生物工程(大连)有限公司]。
1.3 方法
1.3.1 全血DNA 提取 取空腹静脉血3 mL,4 ℃静置2 h,血凝块用DNA 提取试剂盒(离心柱型,DP335)提取全血DNA。
1.3.2 引物设计 参照GeneBank 中人IL-17A DNA 序列编号(NC_000006.12),根据rs2275913在美国国立生物技术信息中心网站上查询-152G/A 位点的基因序列,参考文献[3-4]确定突变位点,用Primer Premier5.0 软件设计引物。
1.3.3 IL-17A 基因-152G/A 位点PCR-RFLP 检测
上游引物序列为5'-CAG AAG ACC TAC ATG TTA CT-3',下游引物序列为5'-GTA GCG CTA TCG TCT CTC T-3'。PCR 目的片段扩增PCR 反应体系:25 μL 反应体系含2×Taq PCR MasterMix 12.5 μL,10 μmol/L 上、下游引物各0.8 μL,50 mg/L DNA模板2 μL,ddH2O 8.9 μL。PCR 反应条件94 ℃预变性5 min,94 ℃变性30 s,59 ℃退火40 s,72 ℃延伸30 s,共30 次循环,72 ℃最后一次延伸5 min,反应产物用2%琼脂糖凝胶水平电泳判断是否扩增成功。扩增产物的限制性片段长度多态性分析:15 μL酶切体系含PCR 产物5 μL,10×FastDigest Green Buffer 1 μL,限制性内切酶PdmⅠ(FastDigest PdmⅠ)0.5 μL,ddH2O 8.5 μL,置于37 ℃恒温水浴箱反应5 min,转至65 ℃恒温水浴箱5 min 使酶失活,酶切结果用2%琼脂糖凝胶水平电泳后采用G:BOX 凝胶成像系统鉴定。
1.4 统计学方法
所有数据采用SPSS 16.0 统计软件进行分析,样本分布经Hardy-Weinberg 平衡检验,检验样本群体代表性;计数资料用百分比表示,病例组和对照组的基因型及等位基因频率分布的差异用χ2检验分析,以P <0.05 为差异有统计学意义。
2 结果
2.1 IL-17A 基因-152G/A 位点
PCR 扩增产物结果显示哮喘组和对照组均扩增出344 bp 目的片段,见图1。哮喘组和对照组PCR 扩增产物经PdmⅠ酶切后均发现AA、AG、GG3 种基因型,AA 基因型为213 bp、131 bp,AG 基因型为344 bp、213 bp、131 bp,GG 基因型为344 bp。见图2。
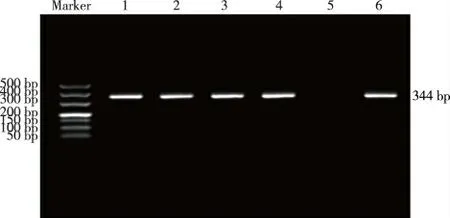
图1 哮喘组和对照组IL-17A-152G/A位点PCR 扩增产物电泳结果Fig.1 Electrophoresis of PCR products of the-152G/A site of IL-17A gene
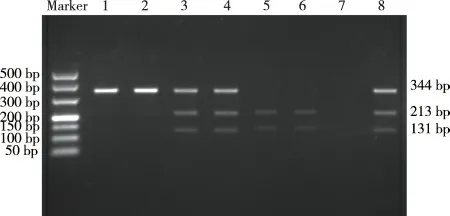
图2 IL-17A 基因-152G/A 位点不同基因型PCR 产物酶切电泳结果Fig.2 Enzyme digestion electrophoresis of PCR products of different genotypes of IL-17A gene-152G/A site
2.2 IL-17A 基因-152G/A 位点基因型及等位基因频率分布
哮喘组和对照组经Hardy-Weinberg 平衡检测示均具有群体代表性(表1),在性别、年龄上差异均无统计学意义(χ2=1.364,t =1.388,P >0.05)。两组间基因型频率分布差异有统计学意义(χ2=7.832,P =0.020),经χ2分割检验,AA 基因型与AG 基因型频率分布差异有统计学意义(χ2=4.395,P=0.036,OR=1.929,95%CI=1.038 ~3.588),AA 基因型与GG 基因型频率分布差异亦有统计学意义(χ2=7.826,P=0.005,OR=2.571,95%CI=1.315 ~5.029),AG 基因型与GG基因型频率分布差异无统计学意义(χ2=1.426,P=0.232);两组间等位基因频率分布差异有统计学意义(χ2=6.635,P =0.01,OR=1.477,95%CI=1.097 ~1.988);变异等位基因A 与哮喘关联,A 基因携带者患哮喘的风险高于非携带者,尤以突变纯合子AA 为著。见表1。
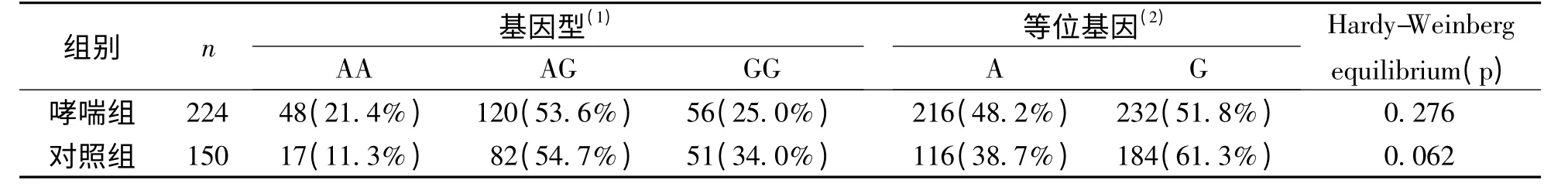
表1 哮喘组和对照组被检儿童IL-17A 基因-152G/A 位点基因型及等位基因分布Tab.1 Characteristics of the genotype and allele frequencies of IL-17A gene-152G/A site of children in asthma group and control group
3 讨论
Th17 细胞是Park 于2005 年在对两种自身免疫疾病动物模型,实验性自身免疫性脑脊髓炎(EAE)、胶原诱导性关节炎(CIA)的研究过程中发现的一类不同于Th1 和Th2 的CD4+Th 亚群细胞[5],可以诱导组织发生强烈炎症反应的T 细胞亚群[6],可以通过多种途径参与哮喘的发生发展,其效应因子IL-17 与哮喘等疾病明显相关[7]。IL-17 通过促进树突状细胞的成熟,刺激相关细胞产生一系列炎性介质和趋化细胞因子等,导致炎症反应的发生[8],活化的IL-17 还可激活上皮细胞、成纤维细胞和巨噬细胞,释放粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、IL-1、IL-6 和IL-8 等,不仅促进气道炎症的进一步加剧,还能参与气道的重构。气道重塑病理基础包括气道上皮细胞和平滑肌增生,粘液高度分泌,上皮下组织纤维化,以及血管生成[9]。
研究表明,IL-17A 基因的单核苷酸多态性与多种疾病相关,尤其是自身免疫性疾病[10]。一项日本研究报道,rs2275913 位点(-152G/A)位于IL-17A 启动子区域,可调控IL-17 表达,A 等位基因可增强启动子活性并增强启动子与核转录因子活化T 淋巴细胞核因子的结合能力,促进IL-17 表达[11]。基因内部的单核苷酸多态性直接或间接影响蛋白质表达水平或性质,从而导致遗传易感性。
Nordang 等[12]对挪威和新西兰的高加索人进行研究,发现在IL-17A 的5 个SNP 多态性基因位点中rs2275913 与挪威人类风湿性关节炎的发生有关,而与新西兰的高加索人类风湿性关节炎却没有明显相关性。Arisawa 等[13]对日本UC 患者IL-17A/F 基因多态性的分析中认为,rs2275913 和rs763780 的基因多态性均与UC 的患病相关。
本研究结果示哮喘组及对照组均存在野生型(GG)、杂合子型(AG)及突变型(AA)三种基因型,基因型及等位基因频率在两组间差异均有统计学意义,发现IL-17A 基因-152G/A 位点多态性与贵阳地区儿童哮喘发病存在相关性,A 等位基因频率显著高于对照组,可能增加儿童患哮喘的风险,当G 突变为A 时,患哮喘的风险是健康儿童的1.477倍,尤其以突变纯合子AA 基因型较其他基因型更易患哮喘,为其它基因型的2.134 倍(χ2=6.376,P =0.012,OR=2.134,95%CI=1.174 ~3.877);Chen J 等[3]对IL-17A rs2275913 位点基因型频率检测中发现该位点和哮喘相关,纯合子A 的儿童患哮喘的几率是其他基因型的2.29 倍,这与本实验结果一致。但Wang 等[14]对台湾地区汉族哮喘儿童IL-17A 基因多个多态性位点的研究中发现-152A/G 位点与该地区哮喘发病无关;王娟等[15]研究发现IL-17A 基因rs711998 可能是儿童哮喘易感位点,其中该位点GG 纯合子基因型与哮喘发病密切相关,未发现IL-17A rs2275913 多态性与哮喘发病有相关性,这与本实验结果不同。哮喘是一种复杂的多基因遗传倾向的疾病,人体中基因与基因之间有着相互作用及累积效应,环境因素,在儿童中如被动吸烟、空气中的尘螨、宠物毛屑等均可影响哮喘的易感性,这些均可造成实验结果的差异。
综上所诉,IL-17A 基因-152G/A 位点可能是贵阳地区儿童哮喘的候选基因,目前指南推荐的吸入性激素(ICS)治疗虽能有效控制嗜酸性粒细胞介导的气道炎症,但对中性粒细胞炎症及气道重塑无效,IL-17 作为促进哮喘中性粒细胞炎症的重要因子,与哮喘气道重塑关系密切,有望成为防治哮喘的新靶点。进行哮喘易感基因的多态性的检测,希望能早期从基因水平筛选哮喘易感人群,以便早期诊断、干预及治疗。
[1]全国儿科哮喘协作组.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志,2013(10):729-735.
[2]中华医学会儿科学会呼吸学组.《中华儿科杂志》编辑委员会.儿童支气管哮喘诊断与防治指南.中华儿科杂志,2008(10):745-753.
[3]Chen JH,Deng Y,Zhao J,et al.The Polymorphism of IL-17 G-152A was Associatedwith Childhood Asthma and Bacterial Colonizationof the Hypopharynx in Bronchiolitis[J].J Clin Immunol,2010(4):539-545.
[4]Kaabachi W,Amor AB,Kaabachi S,et al.Interleukin-17A and-17F genes polymorphisms in lung cancer[J].Cytokine,2014(1):23-29.
[5]Park H,Li Z,Yang XO,et al.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005(11):1133-1141.
[6]Lan F,Liu K,Zhang J,et al.Th17 respones is augmented in OVA-induced asthmatic mice exposed to HDM[J].Med Sci Monit,2011(5):132-138.
[7]Pene J,Chevalier S,Preisser L,et al.Chronically inflamed human tissues are infiltrated by highly differentiated Th17 lymphocytes[J].J Immunol,2008(11):7423-7430.
[8]Besnard AG,Togbe D,Guillou N,et al.IL-33-activated dendritic cells are critical for allergic airway inflammation[J].Eur J Immunol,2011(6):1675-1686.
[9]Gras D,Bourdin A,Chanez P,et al.Airway remodeling in asthma:clinical and functional correlates[J].Med Sci(Paris),2011(11):959-965.
[10]zhu S,Qian Y.IL-17/IL-17receptor system in autoimmune disease:mechanisms and therapeutic potential[J].Clin Sci(lOND),2012(11):487-511.
[11]Espinoza JL,Takami A,Nakata K,et al.A genetic variant in the IL-17 promoter is functionally associated with actue graft-versus-host disease after unrelated bone marrow transplantation[J].PLoS One,2011(10):26229.
[12]Nordang GB,Viken MK,Hollis-Moffatt JE,et al.Association analysis of the interleukin 17A gene in Caucasian rheumatoid arthritis patients from Norway and New Zealand[J].Rheumatology(Oxford),2009(4):367-370.
[13]Arisawa T,Tahare T,Shibata T,et al.The influenceof polymorphisms of interleukin-17A and interleukin-17F genes on the susceptibility to ulcerative colitis[J].J Clin Immunol,2008(1):44-49.
[14]Wang JY,Shyur SD,Wang WH,et al.The polymorphisms of interleukin 17A(IL 17A)gene and tis association with pediatric asthma in Taiwanese population[J].Allergy,2009(7):1056-1060.
[15]王娟,周娟,蔺丽慧,等.IL-17 基因启动子区单核苷酸多态性与儿童哮喘的关系[J].第二军医大学学报,2011(5):481-484.
