桉柠蒎对慢性阻塞性肺疾病大鼠肺功能和气道细菌负荷的影响*
2015-04-28李文扬孙宜田
李文扬,于 娜,孙宜田,康 健
(中国医科大学附属第一医院 呼吸疾病研究所,辽宁 沈阳 110001)
慢性组塞性肺疾病(COPD)是一种慢性进展恶化的炎症性疾病,多种原因可引起COPD 的急性加重。目前黏液纤毛清除(MCC)功能在COPD 发病中的作用日益引起人们的重视[1]。MCC 功能障碍和气道炎症,使细菌容易在下呼吸道定植,细菌负荷达到某一阈值水平,可引起COPD 急性发作,是使病情恶化的主要原因之一[2]。有报导桉柠蒎有促进MCC 功能,增快粘液移动速度,从而稀化黏液的作用[3]。为证实桉柠蒎是否改善COPD 大鼠肺功能并提高细菌清除能力,以及其在细菌清除中所起到的作用,本研究应用烟熏大鼠模拟COPD 模型观察桉柠蒎对MCC 功能与细菌定植的影响。
1 材料与方法
1.1 主要试剂与仪器
桉柠蒎(九龙公司),过滤嘴香烟(大前门,上海),Thermo 超净工作台,自制烟熏箱,离心机,小动物肺功能议AniRes1030,流感嗜血杆菌,培养皿。
1.2 模型构建及分组
SPF 级雄性Wister 大鼠120 只,由中国医科大学实验动物中心提供,鼠龄12 周,体重(200±20)g,随机分为对照组、模型组、预防组和治疗组,每组30 只。分笼饲养于中国医科大学呼吸实验室,室温18 ~20 ℃,湿度50%的洁净环境,12 h 交替采光,普通饲料喂养,自由饮水进食。模型组、预防组及治疗组给予烟熏饲养12 周,一次熏烟燃烧大前门牌香烟40 支,每支香烟约产生烟雾2 L,烟雾浓度8%~10%,持续0.5 h,每日吸烟2 次,上下午各一次,每周5 d,连续12 周。预防组从实验之日起,上午吸烟前30 min 给予桉柠蒎300 mg/kg 灌胃,不吸烟日不给药;治疗组从实验第9 周起给予桉柠蒎,给药方法同预防组。对照组和模型组与预防组同时间给纯净水1.5 mL 灌胃,不吸烟日不给药。
1.3 方法
1.3.1 病理标本的制作 取右肺中叶,用10%甲醛溶液固定,常规脱水,石蜡包埋,切片,HE 染色。进行病理形态学观察。
1.3.2 肺功能测定 造模12 周后,各组随即取6只大鼠,腹腔注射麻醉,仰卧位固定于操作台上,纵行切开颈部皮肤约2 cm,钝性分离皮下组织暴露气管,在环状软骨下两个气管环处切一倒“T”型切口,行气管插管并固定。然后在大鼠左侧胸部作一切口,将与小动物肺功能仪压力传感器相连的胸腔管通过肋间隙插入胸膜腔,采用Medlab 医学软件分析系统测定潮气量、气道流速、跨肺压,换算成气道阻力和肺顺应性。测定呼气峰流速(PEF)、用力呼气容积50%肺活量的瞬间流量(FEF50%)、第0.3秒呼气容积(FEV0.3)、第0.3 秒用力呼气容积与用力肺活量百分比(FEV0.3/FVC)、功能残气量(FRC)等指标,证实通气功能下降并以阻塞性气流受限为主。
1.3.3 细菌负荷的测定 在第12 周结束后麻醉大鼠,通过注射器针头滴入气管内1.5×107cfu/0.1 mL 的流感嗜血杆菌(Hi)混悬液,分别于接种3、6、12 及24 h 后分批处死大鼠,每批处死6 只,行左肺肺泡灌洗。10%水合氯醛3 mL/kg 腹腔注射麻醉大鼠,股动脉放血处死动物。无菌操作下颈部正中切开皮肤,剪开肌肉后暴露气管,眼科剪尖端向心与颈部平面呈30°角剪一小口,直径1.5 mm 朔料软管行气管插管进入2 cm,双重棉线结扎固定。沿胸骨打开胸腔,暴露心脏,夹闭右主支气管,注射器吸取生理盐水与气管插管相连,用4 ℃冷藏的生理盐水灌洗左肺2 次,30 ~60 s 内缓注4 mL,在肺内停留30 s,每次反复推抽两次,收集灌洗液,回收率达90%,双层纱布过滤去除粘液等物,留取支气管肺泡灌洗液(BALF)。4 ℃1 000 r/min 离心10 min。完整取出全肺制成肺组织匀浆。将BALF沉渣和倍比稀释后的肺组织匀浆分别接种于巧克力培养基上,5%CO2、37 ℃孵育箱中培养24 h[4-5],计数BALF 和肺组织匀浆的细菌菌落。
1.4 统计学方法
采用SPSS 19.0 统计软件分析。数据均以均数±标准差()表示,两组间比较用t 检验,多组间比较采用方差分析,以P <0.05 为差异有统计学意义。变量间相关性用多元线性回归分析,P <0.05有相关性,r 越接近1,相关性越显著。
2 结果
2.1 形态学改变
光镜下可见对照组肺泡壁完整,没有明显的炎细胞浸润,而模型组有一定量淋巴细胞等炎症细胞浸润并伴有肺泡壁破裂、肺泡融合,肺泡腔增大。预防组和治疗组大鼠前述病理改变较模型组均有不同程度的减轻,浸润的炎细胞减少,肺泡腔扩大减轻。
2.2 肺功能测定
模型组大鼠FEV0.3/FVC <70%,且FRC 较对照组明显增加,两组比较差异有统计学意义(P <0.01),功能学上达到气流阻塞的程度。预防组和治疗组的FRC 明显低于模型组,预防组改善更为显著,与对照组比较差异无统计学意义(P >0.05),PEF、FEF50%、FEV0.3、FEV0.3/FVC 各组间比较差异无统计学意义(P >0.05)。见表1。
表1 各组大鼠的肺功能比较(,n=6)Tab.1 Comparison of pulmonary function of rats in each group
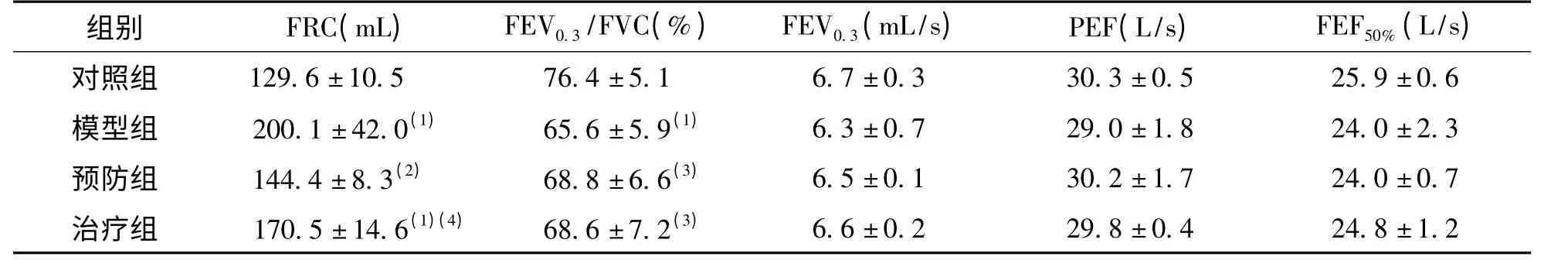
表1 各组大鼠的肺功能比较(,n=6)Tab.1 Comparison of pulmonary function of rats in each group
(1)与对照组比较,P <0.01;(2)与模型组比较,P <0.01;(3)与对照组比较,P <0.05;(4)与模型组比较,P <0.05
组别 FRC(mL) FEV0.3/FVC(%) FEV0.3(mL/s) PEF(L/s) FEF50%(L/s)对照组 129.6±10.5 76.4±5.1 6.7±0.3 30.3±0.5 25.9±0.6模型组 200.1±42.0(1) 65.6±5.9(1) 6.3±0.7 29.0±1.8 24.0±2.3预防组 144.4±8.3(2) 68.8±6.6(3) 6.5±0.1 30.2±1.7 24.0±0.7治疗组 170.5±14.6(1)(4) 68.6±7.2(3)6.6±0.2 29.8±0.4 24.8±1.2
2.3 细菌负荷
模型组的BALF 和肺组织匀浆的菌落计数在各时间点均明显高于对照组(P <0.01)。除对照组BALF 菌落计数呈直线下降及模型组肺匀浆菌落计数于12 h 后再次升高呈波动型外,各组菌落计数均于种菌后第6 h 达到高峰,之后下降。于3、12 及24 h 时,预防组和治疗组的肺匀浆菌落计数较模型组明显降低,且预防组下降更为显著,特别是24 h 时,预防组明显低于治疗组(P <0.01),基本接近正常组;但在6 h 时,模型组、预防组及治疗组3 组肺匀浆细菌菌落计数差异无统计学意义。于3 h、12 h,预防组和治疗组的BALF 菌落计数较模型组明显降低,且预防组下降更为显著(P <0.01);在12 h 时,预防组的BALF 菌落计数明显低于模型组及治疗组(P <0.05);在24 h,预防组基本接近正常组。见表2、表3。
2.4 大鼠肺匀浆细菌负荷与肺功能的相关性
各组大鼠种菌后3、12 及24 h 时的肺匀浆菌落计数与FRC 呈显著正相关(P <0.01),r 分别为0.55、0.715、0.742;6 h 的 肺 匀 浆 菌 落 计 数 与FEV0.3/FVC 呈负相关(P <0.05),r 为-0.367;而FEV0.3与细菌负荷无相关性(P >0.05)。见表4。
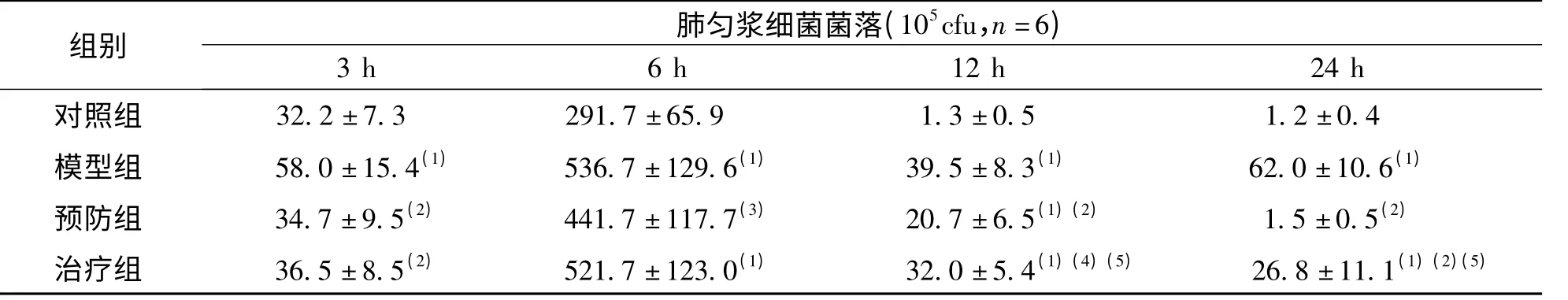
表2 各组大鼠不同时间点的肺匀浆细菌菌落计数(105cfu,n=6)Tab.2 Bacterial colony count of lung homogenate of rats in each group at different time points

表3 各组大鼠不同时间点的BAIF 细菌菌落计数(105cfu,n=6)Tab.3 Bacterial colony count of BAlF of rats in each group at different time points
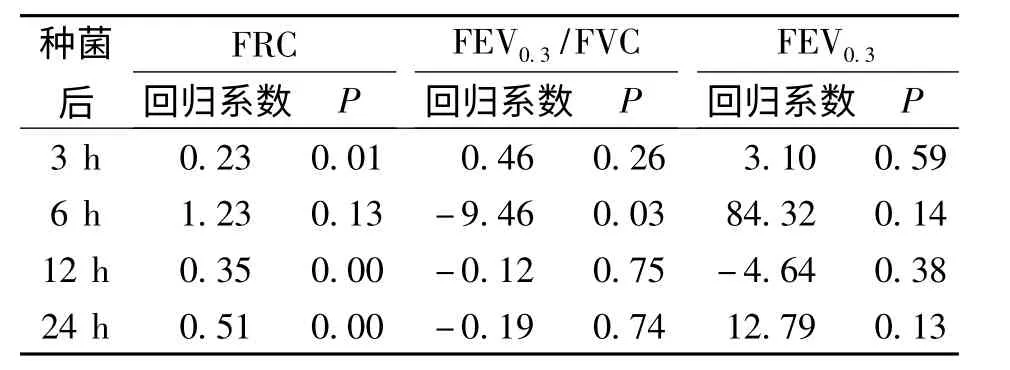
表4 肺功能对大鼠肺匀浆细菌计数多元线性回归分析Tab.4 Multivariate linear regression analysis on pulmonary function and bacterial colony count of lung homogenate of rats
3 讨论
细菌感染是引起COPD 急性发作的一个重要原因,MCC 功能在呼吸道防御机制中起着主要作用,它主要通过纤毛摆动,对黏液的清除,从而把吸附在黏液中的细菌等微生物排出体外,减低气道的细菌负荷。因此,在正常情况下,下呼吸道始终保持无菌状态。COPD 患者在吸烟或其他有害因素作用下,MCC 功能减低,分泌物便在气道中积聚,使细菌容易在下呼吸道定植。细菌及其产物通过增强黏液分泌,直接或间接损害纤毛运动,导致MCC 功能进一步下降,并能持续刺激宿主免疫反应,导致进行性气道破坏,形成恶性循环,加重COPD 进展[2]。随着黏液活性药物桉柠蒎在COPD中的临床应用增加,对其认识愈加深入。按柠蒎主要成分为桉油精、柠檬烯及α-蒎烯,有研究报导这3 种成分均有祛痰、抗菌作用[3,6];其主要成分桉油精为桃金娘科桉属植物的主要提取物,因具有促进MCC 功能,增加黏液移动速度,稀化黏液。
吸烟诱导的COPD 大鼠模型病理学上能出现肺气肿和炎细胞浸润改变,功能学上肺功能也能达到COPD 的诊断标准。本研究采用Wistar 大鼠被动吸烟12 周,形态学上出现了肺气肿改变和淋巴细胞等炎细胞浸润[7-8],。小动物肺功能仪测定FEV0.3/FVC <70%,病理学和功能上符合COPD 大鼠模型标准。肺功能检测结果显示桉柠蒎能降低功能残气量,且预防给药组改善更为显著,可基本接近正常组水平,但其余各项指标均无明显改善,提示桉柠蒎在一定程度上能够减少COPD 大鼠肺泡死腔,改善肺泡过度充气,但短期内应用不能延缓肺功能的下降趋势或改善肺功能。
COPD 稳定期和急性发作期下呼吸道均可分离出病原菌[9-10]。宿主的炎症反应与气道细菌负荷量的增加成正比,当细菌负荷达到某一阈值,便可引起COPD 急性加重[11],其中流感嗜血杆菌感染占第一位。本研究以流感嗜血杆菌为例,将各组大鼠气道内接种该菌,在不同时间点计数不同组别大鼠气道内的细菌负荷并进行统计分析;结果表明,气道内细菌负荷在同一时间点各组间比较有统计学意义,模型组较对照组明显升高,桉柠蒎预防组和治疗组较模型组明显降低,其中预防组降低更加显著;各组菌落计数均于种菌后6 h 达到高峰,之后下降,预防组于24 h 基本接近正常组,且明显低于治疗组;提示桉柠蒎在减低COPD 大鼠下呼吸道细菌负荷有一定的作用,同时表明预防用药好于治疗用药。MCC 是气道的非特异免疫功能,在早期即可发挥作用,本研究通过选取不同时间点计数细菌负荷,证明种菌后6 ~12 h,MCC 能发挥最大效应。模型组大鼠肺匀浆的菌落计数于12 ~24 h有所回升,究其原因可能是由于MCC 功能障碍,不能及时清除细菌而在此时间段出现细菌生长与繁殖大于清除。而细菌负荷的加重亦会导致气道表面Muc5b 生成量的减少,进而引起MCC 功能的进一步损伤[11-13]。
本研究还通过多元线性回归分析细菌负荷与肺功能的相关性,结果显示气道细菌负荷与FRC呈显著正相关,且越到排菌后期相关性越强,与FEV0.3/FVC 呈弱负相关,进而得出气道细菌负荷受肺功能的影响,肺功能(尤其是FRC 与FEV0.3/FVC)越差,MCC 功能损伤越大,细菌负荷越重。提示改善肺功能有利于恢复MCC 功能,增强气道内细菌清除,减少COPD 急性发作。
总之,本研究首次证实了作为黏液促排新药和黏液纤毛清除系统恢复剂的桉柠蒎可以减少吸烟诱导大鼠的肺功能残气量,并减低其气道流感嗜血杆菌细菌负荷。结果表明桉柠蒎对COPD 有效可能是通过对细菌的清除增加即降低细菌负荷起作用的,提高呼吸道黏液清除效率,全面恢复气道的宿主防御功能,打破炎症的恶性循环,有效加速呼吸系统炎性反应的临床恢复,降低气道的易感性,减少感染复发,减少呼吸道感染时抗生素治疗用药周期,全面改善COPD 患者的生活质量[14]。目前已有报道证实其亦有一定的抗炎作用,吕小琴等[15]研究发现蓝桉油(桃金娘科植物提取物)对脂多糖引起的大鼠慢性支气管炎具有一定的抗炎作用,并能抑制其气道黏蛋白高分泌现象。因此,桉柠蒎改善MCC 功能并减少细菌定植的药理作用及相关分子生物学机制仍需进一步深入研究。随着COPD 发病机制研究的深入,桉柠蒎的长期应用可能延缓该病的进展,并有可能成为针对病原菌的抗微生物制剂的补充疗法[16]。
[1]Danahay H,Jackson AD.Epithelial mucus-hypersecretion and respiratory disease[J].Curr Drug Targets Inflamm Allergy,2005(6):651-664.
[2]Agusti GN.COPD,a multicomponent disease:implications for management[J].Respiratory Medicine,2005(99):670-682.
[3]向海洋.强效黏液促排药-桉柠蒎肠溶软胶囊[J].中南药学,2010(3):237-239.
[4]Guyornnet DV,Audie JP.Characterization of the human mucin gene MUC5AC:a consensus cysteine-rich domain for 11P15 mucin genes[J].Bioehem J,1995(1):211-219.
[5]Silverman HS,Parry S,Sutton-Smith M,et al.In vivo glycosylation of mucin tandem repeats[J].Glycobiology,2001(6):459-471.
[6]Davri1 M,Degroote S,Humbert P,et al.The sialylation of bronchial mucins secreted by patients suffering from cystic fibrosis or from chronic bronchitis is related to the severity of airway infection[J].Glycobiology,1999(3):311-321.
[7]Fowler J,Vinall L and Swallow D.Polymorphism of the human MUC genes[J].Front Biosci 6:D1207-D1215,2001.
[8]Audie JP,Janin A,Porchet N,et al.Expression of human mucin genes in respiratory,Digestive,and reproductive tracts ascertained by in situ hybridization[J].J Histochem Cytochem,1993(10):1479-1485.
[9]Hill AT,Campbell EJ,Hill SL,et al.Association between airway bacterial load and markers of airway inflammation in patients with stable chronic bronchitis[J].Am J Med,2000(109):288-295.
[10]Tumkaya M,Atis S,Ozge C,et al.Relationship between airway colonization,inflammation and exacerbation frequency in COPD[J].Respir Med,2007(4):729-737.
[11]Rogers DF.Physiology of airway mucus secretion and pathophysiology of hypersecretion[J].Respir Care,2007(9):1134-1146.
[12]Roy MG,Livraghi-Butrico A.Muc5b is required for airway defence[J].Nature,2014(7483):412-416.
[13]Sun L,Tang L,Kang J,et al.The effect and mechanism of action of carbocysteine on airway bacterial load in rats chronically exposed to cigarette smoke[J].Respirology,2010(7):1064-1071.
[14]詹谨,耿维飞.桉柠蒎的药理作用与临床评价[J].中国现代药物应用,2008(12):26-28.
[15]吕小琴,唐法娣,王砚,等.蓝桉油对脂多糖引起的大鼠慢性支气管炎及黏蛋白高分泌的影响[J].中华中药杂志,2004(7):168.
[16]Baraldo S,Saetta M,Cosio MG,et al.Pathophysiology of the small airways[J].Semin Respir Crit Care Med,2003(24):465-472.
