3种黄酮醇ESI-ITMS准分子离子构型的密度泛函理论分析
2015-04-27孙长海姜文婷房碧晗王慧冰方洪壮
李 想,孙长海,姜文婷,房碧晗,王慧冰,方洪壮
(佳木斯大学 药学院,黑龙江 佳木斯 154007)
3种黄酮醇ESI-ITMS准分子离子构型的密度泛函理论分析
李 想,孙长海,姜文婷,房碧晗,王慧冰,方洪壮*
(佳木斯大学 药学院,黑龙江 佳木斯 154007)
采用密度泛函理论(Density functional theory,DFT) B3LYP方法,通过全几何结构优化、二面角柔性势能扫描,对山奈酚、槲皮素、杨梅素3种黄酮醇分子的优势构象及电喷雾离子阱质谱(ESI-ITMS)负离子模式下准分子离子的最优构型进行了研究,并从能量参数、构型参数、质谱实验角度对准分子离子的最优构型作出了确证。结果表明:山奈酚、槲皮素和杨梅素分子二面角D(1,2,1′,6′)均接近0°,分子的优势构象均为B环与A,C环处在同一平面上的构象;在负离子模式下,自动及手动扫描方式得到的山奈酚、槲皮素、杨梅素的二级质谱的复杂程度依次减弱,各分子失去羟基氢所形成的准分子离子结构共轭链增长、共轭效应加强;山奈酚存在两种低能量的准分子离子构型,即失去B环4′位羟基氢与失去A环7位羟基氢的构型,槲皮素与杨梅素失去B环4′位羟基氢的总能量最低、构型最稳定,且山奈酚、槲皮素、杨梅素准分子离子构型的稳定性依次增加。该研究可供进一步探索黄酮醇类化合物ESI-ITMS负离子模式下的质谱裂解规律参考。
黄酮醇化合物;电喷雾离子阱质谱;密度泛函理论
黄酮醇(Flavonol)属黄酮类化合物,广泛分布于自然界,常以游离态或糖苷形式存在[1-3],具有抗突变、抗肿瘤、抗氧化、延缓衰老等多种药理和保健作用,被广泛用于药品和保健食品的开发[4-6]。黄酮醇类化合物的天然产物及体内样品的分析[7-8]方法多采用电喷雾电离源质谱技术。随着软电离质谱的不断发展,借助量子化学方法从分子水平研究化合物软电离方式下的质谱裂解规律受到广泛关注[9-10]。在质谱裂解规律的量子化学计算中,准分子离子几何结构的可靠性直接影响后续深层次的分析,确定准分子离子最有可能的最优构型是解析质谱裂解机理的首要问题[11-12]。本研究运用量子化学计算方法,依据密度泛函理论(Density functional theory,DFT),借助Gaussian 03计算软件,考察了山奈酚、槲皮素、杨梅素3种黄酮醇分子处于稳定状态时的结构特征,探索了各化合物分子的优势构象以及电喷雾电离源负离子模式下准分子离子的最优构型,结合构型参数与质谱测定,对获得的准分子离子最优构型进行了确证。实验结果可供深入探索ESI-ITMS负离子模式下黄酮醇类化合物的质谱裂解机理参考。
1 实验部分
1.1 仪器与试剂
AgilentG6310电喷雾离子阱质谱仪(美国安捷伦公司);KDS 100 CE微量注射泵(Agilent kd scientific)。对照品:山奈酚(Kaempferol,纯度>98%,批号20121215,大连美仑生物技术有限公司);槲皮素(Quercetin,纯度>98%,批号1109630,天津一方科技有限公司);杨梅素(Myricetin,纯度≥98%,批号13020102,成都曼斯特生物科技有限公司)。甲醇、异丙醇(色谱级,天津市科密欧化学试剂有限公司)。
1.2 质谱条件
离子源:ESI源;扫描方式:负离子模式下自动一级质谱全扫描及手动二级质谱提取离子扫描;碎裂电压:自动1.00 V,手动0.10~1.50 V;扫描范围:m/z50~330;鞘气和辅助气:氮气;鞘气流速10 L·min-1;辅助气流速:0.15 L·min-1;碰撞气:氦气;喷雾电压:3.5 kV;毛细管电压:13 V;干燥气温度:325 ℃;微量注射泵进样流速:0.5 mL·h-1;进样方式:直接进样。对照品浓度:5 μg/mL;溶剂:甲醇。
1.3 量子化学计算
量子化学计算采用Gaussian 03软件完成。各化合物分子及离子的初始几何结构由软件GaussView 3.0给出。首先,采用密度泛函理论B3LYP/6-31+g(2d,2p)方法,对分子初始结构中B环与C环间的二面角进行旋转360°柔性势能扫描,获得各分子能量最低的构象;再用B3LYP/6-31g(d)方法对获得的构象进行优化,得到各分子的优势构象及相关参数。在优势构象基础上,采用相同优化方法对各分子可能的准分子离子构型进行结构优化及振动分析,并在RB3LYP/6-31+g(2d,2p)水平计算各个优化结构的能量;最后,通过能量比较分析,得出各化合物准分子离子的最优构型。结构优化及振动分析收敛标准均为:力的最大值(Maximum Force)小于0.000 450;力的均方根(RMS Force)小于0.000 300;位移的最大值(Maximum Displacement)小于0.001 800;位移的均方根(RMS Displacement)小于0.001 200。键长、偶极矩等参数从各分子及准分子离子相应的优化结果文件中获取。
2 结果与讨论
2.1 分子优势构象
黄酮醇化合物分子的初始结构及原子位次编号如图1所示,其中,山奈酚:R1=H,R2=H;槲皮素:R1=OH,R2=H;杨梅素:R1=OH,R2=OH。分子柔性势能扫描各角度构象与最稳定构象的能量差结果如图2所示。由图2可知,当分子处于最稳定状态即能量最低时,山奈酚、槲皮素和杨梅素的二面角D(1,2,1′,6′)均接近0°。各分子能量最低结构的优化结果均符合收敛标准,振动分析未出现虚频,各构象稳定。各分子的优势构象如图3所示。3种化合物优势构象的部分二面角参数见表1。表1数据表明,当分子构型相对最稳定时,A,C,B环处于同一平面,与文献[13-14]报道相吻合。
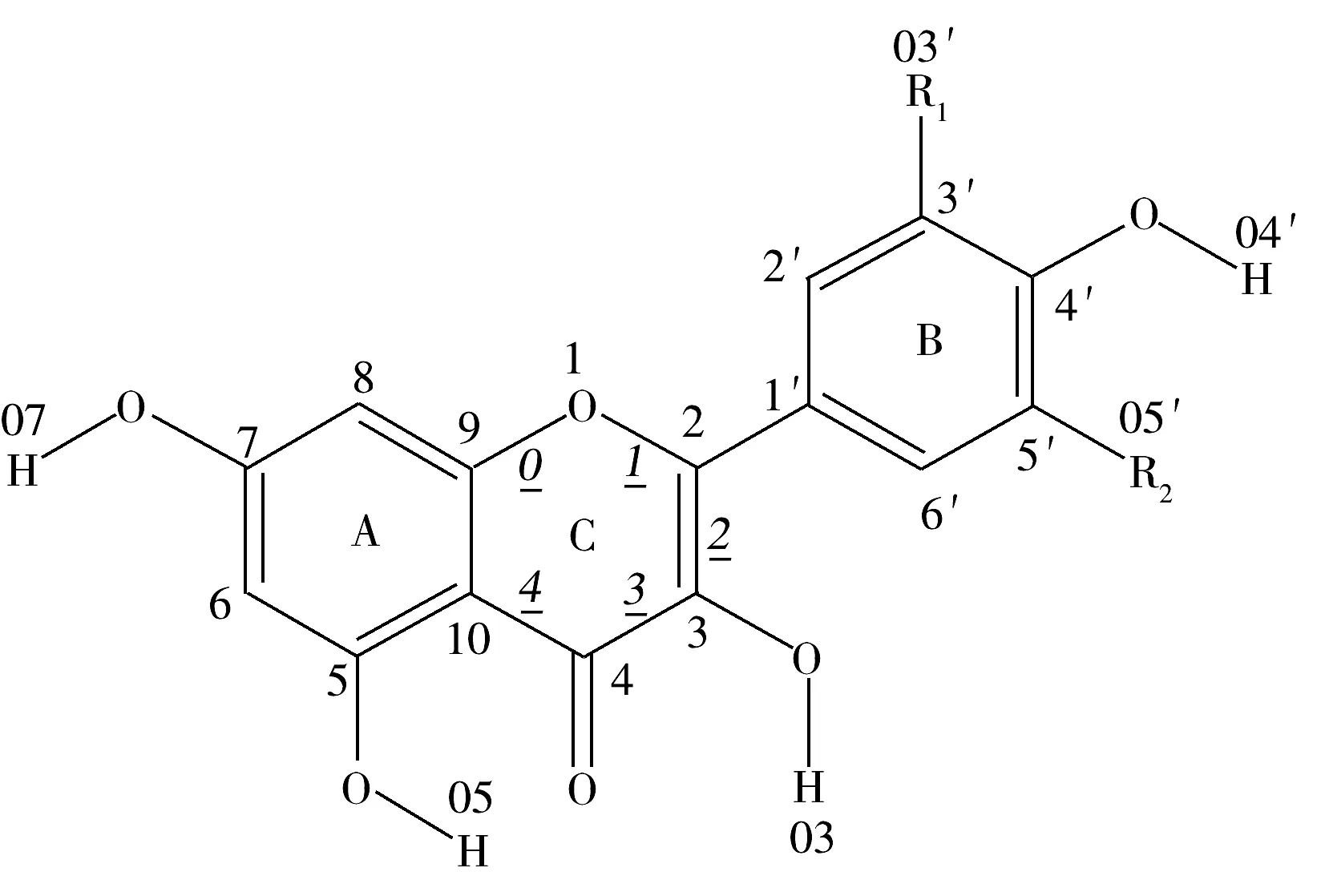
图1 3种化合物的分子结构

图2 3种化合物二面角D(1,2,1′,6′)的柔性势能扫描曲线

图3 3种化合物的优势构象
表1 3种化合物优势构象的部分二面角参数
Table 1 Some dihedral parameters of the preferred conformations of three compounds

Dihedral(二面角)Degree(角度,°)Kaempferol(山奈酚)Quercetin(槲皮素)Myricetin(杨梅素)D1(5,10,9,1)-180 0000180 0014180 0001D2(4,10,9,8)179 9996-180 0051179 9997D3(5,10,4,3)180 0001-180 0041179 9986D4(8,9,1,2)-179 9998180 0045-179 9980D5(3,2,1′,6′)0 0196-0 0015-0 0160D6(1,2,1′,2′)0 01460 0000-0 0159D7(3,2,1′,2′)180 0183179 9977179 9847D8(1,2,1′,6′)0 0146180 0008179 9834
分子初始结构的输入方法会影响优势构象的结果。当采用ChemDraw Ultra8.0及Chem3D Ultra8.0方法时,优化后山奈酚、槲皮素和杨梅素的分子B环与A,C环的二面角分别为36.5°,36.1°和36.4°;而通过GaussView3.0输入,对二面角D(1,2,1′,6′)进行柔性势能扫描,得到各分子优势构象所对应的B环与A,C环的二面角却均接近0°。由于柔性势能扫描能够获得D(1,2,1′,6′)旋转1周的各个角度的能量值,可通过能量的比较来确定分子的优势构象,相对更加全面合理,因此本研究采用GaussView3.0输入。需指出,虽然两种输入方式产生的优势构象结果不同,但相应的优势构象间的能量差别较小,在室温及空间位阻很小的情况下,非平面构象只需克服很小的能垒即可依靠分子热运动所提供的能量转化成平面构象[15]。
2.2 准分子离子结构
2.2.1 能量分析 在电喷雾电离源负离子模式下,羟基氢较苯环氢更易丢失而发生去质子化。山奈酚、槲皮素、杨梅素分子中分别具有4,5,6个羟基,可分别失去质子而形成准分子离子([M-H]-)。3种化合物可能的[M-H]-构型的结构优化、振动分析及能量计算表明:优化均符合收敛标准,振动分析无虚频,构型稳定。表2为3种黄酮醇可能的[M-H]-体系的能量计算结果,可知山奈酚、槲皮素与杨梅素丢失B环04′-H(即4′位羟基氢,下同)的体系总能量均最低,构型最稳定,所形成[M-H]-为热力学择优结果。
与此同时,由于山奈酚丢失A环07-H(即7位羟基氢,下同)与丢失B环04′-H所形成的两种[M-H]-总能量接近,故在负离子模式下,山奈酚存在两种不同的[M-H]-构型,分别记作山奈酚Ⅰ(Kaempferol Ⅰ,丢失04′-H)与山奈酚Ⅱ(Kaempferol Ⅱ,丢失07-H)。

表2 3种化合物可能的[M-H]-构型的能量

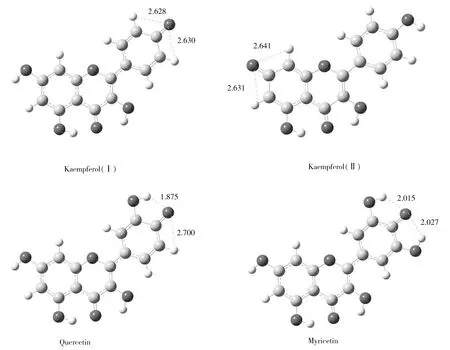
图4 3种化合物丢失04′-H的[M-H]-立体构型及可能的氢键(Å)
2.2.3 质谱分析 3种黄酮醇的自动二级质谱图如图5所示。由图5可知,山奈酚、槲皮素、杨梅素二级质谱的复杂程度逐渐降低。对各准分子离子施以不同碎裂电压,手动提取二级质谱时发现,当碎裂电压较低时,山奈酚即可获得多个产物离子,槲皮素只产生两个明显的离子(m/z178.8与m/z150.8),而杨梅素仅有一个明显的m/z178.8离子。由于二级质谱所呈现的复杂程度是随着化合物准分子离子稳定性的升高而降低,因此可以说明山奈酚、槲皮素、杨梅素准分子离子的稳定性逐渐增加。

图5 3种化合物[M-H]- 的MS2质谱图
3种黄酮醇的[M-H]-稳定构型的相应偶极矩计算结果为:山奈酚(Ⅰ)11.697 4D、山奈酚(Ⅱ)13.230 9D、槲皮素10.058 1D、杨梅素9.022 5D。结合质谱测定结果及相关文献资料分析可推断出,对于[M-H]-最为稳定的杨梅素,由于分子C环极性相对较小,使得二级质谱主要发生C环跨环开裂产生1,2A-m/z178.8离子,进而脱去中性分子CO生成m/z150.8离子及连续脱去CO 和CO2后的m/z106.9离子[16]。槲皮素[M-H]-的极性相对于杨梅素有所下降,在C环跨环开裂产生m/z178.8,150.8,106.9离子的同时,也发生C环的另一跨环开裂,产生1,3A-m/z150.8离子[16-17],使得m/z150.8处的强度增大;与此同时,C环同环开裂的程度增加,有多个脱去中性低质量碎片后的离子产生。山奈酚[M-H]-极性相对较大,其稳定性较差,故其二级质谱无1,2A-m/z178.8离子产生,而在产生1,3A-m/z150.8离子的同时,还产生另一跨环开裂的0,2A-m/z162.8离子及其连续碎裂后的m/z106.9离子,并且C环同环开裂的比例加大,产生大量脱去中性碎片的离子[18-20]。
3种黄酮醇[M-H]-体系的C环各键键长及C环与B环相接的键长见表3。由表3可知,构成C环的C—C键与C—O键及连接C环与B环的C—C键的长度介于单键与双键之间,说明组成C环的各原子间及C环与B环间存在着共轭现象。由表3还知,在3种黄酮醇[M-H]-所涉及的化学键中,山奈酚、槲皮素、杨梅素多数键键长的顺序是由长到短。由于键长越长,键越易断裂,从而可进一步解释3种黄酮醇质谱复杂的顺序。结合3种黄酮醇的二级质谱可知,由于C环的各键中,C2—C3及C4—C10键的键长数值最大,其中又以山奈酚为最大,因此山奈酚[M-H]-最易发生C2—C3及C4—C10断裂,在质谱中表现为,先脱去中性分子CO生成m/z257.0离子,进而再分别脱去H2O与CO生成m/z239.0与m/z228.9的离子,m/z228.9离子可继续脱去CO2生成m/z184.9的离子。另外,山奈酚C4—C10的断裂,也可导致C2H2O的脱去,产生m/z243.1离子,进而脱去CO2生成m/z199.0的离子;同时C4—C10的断裂还会引发m/z142.9离子的产生。由表3还可知,3种黄酮醇[M-H]-连接C环与B环的C2—C1′键较长、较易断裂,表现在图5的二级质谱上,山奈酚脱去中性碎片AC环,产生m/z93.0的酚羟基离子[21],而槲皮素和杨梅素[M-H]-脱去中性碎片B环,产生m/z192.8的离子[16]。虽然m/z192.8的离子峰强度较低,但此峰的强度与槲皮素和杨梅素[M-H]-的键长顺序相对应。关于山奈酚与另外两种黄酮醇在C2—C1′键开裂时生成不同产物离子的现象,推测其原因为,山奈酚[M-H]-构型Ⅱ的C2—C1′键键长大于构型Ⅰ,键断裂发生在构型Ⅱ上,键断裂时电荷转移的机制与丢失04′-H构型的槲皮素和杨梅素的[M-H]-有所不同。

表3 3种化合物[M-H]-C环的主要键长(Å)
3 结 论
依据密度泛函理论,通过量子化学计算确定山奈酚、槲皮素、杨梅素化合物分子的优势构象为A,C,B环处在同一平面,为平面共轭体系。量子化学与质谱实验的结合分析表明,电喷雾离子阱质谱负离子模式下,3种黄酮醇分子中B环4′-OH脱去质子及山奈酚A环7-OH脱去质子所形成的准分子离子体系,使共轭系统共轭链增长,共轭效应加强,总能量最低,均为准分子离子的最优构型。
[1] Day A J,Bao Y,Morgan M R,Williamson G.FreeRadicalBiol.Med.,2000,29(12):1234-1243.
[2] Ablajan K,Abliz Z,Shang X Y,He J M,Zhang R P,Shi J G.J.MassSpectrom.,2006,41(3):352-360.
[3] Manach C,Morand C,Demigné C,Texier O,Régérat F,Rémésy C.FEBSLett.,1997,409(1):12-16.
[4] Vuorinen H,Määttä K,Törrönen R.J.Agric.FoodChem.,2000,48(7):2675-2680.
[5] Garcia-Closas R,Gonzalez C A,Agudo A,Riboli E.CancerCauses&Control,1999,10(1):71-75.
[6] Su Y,Liu S,Yang M,Liao X W.J.SouthwestUniv.Natl.:Nat.Sci.Ed.(苏宇,刘珊,杨铭,廖显威.西南民族大学学报:自然科学版),2006,32(3):517-521.
[7] Geng P,Zhang R,Aisa H A,He J,Qu K,Zhu H,Abliz Z.RapidCommun.MassSpectrom.,2007,21(12):1877-1888.
[8] Chi Y M,Zhu H Y,Ju L,Zhang Y,Shen X N,Hua X Y,Nie F.Chin.J.Anal.Chem.(池玉梅,朱华云,居羚,张瑜,沈小宁,华小懿,聂芬.分析化学),2009,37(2):227-231.
[9] Wright P,Alex A,Harvey S,Parsons T,Pullen F.Analyst,2013,138(22):6869-6880.
[10] Galezowska A,Harrison M W,Herniman J M,Skylaris C K,Langley G J.RapidCommun.MassSpectrom.,2013,27(9):964-970.
[11] Ouyang Y Z,Liang Y Z,Li S H,Lou X,Zhang L X,Tang Z H,Wang Q,Xu X N.Int.J.MassSpectrom.,2009,286(2/3):112-121.
[12] Risoli A,Cheng J B,Verkerk U H,Zhao J,Ragno G,Hopkinson A C,Siu K W.RapidCommun.MassSpectrom.,2007,21(14):2273-2281.
[13] Aparicio S.Int.J.Mol.Sci.,2010,11(5):2017-2038.
[14] Antonczak S.J.Mol.Struct.Theochem.,2008,856(1/3):38-45.
[15] Cornard J P,Merlin J C,Boudet A C,Vrielynck L.Biospectroscopy,1997,3(3):183-193.
[16] Fabre N,Rustan I,Hoffmann E,Quetin-Leclercq J.J.Am.Soc.MassSpectrom.,2001,12(6):707-715.
[17] Burns D C,Ellis D A,Li H X,Lewars E,March R E.RapidCommun.MassSpectrom.,2007,21(3):437-454.
[18] Medana C,Carbone F,Aigotti R,Appendino G,Baiocchi C.Phytochem.Anal.,2008,19(1):32-39.
[19] Lu L,Song F R,Tsao R,Jin Y R,Liu Z Q,Liu S Y.RapidCommun.MassSpectrom.,2010,24(1):169-172.
[20] March R E,Miao X S.Int.J.MassSpectrom.,2004,231(2/3):157-167.
[21] Hughes R J,Croley T R,Metcalfe C D,March R E.Int.J.MassSpectrom.,2001,210/211:371-385.
Analysis on ESI-ITMS Quasi-molecular Ion Configurations of Three Flavonol Compounds by Density Functional Theory
LI Xiang,SUN Chang-hai,JIANG Wen-ting,FANG Bi-han,WANG Hui-bing,FANG Hong-zhuang*
(Pharmaceutical College,Jiamusi University,Jiamusi 154007,China)
Using density functional theory(DFT) B3LYP method,the preferred molecular conformations and the optimal configurations of kaempferol,quercetin and myricetin quasi-molecular ions in electrospray ion trap mass spectrometry(ESI-ITMS) negative ion mode were studied by the full geometry optimization and the relaxed dihedral potential energy scan.The optimal configurations of three flavonol quasi-molecular ions were confirmed in the aspects of energy parameters,configuration parameters,and mass spectrometry experiments.The results indicated that the degrees of dihedral D(1,2,1′,6′) for kaempferol,quercetin and myricetin were close to 0°,and the preferred conformations of three flavonol compounds were respectively coplanar including A,C and B ring.In the negative ion mode,the complexities of MS2spectra which were determined by the automatic and manual methods for kaempferol,quercetin and myricetin were successively weakened.The optimal configurations of quasi-molecular ions were the structures lost the hydrogen of phenolic hydroxyl,with the conjugated chain increasing and the conjugated effect strengthening.Two quasi-molecular ion configurations for kaempferol existed,that were loss of 4′-OH hydrogen and 7-OH hydrogen,and the total energy of loss of 4′-OH hydrogen configurations for quercetin and myricetin were the lowest and the most stable.The stabilities of quasi-molecular ion configurations for kaempferol,quercetin and myricetin were increased successively.The analysis of the study can be used as a reference for further exploration of the fragmentation pathway and mechanism of flavonol compounds in ESI-ITMS negative ion mode.
flavonol compounds; electrospray ionization ion trap mass spectrometry(ESI-MS); density functional theory
2014-10-11;
2014-11-10
佳木斯大学研究生科技创新项目(LZR2014_032);黑龙江省自然科学基金资助项目(D201226)
10.3969/j.issn.1004-4957.2015.02.004
O657.63;TQ460.72
A
1004-4957(2015)02-0147-06
*通讯作者:方洪壮,教授,研究方向:中药分析与计算药物分析,Tel:0454-8611265,E-mail:fhz-chjms@sohu.com
