PEP-3与HBc融合原核表达载体的构建与表达
2015-04-27叶明付夏海滨
杨 星,陈 皓,叶明付,代 鑫,夏海滨
(陕西师范大学 生命科学学院,秦巴山区可持续发展协同创新中心,陕西 西安710119)
乙肝病毒核心蛋白(Hepatitis B Virus Core Protein,HBc)是构成乙肝病毒(Hepatitis B Virus,HBV)核心抗原(Hepatitis B Core Antigen,HB-cAg)的主要单体蛋白[1],能够形成二十面体对称病毒样粒子(Virus-like Particles,VLPs)的结构[2],可被用来展示外源序列。作为免疫载体蛋白[3],HBc可在自身表面重复且高密度地展示外源性序列,从而诱发强有力的体液或细胞免疫反应,同时对免疫检测也有放大作用。使用单克隆抗体研究发现,位于HBc衣壳表面刺突顶端的78—82位氨基酸是它的主要免疫显性区域(Major Immunodominant Region,MIR)。MIR为特异性抗原小肽的插入提供了极佳位点[4]。HBc作为抗原表位小肽的载体蛋白,形成的 HBc-VLPs[5],在研究表位小肽疫苗的制备及应用等方面具有巨大的应用前景。
人表皮生长因子受体突变体Ⅲ(EGFRvⅢ)首次在多形性胶质母细胞瘤中发现,普遍存在于多种恶性肿瘤细胞表面[6-7]。EGFRvⅢ 由 EGFR 缺失2—7外显子区域所致。EGFRvⅢ的胞外区域形成了一段含有13氨基酸的特异性小肽片段,其氨基酸序列为LEEKKGNYVVTDH,该小肽被命名为PEP-3[8-9]。据报道,针对 EGFRvⅢ表面特异性小肽的肿瘤疫苗已用于小鼠动物肿瘤模型的实验研究[10]。由于EGFRvⅢ中的PEP-3小肽仅在肿瘤细胞表面特异性表达,因此PEP-3可以作为肿瘤治疗中理想的靶分子,针对PEP-3的肿瘤疫苗将在肿瘤治疗中发挥重要的作用。
目前,抗原表位小肽在治疗性或预防性疫苗的研究中得到广泛应用。为了快速检测抗原表位小肽作为疫苗的效果,本研究通过小肽的一步连接及阳性克隆的蓝白班筛选,构建了嵌合可呈现抗原表位小肽的HBc病毒样粒子的原核表达载体。在此基础上,为了进一步测试该载体,我们将肿瘤特异性表位小肽PEP-3插入该载体,利用蓝白班筛选原理获得HBc/PEP-3融合蛋白的原核表达载体,并通过大肠杆菌原核表达及纯化获得HBc/PEP-3融合蛋白。呈递抗原表位小肽的乙肝病毒核心蛋白类病毒颗粒通用原核表达载体的构建为研究其他表位小肽的疫苗作用奠定基础,同时 HBc/PEP-3融合蛋白的表达与纯化也为后续PEP-3小肽抗肿瘤疫苗的实验治疗研究奠定基础。
1 材料与方法
1.1 材料
质粒pET-28a(+)、大肠杆菌 E.coli DH5α、BL21(DE3)均由本实验室保存,限制性内切酶为Fermentas公司产品,pGEM-T Easy Vector,T4 DNA连接酶购自Promega公司。rTaq酶为TaKa-Ra公司产品,DNA Marker为Hybigen公司出品,DNA凝胶回收试剂盒购于AXYGEN公司,所有引物由华大基因公司合成。增强型化学发光底物试剂盒、Spectra Multicolor Broad Range Protein Ladder、PageRuler Unstained Protein Ladder 购 自Thermo 公 司,蛋 白 纯 化 所 用 Ni-NTA His-Bind Resin为Novagen公司产品,鼠源Anti-His Antibody购自天根公司,辣根过氧化物酶标记山羊抗小鼠IgG购自中杉金桥公司。
1.2 方法
1.2.1 携带BamHⅠ及SfuⅠ单一位点的基因片段HBc-BS的获得 根据Gene Bank公布的HBV基因组(GI 22203511)信息,以本实验室已有的HBc的基因片段作为模板,使用引物P1(AGAATTCATGGACATTGACCCGTATAA)及P2(TTCGAATATGTGAAGCTTGGATCCATTACTT CCCACCCAGGT)扩增 HBc-BS 基因F1片段(即包含HBc基因1-225bp的片段),在F1片段的5′-端引入EcoRⅠ位点,3′-端引入BamHⅠ-SfuⅠ位点;使用引物P3(GGATCCAAGCTTCACATATTCGAATTAGTAGTCAGCTAT)及 P4(TCTCGAGTTAACACTGAGATTCCCGAGAT)扩 增HBc基因F2片段(即包含HBc基因247-552bp的片段),在F2片段的5′-端引入BamHⅠ-SfuⅠ位点,3′-端引入XhoⅠ位点。PCR产物经1%琼脂糖凝胶电泳回收后,采用Overlap PCR方法,以P1及P4为引物,F1,F2为模板,扩增获得HBc MIR区域78—82位氨基酸缺失的HBc基因片段。此外,在缺失HBc MIR片段的区域两侧分别携带单一的限制性内切酶位点BamHⅠ及SfuⅠ位点,将获得的片段命名为HBc-BS,约564bp。回收产物连至pGEM-T easy载体,连接产物经转化后,获得的阳性克隆经酶切鉴定和测序确认,命名为pGEM-T Easy/HBc-BS,于-20℃存储备用。
1.2.2 pRGHBc-BS/Lac Zα原核表达通用载体构建
限制性内切酶BamHⅠ和XhoⅠ双酶切原核表达载体pET-28a(+),随后将一段两端携带BamHⅠ与XhoⅠ粘性末端的多克隆位点片段连入上述酶切载体中,从而导致载体中的BamHⅠ位点发生突变,所获得的阳性克隆称为pET-28a(+)/BX。多克隆酶切位点片段序列为:GGATCGGTCGACGAATTCTTCGAAGGATCCACAGTGGTACCCTCGAG。
载体pGEM-T Easy/HBc-BS经EcoRⅠ和XhoⅠ双酶切,将获得的片段HBc-BS连入经相同酶切的表达载体pET-28a(+)/BX中,经酶切鉴定并测序确认后,获得的阳性克隆命名为pRGHBc。
将两端携带BamHⅠ与SfuⅠ粘性末端的Lac Zα片段连入同样酶切的载体pRGHBc中。连接产物转化至E.coli DH5α,37℃孵育1.5h后,全菌液与50μL 40mg/μL X-gal混匀,涂至 Kan+抗性LB固体培养基平板上。37℃培养过夜,利用蓝白斑筛选,挑取蓝色单菌落,对所提取的质粒DNA进行酶切鉴定,获得阳性克隆。所获得的阳性克隆载体可以作为一种通用的原核表达载体,可用于获得表面呈现抗原表位小肽的HBc类病毒颗粒,该载体命名为pRGHBc-BS/Lac Zα。
1.2.3 表面呈现PEP-3小肽的HBc融合蛋白表达载体pRGHBc-BS/PEP-3构建 PEP-3基因序列共39 bp,序列为 CTGGAGGAAAAGAAAGG TAATTATGTGGTGACAGATCAC 。基因片段L1(GATCCCTGGAGGAAAAGAAAGGTAATTATGTGGTGACAGA TCACTT)及 L2(CGAAGTGATCTGTCACCACATAATTACCTTTCTTTTCCTCCAGG )由华大基因公司合成,室温退火2h后,获得两端带有BamHⅠ、SfuⅠ粘性末端的PEP-3基因片段。载体pRGHBc-BS/Lac Zα经BamHⅠ及SfuⅠ双酶切后,琼脂糖凝胶电泳回收pRGHBc-BS载体,并将退火所形成的PEP-3片段连入其中,所获得的阳性克隆命名为pRGHBc-BS/PEP-3。
1.2.4 抗原表位小肽PEP-3的 HBc融合蛋白原核表达及纯化 将重组质粒 pRGHBc-BS/PEP-3电转至大肠杆菌感受态细胞BL21(DE3),条件为1 500V,5.0ms。加1mL无抗性LB培养基后,37℃孵育2h,取20μL菌液均匀涂至Kan+抗性LB固体培养基平板上,37℃培养过夜。次日挑取单克隆至5mL Kan+抗性液体培养基中,225r/min,37℃摇床培养。至菌液OD600=0.35时进行异丙基β-D-1-硫代半乳糖苷(IPTG,Isopropylβ-D-1-Thiogalactopyranoside)诱导,IPTG 终浓度为1mmol/L。诱导5h后收集菌液,留样进行检测。以IPTG诱导前菌液作为对照组。
将诱导后的菌液100mL,7 000r/min,4℃离心10min,弃上清培养基,收集离心后沉淀。首先采取非变性法处理目的蛋白,即用1×Lysis Buffer(pH=8.0)重悬菌体,加溶菌酶至终浓度为1mg/mL,冰上静置30min。超声破碎2×5min后,4℃,13 200r/min离心10min,弃上清,收集沉淀。随后用1mol/L尿素漂洗沉淀2次,洗去不溶性碎片后,13 200r/min离心10min后收集沉淀。最后采用变性的方法,8mol/L尿素重悬沉淀。超声破碎2min,相同条件下离心后,收集上清。4℃、旋转条件下,目的蛋白与Ni-NTA结合3h。采用梯度洗脱纯化目的蛋白,咪唑终浓度分别为40、60、80、300、400、900mmol/L,在300、400mmol/L咪唑浓度范围内收集目的蛋白。同时采用梯度透析方法进行蛋白透析,透析液(咪唑、磷酸缓冲液PBS)中尿素终浓度分别为6、4、1、0mol/L,4℃ 磁力搅拌器搅拌下,每个梯度透析液工作45min。最终收集蛋白,测定蛋白浓度OD280。
1.2.5 重组蛋白 HBc/PEP-3的检测 纯化样品及透析后样品与2×SDS Loading Buffer混匀后,95℃变性10min,冰上放置2min。随后分别进行SDS-PAGE和 Western Blot检测。
HBc/PEP-3样 品 经 10%SDS-PAGE 进 行 分离,电泳条件为80V,30min,当进入分离胶时,电泳条件改变为200V,24min。随后采用半干法转至PVDF(聚偏二氟乙烯膜)膜上,条件为:13V,35 min。1%脱脂牛奶-PBST溶液,4℃封闭PVDF膜,过夜。一抗为小鼠抗His抗体(His·tag mAb 1∶800稀释),室温下孵育2h,PBST洗涤3×8 min。二抗为辣根过氧化物酶标记的山羊抗小鼠IgG抗体(1∶10 000稀释),室温下孵育二抗1.5h,PBST洗涤3×5min,后PBS洗涤3×4min。随后进行ECL显色。实验中以不带His·tag的GST蛋白为阴性对照,以带 His·tag的Glrx3-6His蛋白为阳性对照。上述两种对照蛋白均为本实验室以往表达并验证过的蛋白。
2 结果
2.1 HBc-BS 片段基因的扩增
通过PCR扩增获得基因片段F1及F2,其长度分别为 230、300bp(见图1a),然后采用 Overlap PCR法扩增HBc-BS片段,扩增产物经1%琼脂糖凝胶电泳分析,获得一条558bp的特异性条带,大小与预期结果相符(见图1b),结果表明HBc-BS全长片段扩增成功。最终测序表明,所获得HBc基因片段中第78—82位氨基酸缺失,且HBc MIR的两侧成功引入两个单一特异性的酶切位点BamHⅠ及SfuⅠ。HBc-BS的片段示意图(见图1c)。

图1 HBc-BS基因PCR扩增产物电泳图及其结构示意图Fig.1 Electrophoretic profile of PCR products and structure schematic diagram of HBc-BSa.HBc-BS 的PCR结果,M:DNA marker;1:HBc-BS F1片段。2:HBc-BS F2片段。b.HBc-BS 全长的PCR结果,M:DNA marker;1:HBc-BS 全长。c.HBc-BS 基因片段图。
2.2 原核表达通用载体pRGHBc-BS/Lac Zα的构建与鉴定
通过BamHⅠ和XhoⅠ位点将多克隆位点片段连入pET-28a(+)载体,经测序确认,载体中158 bp处的BamHⅠ位点成功被突变,同时EcoRⅠ、BamHⅠ、SfuⅠ、XhoⅠ单一酶切位点被成功引入载体,表明质粒pET-28a(+)/BX正确构建。
通过EcoRⅠ、XhoⅠ位点将HBc-BS片段连入pET-28a(+)/BX载体中,获得重组质粒pRGHBc。质粒pRGHBc经HBc-BS两端的内切酶EcoRⅠ、XhoⅠ双酶切,得到约560bp条带,表明基因片段HBc-BS成功连入pET-28a(+)/BX,确定为阳性。质粒pET-28a(+)/BX作为对照,被相同的内切酶双切后,未得到条带(见图2a中的1、2泳道)。
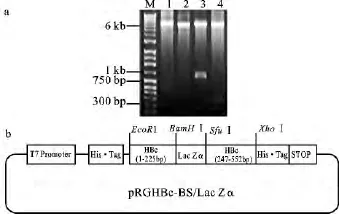
图2 pRGHBc-BS/Lac Zα酶切鉴定图及其载体示意图Fig.2 The enzyme digestion and structure schematic diagram of universal expression vector pRGHBc-BS/Lac Zαa.pRGHBc-BS/Lac Zα的酶切鉴定图,M:DNA marker;1:EcoRⅠ&XhoⅠ双切 pRGHBc;2:EcoRⅠ&XhoⅠ双切pET-28a(+)/BX;3:BamHⅠ&XhoⅠ双切pRGHBc-BS/Lac Zα;4:BamHⅠ& XhoⅠ双切pRGHBc。b.pRGHBc-BS/Lac Zα的载体结构图。
通过BamHⅠ、SfuⅠ位点将Lac Zα片段连入pRGHBc载体中,获得重组质粒pRGHBc-BS/Lac Zα。重组质粒经内切酶BamHⅠ、XhoⅠ双酶切,得到约800bp条带,确定为阳性。质粒pRGHBc作为对照,经相同的内切酶双切后,得到约200bp条带(见图2a中的3、4泳道)。电泳结果表明Lac Zα成功连入pRGHBc表达载体中,为采用一步连接法将抗原小肽连入HBc,原核表达融合蛋白奠定基础。以上实验结果表明,pRGHBc-BS/Lac Zα表达载体构建成功(见图2b)。
2.3 pRGHBc-BS/PEP-3载体的构建及鉴定
PEP-3基因片段通过BamHⅠ、SfuⅠ位点将pRGHBc-BS/Lac Zα载体中的Lac Zα片段替代,获得重组质粒 pRGHBc-BS/PEP-3。质粒 pRGHBc-BS/PEP-3和pRGHBc-BS/Lac Zα经EcoRⅠ、SfuⅠ双切,前者得到约250bp条带,后者得到约800bp条带,二者结果对比得出,PEP-3片段成功替代Lac Zα片段,连入pRGHBc表达载体(见图3a)。同时,以HBc基因的上游引物P1及PEP-3基因片段的下游引物L2作为引物、重组质粒pRGHBc-BS/PEP-3作为模板,采用PCR法进行鉴定。PCR扩增得到230bp大小条带,琼脂糖凝胶电泳结果与理论推断相符(见图3b)。最后测序结果也证实,pep-3已成功克隆到上述表达载体中。以上实验结果表明,pRGHBc-BS/PEP-3载体构建成功(见图3c)。

图3 pRGHBc-BS/PEP-3酶切鉴定图及载体示意图Fig.3 The schematic diagram and identification of expression vector pRGHBc-BS/PEP-3a.pRGHBc-BS/PEP-3的酶切鉴定图,M:DNA marker;1:EcoRⅠ&SfuⅠ双切 pRGHBc-BS/PEP-3;2:EcoRⅠ&SfuⅠ双切pRGHBc-BS/Lac Zα。b.pRGHBc-BS/PEP-3的PCR鉴定结果,M:DNA marker;1:PCR结果;2:阴性对照。c.pRGHBc-BS/PEP-3的载体结构图。
2.4 HBc/PEP-3融合蛋白的原核表达及纯化
重组质粒pRGHBc-BS/PEP-3转化大肠杆菌BL21(DE3),经IPTG诱导表达融合蛋白 HBc/PEP-3。表达产物经超声裂解后,采用Ni-NTA柱对表达的HBc/PEP-3重组蛋白进行亲和纯化。纯化目的蛋白进行蛋白复性后再次测定浓度,所获得的融合蛋白浓度大约为0.6mg/mL。HBc/PEP-3融合蛋白经纯化后,经SDS-PAGE电泳显示所得到的蛋白分子量大小约27kDa(见图4a剪头所示),与预测的分子量相吻合。通过Western blot进一步验证,得到分子量约27kDa的单一条带。以上实验结果表明,HBc/PEP-3表达与纯化成功,为下一步的实验奠定了基础。

图4 融合蛋白HBc/PEP-3原核表达纯化产物的SDS-PAGE分析及其Western blot鉴定Fig.4 SDS-PGAE profile and Wstern blot identification of fusion protein HBc/PEP-3expressed from prokaryotic expression vectora.融合蛋白 HBc-PEP3的SDS-PAGE分析,箭头所指为目的蛋白;1:洗脱液1,咪唑浓度为300mmol/L;2:洗脱液;2:咪唑浓度为400mmol/L。b.Western Blot鉴定;M:蛋白 Marker;1:融合蛋白 HBc/PEP-3;2:阴性对照蛋白GST;3:阳性对照蛋白Glrx3-6His。
3 讨论
本研究成功构建了表面呈现抗原小肽的HBc类病毒颗粒的通用原核表达载体。同时在此基础上,进行了嵌有PEP-3小肽的 HBc/PEP-3融合蛋白的原核表达载体的构建、表达及纯化,并通过Western blot对所表达的融合蛋白进行鉴定。实验结果表明,该通用载体的构建提高了嵌有抗原表位小肽的HBc类病毒颗粒的原核表达,降低了实验成本,可为深入研究各种小肽在肿瘤疫苗治疗中的作用提供良好的实验平台。以PEP-3小肽为例所获得的HBc-PEP-3融合蛋白将在肿瘤疫苗的研发及单克隆抗体的制备中发挥作用。
近年来,以HBc作为免疫载体蛋白在肿瘤免疫治疗方面显示出巨大的应用前景。相关研究利用HBc-VLPs进行抗原的递呈,如 Ravin NV等人[11]利用携带有M2蛋白的HBc-VLPs制备流感疫苗;或者利用HBc-VLPs高效的外源序列展示效果,进行特异性抗体的制备,如Sun Chang等人[12]在HBc-VLPs的抗原展示系统上,获得了针对AFP、MGAE-1的多克隆抗体。本研究寄希望于借助HBc免疫原性高,可携带高拷贝数免疫抗原等特点[13],将抗原表位小肽嵌合至HBc表面,获得表面呈现抗原表位小肽的HBc-VLPs,制备具有高效特异免疫原性的抗原蛋白,为肿瘤免疫治疗或抗体制备提供良好的抗原来源。
相关文献报道,来源于EGFRvⅢ特异性小肽的疫苗接种对脑部肿瘤的治疗效果显著[14],本研究以PEP-3为例,将PEP-3基因插入HBc基因的225 bp处,使其在大肠杆菌BL21(DE3)中表达融合蛋白HBc/PEP-3。结果表明:重组基因可在大肠杆菌中表达,融合蛋白主要以包涵体的形式存在于菌体中。融合蛋白HBc/PEP-3的表达为后续研究抗原融合蛋白在恶性脑胶质母细胞瘤动物模型体内引发免疫应答[15-16],及针对肿瘤的疫苗治疗研究等奠定实验基础。
文献报道HBc核心蛋白单体MIR区域插入外源抗原小肽后,仍能够形成由240个亚基聚集而成正二十面体壳粒结构[1],根据 HBc蛋白单体及HBV衣壳蛋白二聚体的结构模式图分析[17],单体结构中蛋白C端可能游离暴露在外端,而经包装后,C端则会被包裹在 HBc-VLPs内部,从而对HBc/抗原小肽融合蛋白的纯化造成影响。此猜想在本试验实验过程中,通过亲和层析、Western blot试验均得到验证(结果未显示)。关于HBc蛋白聚集成二聚体或颗粒结构的详细组装过程,仍需进一步研究。为了提高蛋白纯化效率及纯度,本实验选择了在目的蛋白N端和C端均表达6His·tag的商业化载体pET-28a(+),此商业化载体经改造后用于表达嵌有抗原表位小肽的HBc融合蛋白的表达与纯化。同时,分别采用非变性法(1×Lysis buffer溶解蛋白)和变性(8mol/L尿素溶解蛋白)进行蛋白纯化,结果发现8mol/L尿素处理蛋白后,对亲和镍柱的结合效率明显高于非变性法处理效果。其次,实验结果与预实验(全菌液蛋白直接进行纯化)结果相较,大肠杆菌自身表达的蛋白大部分溶解在1×Lysis buffer中,沉淀中杂蛋白含量较少,多数为目的蛋白。因此为了减少其他杂蛋白在纯化过程中的非特异性结合,本实验采取提取包涵体的方法进行目的融合蛋白的纯化。
4 结论
本文成功构建了表面呈现抗原小肽的HBc融合蛋白的原核通用表达载体,借此通用载体可实现表面呈递抗原小肽的HBc融合类病毒颗粒表达载体的构建。实验利用通用载体成功构建表达载体pRGHBc-BS/PEP-3,并在大肠杆菌中成功表达和纯化融合蛋白HBc/PEP-3。本实验对此通用载体所表达的融合蛋白的纯化条件进行了探索,初步获得了利用此载体进行融合蛋白的表达和纯化策略,为该载体以后在基于HBc的表位抗原表达及其在疫苗等应用研究方面奠定了基础。
[1]Francis M J,Hastings G Z,Bronw A L,et al.Immunological properties of hepatitis B core antigen fusion proteins[J].Proceedings of National Academy of Science of United States of America,1990,87:2545-9.
[2]Elisa Crisci,Juan Barcena,Maria Montoya.Virus-like particles:The new frontier of vaccines for animal viral infections[J].Veteinary Immunology and Immunopathology,2012,148:211-225.
[3]Pumpens P,Grens E.HBV core particles as a carrier for B cell/T cell epitopes[J].Intervirology,2001,44(2/3):98-114.
[4]Pumpens P,Grens E.Hepatitis B core particles as a universal display model:A structure-function basis for development[J].FFBS Letters,1999,442(1):1-6.
[5]Dhanasooraj D,Kumar R A,Mundayoor S.Vaccine delivery system for tuberculosis based on nano-sized hepatitis B virus core protein particles[J].International Journal of Nanomedicine,2013,8:835-843.
[6]Moscatello D K,Holgado-Madruga M,Godwin A K,et al.Frequent expression of a mutant epidermal growth factor receptor in multiple human tumors[J].Cancer Research,1995,55(23):5536-5539.
[7]Heimberger A B,Hlatky R,Suki D,et al.Prognostic effect of epidermal growth factor receptor and EGFRvⅢin glioblastoma multiforme patients[J].Clinical Cancer Research,2005,11(4):1462-66.
[8]Bigenr S H,Humphrey P A,Wong A J,et al.Characterization of the epidermal growth factor receptor in human glioma cell lines and xenografts[J].Cancer Research,1990,50:8017-8022.
[9]Li G,Mitra S,Wong A J.The epidermal growth factor variantⅢpeptide vaccine for treatment of malignant gliomas[J].Neurosurgery Clinics of North America,2010,21:87-93.
[10]Moscatello D K,Ramirez G,Wong A J.A naturally
occurring mutant human epidermal growth factor receptor as a target for peptide vaccine immunotherapy of tumors[J].Cancer Research,1997,57(8):1419-1424.[11]Ravin N V,Kotlyarov R Y,Mardanova E S,et al.Plant-produced recombinant influenza vaccine based on virus-like HBc particles carrying an extracellular domain of M2protein[J].Biochemistry Biokhimiia,2012,77(1):33-40.
[12]Sun Chang,Ding Feixiang,Wang Fang,et al.Screen of multifunctional monoclonal antibodies against hepatitis B core virus-like particles[J].Microbiology and Immunology,2009,53:340-348.
[13]Kratz P A,Bottcher B,Nassal M.Native display of complete protein domains on the surface of hepatitis B virus capsids[J].Proceedings of National Academy of Science of United States of America,1999,96(5):1915-1920.
[14]Heimberger A B,Crotty L E,Archer G E,et al.Epidermal growth factor receptor vⅢpeptide vaccination is efficacious against established intracerebral tumors[J]. Clinical Cancer Research,2003,9 (11):4247-4254.
[15]段小艺,王健生,郭佑民.EGFR vⅢ与HBcAg重组疫苗抗肿瘤作用的实验研究[J].细胞与分子免疫学杂志.2007,23(7):600-602.
[16]Anhua Wu,Jing Xiao,Lars Anker,et al.Identification of EGFR vⅢ-derived CTL epitopes restricted by HLA A0201for dendritic cell based immunotherapy of gliomas[J].Journal of Neuro-oncology,2006,76(1):23-30.
[17]Wynne S A,Crowther R A,Leslie A G.The crystal structure of the human hepatitis B virus capsid[J].Molecular Cell,1999,3:771-780.
