有机电解液型锂空气电池空气电极研究进展
2015-04-27罗仲宽尹春丽吴其兴李豪君魏蒙蒙
罗仲宽,尹春丽,吴其兴,王 芳,黄 洋,李豪君,魏蒙蒙
深圳市新型锂离子电池与介孔材料重点实验室,深圳大学化学与化工学院,深圳 518060

【材料科学 / Materials Science】
有机电解液型锂空气电池空气电极研究进展
罗仲宽,尹春丽,吴其兴,王 芳,黄 洋,李豪君,魏蒙蒙
深圳市新型锂离子电池与介孔材料重点实验室,深圳大学化学与化工学院,深圳 518060
有机电解液体系的锂空气电池因其超高能量密度受到广泛关注. 为寻求高性能、安全实用的锂空气电池,国内外就正极材料、催化剂、电解液和锂负极等开展了大量研究,其中空气电极的优化、电解液的稳定性是锂空气电池高性能发挥的关键. 介绍了近年有机电解液锂空气电池空气电极上的反应机理、空气电极影响因素、正极材料和催化剂等最新研究进展,分析了各类多孔材料和催化剂的优缺点,及其对电池电化学性能的影响,结合本课题组研究成果,指出了锂空气电池空气电极的发展方向,即结合新型复合氧化物催化剂,构筑独特的多孔电极结构,以实现高容量、长寿命的锂空气电池.
应用化学;锂空气电池;空气电极;反应机理;碳材料;催化剂
为应对能源和环境两大全球性问题,人们对可再生能源(太阳能、风能和潮汐能等)的应用研究不断加深,与此同时,也对电能存储系统(如燃料电池、锂硫电池和金属-空气电池等)进行了广泛深入的探索. 目前,锂离子电动车的电池能量密度即将达到其理论极限,严重制约着电动汽车的续驶里程,且电池造价占到了整车成本的65%[1]. 锂空气电池技术作为后锂离子时代的一种新型电池技术,具有5 200 W·h/kg的超高能量密度(考虑锂片和O2的质量),是锂离子电池体系(150 W·h/kg)的数十倍,预计可驱动电动汽车行驶500 km以上,接近汽油燃料汽车的行驶能力. 文献[2]指出,锂空气电池的研究已获日本(NEDO(New energy and industrial technology development organization)和Rising项目)、美国(DOE(Department of energy)和EIH(Energy innovation hub)项目)、中国(科技部973项目)政府的国家重点研究资助. 近年关于锂空气电池的研究报道越来越多,涉及电解液、空气电极和催化剂等方面,涵盖整个电池体系研究进展的更新速度也较快.
锂空气电池的超高比能量来自两个方面:一是锂空气电池的正极活性物质(O2)直接从外界汲取而不存储在电池中;二是电池的负极材料金属锂拥有固体材料中的最高的比容量(3.862 A·h/g)和最低的电极电势(-3.04 V)[3]. 然而,锂空气电池还处于研究初期,要实现应用还面临着重大挑战,特别是电池组件材料的长寿命可循环充电性能仍有待提高. 本文针对近年来有机体系锂空气电池空气电极上的反应机理、影响因素、正极材料及催化剂的研究进展作详细介绍.
1 有机体系锂空气电池及反应机理
1996年,Abraham等[4]最先报道了有机体系的Li/LiPF6-聚丙烯腈/O2的锂空气电池,该电池达到了250~350 W·h/kg的能量密度,远高于现有的锂离子电池. 2006年,Ogasawara等[5]建立了基于碳酸酯类电解液体系的锂空气电池,首次实现了50次循环后,电池仍能保持600 mA·h/g的容量. 此后,锂空气电池的研究在国内外广泛开展起来. 根据电解液的不同,锂空气电池可分为有机电解液型、水系电解液型、有机-水混合电解液型以及全固态电解质型4类. 有机电解液型锂空气电池结构相对简单,理论上的能量密度最高,体系较为稳定,且由于无水环境包围锂片,电池的整体安全性较高,因而倍受关注.
有机电解液体系锂空气电池以金属锂作负极,多孔材料为正极(如碳纳米管和多孔金等),从空气中汲取的O2为正极活性物质,碳酸酯类、砜类、醚类或腈类等有机物搭配锂盐为锂空气电池电解液体系[6-7]. 目前研究中,乙二醇二甲醚(1,2-dimethoxyethane,DME)[8]、四乙二醇二甲醚(tetraethylene glycol dimethyl ether, TEGDME)[9]和二甲基亚砜(dimethyl sulfoxide, DMSO)[10]作为电池电解液的情况较多. 学界对于有机体系的氧化还原机制(oxygen reductive reaction/oxygen evolution reaction, ORR/OER)有不同的见解[11-14],一般认为:① 通过两电子过程,O2在正极表面直接被还原,与Li+结合生成Li2O2[13]

(1)
(2)
(3)
② 通过一电子过程O2首先被还原成O2-,与Li+生成不稳定的中间产物LiO2,然后再歧化得到Li2O2[15]
(4)
(5)
(6)
(7)
Cao等[16]在DMSO电解液体系中采用电子顺磁共振测试方法,以5,5-二甲基吡咯啉-N-氧化物(5,5-dimethyl-1-pyrroline N-oxide ,DMPO)为捕捉物,在放电过程中成功捕获O2-(在充电过程中未检测到O2-),提出氧化还原机制为:放电时,O2在空气电极上被还原成O2-,与Li+结合生成LiO2后再发生歧化反应得到Li2O2;在充电过程中,Li2O2直接被还原产生O2,不形成任何中间体,同时释放Li+. 放电过程中生成的Li2O2导电性极差,不溶于有机电解液,而是停留在正极表面. 大量的Li2O2会增大电极的阻抗,从而引起充电电压增大,另一方面,大量的Li2O2会严重堵塞空气电极内部的孔道,甚至破坏电极的微观结构,致使电池循环性能恶化,甚至放电终止[17].
2 影响空气电极性能的因素
空气电极用来提供锂离子、电子和氧气的三维传输通道和反应的活性位置,为放电产物Li2O2提供储存空间. 图1简要描述了锂空气电池的简单结构及三相反应界面处电解液在电池正极的分布情况. 图1(a)中负极锂释放的Li+穿过隔膜与空气中的O2及外电路来的e-在三相界面接触,发生反应. 因此,具有多孔结构的空气电极是决定电池性能的关键部件之一,而正极的比表面积、多孔情况以及被电解液湿润的程度则是体现正极性能优劣的重要参数[18-19].
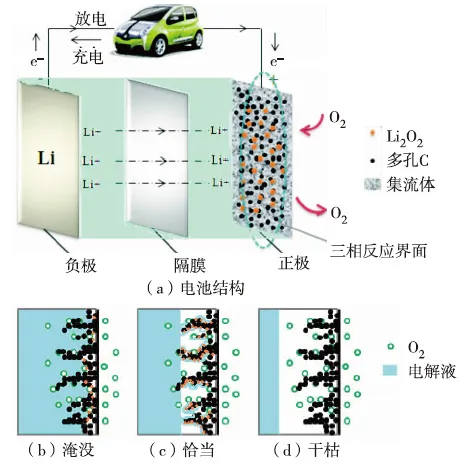
图1 锂空气电池结构示意图和电解液在正极的分布Fig.1 Schematic of Li-air battery structure and electrolyte distribution in cathode
空气电极的比表面积是影响电池性能的重要因素之一,但并不是比表面积越大,电池性能越佳,反而电极孔体积、孔径大小对电池性能的影响更大[20]. 孔体积大,就有足够空间容纳放电产物,延缓因放电产物堵塞导致的放电终止. 孔径是选择空气电极材料的重要参数,孔径太小,孔道易被放电产物充满,不利于氧气的传输,太大则会造成孔的浪费[21]. 由于放电产物不导电且存在不完全分解,当其附着在正极表面时,会导致多孔电极的有效孔径减小、微孔被完全堵塞,产生厚Li2O2膜,从而阻止电子的传导过程,导致表面失效[22]. 因此,设计合理的多孔电极结构,对解决放电产物的存放问题,促进放电产物的分解,改善电池性能至关重要,如中空球形碳[23]、自支撑式[24]空气电极的设计. 电解液对正极的湿润情况如图1(b)—(d),分为3种状态:完全淹没、恰当湿润和干枯. 完全淹没可能赌塞微孔,不利于氧进入电极孔内发生反应;干枯(即基本不湿润)则会大大减小三相界面反应的有效面积;因此,恰当的湿润才能提供最大的三相反应界面,这对电极的反应至关重要[19].
另外,正极厚度对电池容量的影响也不可忽视. Li等[25]通过建立一个二维、非等温的理想态模型并结合数学分析指出,当电极的厚度分别为75、200、400、600和800 μm时,对应的放电比容量在该模型设定下分别为2 151、1 500、980、696和526 mA·h/g,所以正极负载的碳材料厚度越大,电子和O2等的传输阻力越大,导致放电容量越小,孔隙利用率越低. 除此之外,颗粒大小、涂膜方法、集流体材质以及催化剂等都对正极的电化学性能有影响[26-27].
因此,一个理想的空气电极应具备:① 高比表面积,以提供大的反应界面;② 优化的孔道结构,以存放放电产物并确保氧气及离子的快速运输;③ 电解液对正极的恰当润湿,以利于三相界面反应;④ 适中的厚度,以减小电子传输阻抗;⑤高活性的催化剂,以改善ORR和OER反应动力学过程.
3 正极基体材料
3.1 碳多孔材料
3.1.1 传统碳多孔材料
经典的锂空气电池正极基体材料大都采用具有多孔结构的商品炭黑,如Ketjin black(KB)、Super P、Vulcan XC-72等,其导电性好、比表面积大,利于电子的传输和界面反应. Park等[28]选用KB(EC600JD、EC300JD)等5种碳材料分别用作锂空气电池的正极并进行性能比较,发现KB EC600JD的放电比容量最大达2 600 mA·h/g(0.1 mA/cm2、1.5 V截止电压),且文献[28-29]研究表明,KB具有较大的孔体积和比表面积,比容量最高. Super P虽然比表面积不大,仅有62 m2/g,但平均孔径在50 nm左右,有利于放电产物的存放,按孔体积比容量计算Super P是KB的7倍[18]. 因此,将KB和Super P按质量比为 5∶1混合,构建双孔正极结构,电池的放电比容量在30 mA/g、2.0 V下达到1 219 mA·h/g,高于单一使用KB(1 005 mA·h/g)或Super P(635 mA·h/g)的电池[18]. 传统碳材料虽然种类多样,价格便宜,但在高于3.5 V时不稳定,易与放电产物反应发生降解,且传统碳的孔结构不足以满足锂空气电池的性能要求,需进一步寻求更为合理的多孔碳.
3.1.2 新型碳多孔材料
溶胶凝胶法和模板法是制备碳多孔材料最常用的方法,成本低廉且可控调节孔径大小. 利用间苯二酚和甲醛按一定质量比在碳酸钠的催化下混合,经固化、陈化、Ar气氛中碳化以及600~1 200 ℃高温下活化可制得碳气凝胶,调整间苯二酚和甲醛的质量比以及不同的活化温度可有效控制多孔碳材料的比表面积和孔径分布[21, 30-31]. 将碳气凝胶用于锂空气电池可达到4 155 mA·h/g的比容量[32]. 本课题组在利用溶胶凝胶法制备碳气凝胶材料并用以构筑具有双孔结构的空气电极上取得了一定的进展,提升氧气传输速率的同时增大了放电产物的储存空间,使得锂空气电池的循环性能与放电容量同时得到改善[31].模板法是通过模板的孔径来控制目的产物的孔径分布. Nie等[33]以两种不同粒径的SiO2胶体为硬模板合成双孔多层结构的模板碳,获得了10 059 mA·h/g的高比容量. 溶胶凝胶法和模板法制备碳多孔材料的合成工艺简单、成本不高,但由于影响因素太多(前躯体的选择,合成条件的控制等),很难制备得到一种理想状态的多孔碳. 如何能确定一组最佳合成条件,且所得材料孔径分布合理,将是锂空气电池正极材料的重点研究方向.
碳纳米管(carbon nanotubes, CNTs)和石墨烯(graphene nanosheets, GNSs)具有独特的结构特征和良好的导电性,近年来也被广泛用于锂空气电池的空气电极,突出表现为电池容量的提升和循环的稳定性. Chen等[34]利用浮动催化法将多壁碳纳米管互穿制备得到一种三维孔道结构的材料,并直接用于空气电极,在双三氟甲基磺酸亚胺锂/三甘醇二甲醚(LiTFSA/G3)的电解液体系、0.5 A/g的电流密度下,容量可达34 600 mA·h/g,若限制在1 000 mA·h/g、0.25 A/g,电池稳定循环50圈后基本没有明显的过电势增加.另外,近年采用N掺杂的CNTs(即N-CNTs)或是在CNTs中添加催化剂作为空气电极的研究较多. N原子的加入使得N最外层电子与碳π键相结合,进而可修饰碳纳米管结构,利于放电产物覆盖在正极表面,有优化孔结构和提升电池容量的倾向[35-36],催化剂则可在CNTs表面更好的发挥催化效应. Lim等[37]以Pt作催化剂制备CNTs/Pt电极,在2 A/g的条件下可循环130圈,有效地提高了电池的循环性能,即使是完全充放电测试也能循环100圈,是当前锂空气电池的一大突破.

图2 催化剂在碳基体上的沉积[41]Fig.2 Deposition of catalyst on carbon substrate[41]
GNSs的每个碳原子均为sp2杂化,p轨道上的剩余电子可形成大π键,π电子能自由移动,赋予GNSs良好的导电性[38]. 理想的单层GNSs具有超大的比表面积(2 630 m2/g)[39],可提供较大的反应场所,且其独特的结构特征有利于氧气的扩散,促进O2和Li+在正极表面充分接触. 文献[40]的研究表明,在相同测试参数下,GNSs电池体系的放电容量可达8 705.9 mA·h/g,而BP-2000和XC-72碳的放电比容量分别为1 909.1 和1 053.8 mA·h/g. 另外,GNSs还有较好的催化作用. 图2(c)和图2(d)中,Co3O4/GNSs为混合催化剂涂覆在碳基体上,GNSs的片状结构使得Co3O4纳米颗粒在碳基体上很好地铺展开,提供更大面积的催化活性区域,而不像图2(a)和图2(b)中的单Co3O4催化剂很容易板结分散不开. 在0.2 mA/cm2,2.5~4.4 V下,Co3O4/GNSs电池在循环10圈后,电池的比容量、电压基本没有发生变化,表现出较好的稳定性[41]. 因此,GNSs确实具有一定的优越性,但和传统碳材料相比,其成本较高.
碳材料种类很多,结构不一,各种性能参数及在电池上的表现差异较大. 表1列出了本节主要涉及的碳空气电极材料的最高比容量,并简要了描述其优缺点.

表1 碳多孔材料空气电极性能比较
3.2 非碳多孔材料
碳多孔材料是目前锂空气电池应用最广泛的正极材料. 然而,直到文献[8]报道采用LiNO3/DME电解液体系消除充电过程中碳正极的钝化之前,还没有无CO2释放的锂空气电池(正极为碳). Bruce团队[42]在研究中发现,碳材料在充电电压低于3.5 V时较稳定,而当电压高于3.5 V时,易被氧化生成Li2CO3,并会促进电解液(如TEGDME和DMSO)的分解,对Li2O2形成或分解的可逆循环性造成障碍,严重影响电池的电化学性能. 所以,避开碳材料空气电极,而采用非碳多孔空气电极可减少副反应的发生. Bruce团队先是选用纳米多孔金(nanoporous gold, NPG),较大的比表面积和合适的孔径分布满足锂空气电池空气电极的要求. 以NPG为正极,锂片作负极,0.1 mol/L LiClO4/DMSO为电解液构建电池体系,当电流密度为500 mA/g,循环100圈后,电池剩余容量还有95%[10]. 但NPG较高的造价使电池的成本成倍增加,而且其质量较大,打破了锂空气电池轻便这一重要优势. 因此,该团队又以TiC替换NPG电极,在0.5 mol/L的LiClO4/DMSO 电解液体系,1 A/cm2的电流密度下循环100圈后,剩余容量仍达到98%,表现出较好的稳定性和可行性[43]. 近期,Zhao等[44]首次采用TiO2纳米管阵列覆盖在Ti泡沫上,并以Pt作催化剂制备电极,无任何碳材料和黏结剂的添加. 得益于TiO2在充放电过程中优良的稳定性,在1 000 mA·h/g、1 A/g的条件下,电池循环了140圈,甚至在5 A/g的电流密度下,也成功实现了150次循环,值得人们关注.
到目前为止,关于非碳正极的研究还不广泛,却是一个很好的研究方向. 一方面,NPG、TiC和TiO2等自身具有良好催化效应;另一方面,能避免碳材料作为电极的缺陷. 若没有好的方法解决碳正极的化学稳定性,非碳正极将会很快被广泛采纳.
4 正极催化剂
现阶段,锂空气电池的充电电压高,循环寿命短、效率低,阻碍其商业化生产.催化剂可改善充放电电化学过程的动力学行为,提高放电电压平台,降低充电电压平台,延长电池寿命提升电池循环效率. 因此,国内外开展了众多的研究,致力于设计和开发合理的、应用在锂空气电池的空气电极上的催化剂. 其主要分类及进展如下.
4.1 贵金属类催化剂
贵金属如Au、Ag、Pt、Pd、Ir和Ru等常用作锂空气电池的催化剂,其中,采用Pt和Pd作催化剂的电池有最小的过电势,应用较为广泛[45]. 文献[46-47]的研究表明,贵金属在有机电解液体系中可有效促进氧气的电化学反应,且不同金属对氧还原和氧析出的催化能力差别较大. 对于非水电解液中Li+参与的氧还原反应,催化活性顺序为Pd>Pt>Ru≈Au>玻碳,但由于Pt和Pd存在d轨道空穴,所以能够最大程度地进行氧还原,有效提高电池的放电电压. Guo等[48]采用具自组装能力的蛋白质纤维为模板制备纳米Pt和Pd作为正极催化剂,电池的放电平台为2.4~2.5 V,充电平台仅为3.7~4.0 V,比纯碳正极电池的充电电压低约0.7 V. Ru、Au和Ag等或两种贵金属的合金催化剂,在电池正极上的应用也表现出良好的催化效应[49-51]. Lu等[50]采用PtAu纳米合金作催化剂,电池在OER过程中,充电电压降低最多有900 mV,而在ORR过程中,放电电压增大了150~300 mV,效果明显.
4.2 金属氧化物类催化剂
过渡金属氧化物催化剂包括MnO2、Fe2O3、Fe3O4、NiO、CuO和Co3O4等.其中,得到广泛研究的是MnO2和Co3O4,其来源广,成本低,且对环境友好. MnO2主要有(α、β、γ和λ)-MnO2几种型号,α-MnO2型对电池性能的提升最为优越. Cao等[52]在GNSs的基体上,得到以α-MnO2为催化剂的电池,呈现出了11 520 mA·h/g的高比容量(以GNS为基体计算),当控制比容量为2 900 mA·h/g时,循环25圈后电压一直保持平稳,没有出现过电势增加的现象. 同样,在GNSs基体中,添加了Co3O4的电池也表现出了良好的电化学性能[53]. Black等[54]在LiPF6/TEGDME的电解液体系下,以生长在还原氧化石墨烯(reduced graphene oxide, Co3O4/RGO)上的Co3O4为混合催化剂,70%的KB多孔碳为基底,构成空气电池,与纯KB正极相比,Co3O4/RGO电池的充电平台为3.5~3.75 V,比KB降低了0.35 V,容量也增加了近2 500 mA·h/g,性能得到明显改善.
4.3 复合氧化物类催化剂
除单金属氧化物外,由两种或两种以上金属元素组成的钙钛矿型和烧绿石型复合氧化物也被用于空气电极. 钙钛矿型催化剂具阳离子阵列的结构稳定性,可容纳移动氧离子,且多空位,具有较高的电子/离子电导率和催化活性. Xu等[55]首次利用加热静电纺丝技术可控合成了多孔纳米钙钛矿氧化物作为锂空气电池催化剂(图3),这种多孔纳米管状结构不仅有利于增加催化剂的活性位点,同时也可以合理调控空气电极的孔道结构,有利反应物的传质. 由于该催化剂的添加,锂空气电池首次实现了比容量高于10 000 mA·h/g的可逆循环,当控制比容量为1 000 mA·h/g时,电池的循环寿命可达到125次. 近期,Kalubarme等[56]制备了一系列的LaNixCo1-xO3-δ型催化剂,其中,LaNi0.25Co0.75O3-δ以最大放电容量7 720 mA·h/g表现出优越的催化效应. 烧绿石结构的复合氧化物(A2B2O6O)由Oh等[57]成功合成,此结构氧化物表现出较高的比容量(>10 000 mA·h/g)及较好的容量保持率:循环3次后,比容量依然能保持8 000 mA·h/g以上,且其释放氧的活性也有较大提高.

图3 钙钛矿催化剂的合成路线[55]Fig.3 Synthesis route of perovskite catalyst[55]
贵金属、过渡金属氧化物及复合氧化物催化剂在锂空气电池的应用中各有利弊:贵金属催化效应好,价格昂贵;过渡金属氧化物虽成本低,但该类催化剂催化活性的稳定性能还无法与贵金属相媲美,若能开发一种该类的催化剂,成功提升电池性能,并直接取代贵金属催化剂,必将大大降低电池成本;复合氧化物是一种新型催化剂,对电池性能有明显改善,发展空间广阔.到目前为止,还没有一种催化剂能完美匹配锂空气电池,因此,需要更深入的探索.
4.4 其他催化剂
除上述催化剂外,聚合物、Li2O2和N修饰等也可用作催化剂提升电池电化学性能.

图4 添加可溶性LiI催化剂的聚多巴胺-CNTs电极反应示意图[59]Fig.4 Schematic of reactions on the polydopamine-coated CNTs electrode with the dissolved LiI catalyst[59]
图5 VA-NCCF电极的循环性能图[62]Fig.5 Rate performance of the VA-NCCF electrode[62]
锂空气电池具有超高的理论比能量,其潜在开发价值高,应用前景广阔. 用于电动车充电一次,可行驶500 km以上. 近年,锂空气电池的研究取得了一定的成果,但要将锂空气电池用于人们实际生活尚面临许多挑战:电化学性质稳定的电解液、合适的正极材料及修饰、有效催化剂的开发及优化空气电极结构的设计等. 综上所述,碳气凝胶、模板碳可以调控碳材料微孔结构,且其制备工艺较为简便,但合成技术尚不成熟,还需要进一步的深入探索. 碳纳米管和石墨烯均具有独特的微观结构,在锂空气电池中表现了高比容量、高倍率、长寿命等优异的电池性能. 如果采用一种合适的催化剂对这些碳材料进行改性,将使锂空气电池有着更好的发展. 同时,空气电极结构的优化可有效提升电池的电化学性能的稳定性及循环寿命. 因此,在构筑双孔结构的基础上,本课题组将进一步深入探索锂空气电池的电化学过程和机理,结合稳定电解液的发展,从催化剂、正极材料优选及结构优化等方面共同促进锂空气电池综合性能的提升,以加快其实用化和商业化进程.
除空气电极外,负极锂也是影响锂空气电池高性能、长寿命发挥的一大问题.虽然锂本身有高比容量和低电极电势,但其在反复的充放电过程中会形成不均匀沉积,引起树枝样的结晶,如果结晶穿过隔膜则会引起电池内部短路,存在严重的安全隐患,而且半开放的体系环境使负极表面发生副反应的几率增加,导致库伦效率较低[6,64]. 因此,采取某种手段使负极锂表面形成一层保护膜或钝化膜,从而抑制锂枝晶的生长和副反应的发生,将是锂空气电池能够从实验研究进入实际应用的必要前提.
/ References:
[1] Rahman M A, Wang X, Wen C. A review of high energy density lithium-air battery technology[J].Journal of Applied Electrochemistry, 2013, 44(1): 5-22.
[2] Guo Xiangxin, Huang Shiting, Zhao Ning, et al. Rapid development and critical issues of secondary lithium-air batteries[J]. Journal of Inorganic Materials, 2014, 29(2): 113-123.(in Chinese) 郭向欣, 黄诗婷, 赵 宁, 等. 二次锂空气电池研究的快速发展及其急需解决的关键科学问题[J]. 无机材料学报, 2014, 29(2): 113-123.
[3] Hu Xinguo. Power battery technology and application[M]. Beijing: Chemical Industry Press, 2013: 277-290.(in Chinese) 胡信国. 动力电池技术与应用[M]. 北京: 化学工业出版社, 2013: 277-290.
[4] Abraham K M, Jiang Z. A polymer electrolyte-based rechargeable lithium oxygen battery[J]. Journal of the Electrochem Society, 1996, 143(1): 1-5.
[5] Ogasawara T, Debart A, Holzapfel M, et al. Rechargeable Li2O2electrode for lithium batteries[J]. Journal of the American Chemical Materials, 2006, 128(4): 1390-1393.
[6] Lu Jun, Li Li, Park J B, et al. Aprotic and aqueous Li-O2batteries[J]. Chemical Reviews, 2014, 114: 5611-5640.
[7] Balaish M, Kraytsberg A, Ein-Eli Y. A critical review on lithium-air battery electrolytes[J]. Physical Chemistry Chemical Physics, 2014, 16(7): 2801-2822.
[8] Kang S J, Mori T, Narizuka S, et al. Deactivation of carbon electrode for elimination of carbon dioxide evolution from rechargeable lithium-oxygen cells[J]. Nature Communications, 2014, 5: 3937-3943.
[9] Jung H G, Hassoun J, Park J B, et al. An improved high-performance lithium-air battery[J]. Nature Communications, 2012, 4(7): 579-585.
[10] Peng Zhangquan, Freunberger S A, Chen Yuhui, et al. A reversible and higher-rate Li-O2battery[J]. Science, 2012, 337(6094): 563-566.
[11] Peng Zhangquan, Freunberger S A, Hardwick L J, et al. Oxygen reactions in a non-aqueous Li+electrolyte[J]. Angewandte Chemie International Edition. 2011, 123(28): 6475 -6479.
[12] Chen Yuhui, Freunberger S A, Peng Zhangquan, et al. Li-O2battery with a dimethylformamide electrolyte[J]. Journal of the American Chemical Society, 2012, 134(18): 7952-7957.
[13] Mccloskey B D, Scheffler R, Speidel A, et al. On the mechanism of nonaqueous Li-O2electrochemistry on C and its kinetic overpotentials: some implications for Li-air batteries[J].The Journal of Physical Chemistry C, 2012, 116(45): 23897-23905.
[14] Nanda J, Bilheux H, Voisin S, et al. Anomalous discharge product distribution in lithium-air cathodes[J]. The Journal of Physical Chemistry C, 2012, 116(15): 8401-8408.
[15] Laoire C O, Mukerjee S, Abraham K M. Influence of nonaqueous solvents on the electrochemistry of oxygen in the rechargeable[J]. Journal of the Physical Chemisty C, 2010, 114(19): 9178-9186.
[16] Cao Ruiguo, Walter E D, Xu Wu, et al. The mechanisms of oxygen reduction and evolution reactions in nonaqueous lithium-oxygen batteries[J]. ChemSusChem, 2014, 7(9): 2436-2440.
[17] Jiang Xie, Liu Xiaofei, Zhao Shiyong, et al. Research progress of organic electrolyte based lithium-air batteries[J]. Acta Chimica Sinica, 2014, 72: 417-426.(in Chinese) 蒋 颉, 刘晓飞, 赵世勇, 等. 基于有机电解液的锂空气电池研究进展[J]. 化学学报, 2014, 72: 417-426.
[18] Zhang Yining, Zhang Huamin, Li Jing, et al. The use of mixed carbon materials with improved oxygen transport in a lithium-air battery[J]. Journal of Power Sources. 2013, 240: 390-396.
[19] Bardenhagen I, Dreher W, Fenske D, et al. Fluid distribution and pore wettability of monolithic carbon xerogels measured by 1H NMR relaxation[J]. Carbon, 2014, 68: 542-552.
[20] Meini S, Piana M, Beyer H, et al. Effect of carbon surface area on first discharge capacity of Li-O2cathodes and cycle-life behavior in ether-based electrolytes[J]. Journal of the Electrochemical Society, 2012, 159(12): A2135-A2142.
[21] Mirzaeian M, Hall P J, Sillars F B, et al. The effect of operation conditions on the performance of lithium/oxygen batteries[J]. Journal of the Electrochemical Society, 2012, 160(1): A25-A30.
[22] Xue K H, Nguyen T K, Franco A A. Impact of the cathode microstructure on the discharge performance of lithium air batteries: a multiscale model[J]. Journal of the Electrochemical Society, 2014, 161(8): E3028-E3035.
[23] Xu Jijing, Wang Zhongli, Xu Dan, et al. Tailoring deposition and morphology of discharge products towards high-rate and long-life lithium-oxygen batteries[J]. Nature Communications, 2013, 4: 2438-2447.
[24] Cui Yanming, Wen Zhaoyin, Liu Yu. A free-standing-type design for cathodes of rechargeable Li-O2batteries[J]. Energy & Environmental Science, 2011, 4(11): 4727-4734.
[25] Li Xianglin, Faghri A. Optimization of the cathode structure of lithium-air batteries based on a two-dimensional, transient, non-isothermal model[J]. Journal of the Electrochemical Society, 2012, 159(10): A1747-A1754.
[26] Ma Zhong, Yuan Xiangxia, Sha Haodong, et al. Influence of cathode process on the performance of lithium-air batteries[J]. International Journal of Hydrogen Energy, 2013, 38(25): 11004-11010.
[27] Li Qing, Cao Ruiguo, Cho J, et al. Nanostructured carbon-based cathode catalysts for nonaqueous lithium-oxygen batteries[J]. Physical Chemistry Chemical Physics, 2014, 16(27): 13568-13582.
[28] Park C K, Park S B, Lee S Y, et al. Electrochemical performances of lithium-air cell with carbon materials[J]. Bulletin of the Korean Chemical Society, 2010, 31(11): 3221-3224.
[29] Xiao Jie, Wang Donghai, Xu Wu, et al. Optimization of air electrode for Li/air batteries[J]. Journal of the Electrochemical Society, 2010, 157(4): A487-A492.
[30] Al-muhtaseb, Ritter J A. Preparation and properties of resorcinol-formaldehyde organic and carbon gels[J]. Advance Materials, 2003, 15(2): 101-114.
[31] Wang Fang, Xu Yanghai, Luo Zhongkuan, et al. A dual pore carbon aerogel based air cathode for a highly rechargeable lithium-air battery[J]. Journal of Power Sources, 2014, 272: 1061-1071.
[32] Ma S B, Lee D J, Roev V, et al. Effect of porosity on electrochemical properties of carbon materials as cathode for lithium-oxygen battery[J]. Journal of Power Sources, 2013, 244: 494-498.
[33] Nie Hongjiao, Zhang Yining, Li Jing, et al. Synthesis of a meso-macro hierarchical porous carbon material for improvement of O2diffusivity in Li-O2batteries[J]. RSC Advances, 2014, 4(33): 17141-17145.
[34] Chen Yong, Li Fujun, Tang Daiming, et al. Multi-walled carbon nanotube papers as binder-free cathodes for large capacity and reversible non-aqueous Li-O2batteries[J]. Journal of Materials Chemistry A, 2013, 1(42): 13076-13081.
[35] Mi Rui, Liu Hao, Wang Hao, et al. Effects of nitrogen-doped carbon nanotubes on the discharge performance of Li-air batteries[J]. Carbon, 2014, 67: 744-752.
[36] Li Yongliang, Wang Jiajun, Li Xifei, et al. Nitrogen-doped carbon nanotubes as cathode for lithium-air batteries[J]. Electrochemistry Communications, 2011, 13(7): 668-672.
[37] Lim H D, Song H, Gwon H, et al. A new catalyst-embedded hierarchical air electrode for high-performance Li-O2batteries[J]. Energy & Environmental Science, 2013, 6(12): 3570-3575.
[38] Huang Shu, Wang Wei, Wang Kangli, et al. Recent progress about graphene for chemical energy storage applications[J]. Energy Storage Science and Technology, 2014, 3(2): 85-94.(in Chinese) 黄 澍, 王 玮, 王康丽, 等. 石墨烯在化学储能中的研究进展[J]. 储能科学与技术, 2014, 3(2): 85-94.
[39] Kim H, Lim H D, Kim J, et al. Graphene for advanced Li/S and Li/air batteries[J]. Journal of Materials Chemistry A, 2014, 2(1):33-47.
[40] Li Yongliang, Wang Jiajun, Li Xifei, et al. Superior energy capacity of graphene nanosheets for a nonaqueous lithium-oxygen battery[J]. Chemical Communications (Cambridge), 2011, 47(33): 9438-9440.
[41] Lim H D, Gwon H, Kim H, et al. Mechanism of Co3O4/graphene catalytic activity in Li-O2batteries using carbonate based electrolytes[J]. Electrochimica Acta, 2013, 90: 63-70.
[42] Ottakamthotiyl M M, Freunberger S A, Peng Zhangquan, et al. The carbon electrode in nonaqueous Li-O2cells[J]. Journal of the American Chemical Society, 2013, 135(1): 494-500.
[43] Ottakamthotiyl M M, Freunberger S A, Peng Zhangquan, et al. A stable cathode for the aprotic Li-O2battery[J]. Nature Materials, 2013, 12(11): 1050-1056.
[44] Zhao Guangyu, Mo Runwei, Wang Baoyu, et al. Enhanced cyclability of Li-O2batteries based on TiO2supported cathodes with no carbon or binder[J]. Chemistry of Materials. 2014, 26(8): 2551-2556.
[45] Dathar G K P,Shelton W A,Xu Y.Trends in the catalytic activity of transition metals for the oxygen reduction reaction by lithium[J]. The Journal of Physical Chemistry Letters, 2012, 3(7): 891-895.
[46] Cheng Fangyi, Chen Jun. Nanoporous catalysts for rechargeable Li-air batteries[J]. Acta Chimica Sinica, 2013, 71(04): 473-477.(in Chinese) 陈方益,陈 军. 可充锂空气电池多孔纳米催化剂[J]. 化学进展,2013,71(04): 473-477.
[47] Gittleson F S, Sekol R C, Doubek G, et al. Catalyst and electrolyte synergy in Li-O2batteries[J]. Physical Chemistry Chemical Physics, 2014, 16(7): 3230-3237.
[48] Guo Guilie, Truong T H A, Tan Huiteng, et al. Platinum and palladium nanotubes based on genetically engineered elastin-mimetic fusion protein-fiber templates: synthesis and application in lithium-O2batteries[J]. Chemistry an Asian Journa, 2014, 9(9): 2555-2559.
[49] Sun Bing, Munroe P, Wang Guoxiu. Ruthenium nanocrystals as cathode catalysts for lithium-oxygen batteries with a superior performance[J]. Scientific Reports, 2013, 3: 2247-2253.
[50] Lu Yichun, Xu Zhichuan, Gasteiger H A, et al. Platinum-gold nanoparticles: a highly active bifunctional electrocatalyst for rechargeable lithium-air batteries[J]. Journal of the American Chemistry Society, 2010, 132(35): 12170-12171.
[51] Li Fujun, Zhang Tao, Zhou Haoshen. Challenges of non-aqueous Li-O2batteries: electrolytes, catalysts, and anodes[J]. Energy & Environmental Science, 2013, 6(4):1125-1141.
[52] Cao Yong, Wei Zhikai, He Jiao, et al. α-MnO2nanorods grown in situ on graphene as catalysts for Li-O2batteries with excellent electrochemical performance[J]. Energy & Environmental Science, 2012, 5(12): 9765-9768.
[53] Sun Chunwen, Li Fan, Ma Chao, et al. Graphene-Co3O4nanocomposite as an efficient bifunctional catalyst for lithium-air batteries[J]. Journal of Materials Chemistry A, 2014, 2(20): 7188.
[54] Black R, Lee J H, Adams B, et al. The role of catalysts and peroxide oxidation in lithium-oxygen batteries[J]. Angewandte Chemie, 2013, 52(1): 392-396.
[55] Xu Jijing, Xu Dan, Wang Zhongli, et al. Synthesis of perovskite-based porous La(0.75)Sr(0.25)MnO3nanotubes as a highly efficient electrocatalyst for rechargeable lithium-oxygen batteries[J]. Angewandte Chemie, 2013, 52(14): 3887-3890.
[56] Kalubarme R S, Park G E, Jung K N, et al. LaNixCo1-xO3-perovskites as catalyst material for non-aqueous lithium-oxygen batteries[J]. Journal of the Electrochemical Society, 2014, 161(6): A880-A889.
[57] Oh S H, Nazar L F. Oxide catalysts for rechargeable high-capacity Li-O2batteries[J]. Advanced Energy Materials, 2012, 2(7): 903-910.
[58] Nasybulin E, Xu W, Engelhard M H, et al. Electrocatalytic properties of poly(3,4-ethylenedioxythiophene) (PEDOT) in Li-O2battery[J]. Electrochemistry Communications, 2013, 29: 63-66.
[59] Yoon T H, Park Y J. New strategy toward enhanced air electrode for Li-air batteries: apply a polydopamine coating and dissolved catalyst[J]. RSC Advances, 2014, 4(34): 17434-17442.
[60] Kim D S, Park Y J. Effect of multi-catalysts on rechargeable Li-air batteries[J]. Journal of Alloys and Compounds, 2014, 591: 164-169.
[61] Lin Xijing, Lu Xu, Huang Tao, et al. Binder-free nitrogen-doped carbon nanotubes electrodes for lithium-oxygen batteries[J]. Journal of Power Sources, 2013, 242: 855-859.
[62] Shui Jianglan, Du Feng, Xue Chenming, et al. Vertically aligned N-doped coral-like carbon fiber arrays as efficient air electrodes for high-performance nonaqueous Li-O2batteries[J]. Article, 2014, 8(3): 3015-3022.
[63] Luo Zhongkuan, Liang Chunsheng, Wang Fang, et al. Optimizing main materials for a lithium-air battery of high cycle life[J]. Advanced Functional Materials, 2013, 24(14): 2101-2105.
[64] Bhatt M D, Geaney H, Nolan M, et al. Key scientific challenges in current rechareable non-aqueous Li-O2batteries: experient and theory[J]. Physical Chemistry Chemical Physics. 2014, 16(24): 12093-12130.
【中文责编:晨 兮;英文责编:新 谷】
Research progress on air electrode in organic electrolyte lithium-air battery
Luo Zhongkuan,Yin Chunli, Wu Qixing, Wang Fang†, Huang Yang,Li Haojun, and Wei Mengmeng
Key Laboratory of New Lithium-ion Batteries and Mesoporous Materials,College of Chemistry and Chemical Engineering, Shenzhen University, Shenzhen 518060, P.R.China
Due to the advantages of ultra-high energy density, lithium-air batteries based on organic electrolyte system have received widespread concern. To seek after a high-performance, safety and applicable lithium-air battery, a lot of scholars have conducted numerous research works on cathode materials, catalysts, electrolyte, and lithium cathode. Air electrode optimization and electrolyte stability are the keys to obtaining high performance lithium-air batteries. We review some of the latest research progress on air electrode reaction mechanisms, influence factors of air electrode, materials for air cathode and catalysts in organic electrolyte lithium-air batteries. Meanwhile, advantages and disadvantages of all kinds of porous materials and catalysts, as well as impact on the electrochemical performance of batteries, were analysed. Based on these studies, we put forward the future direction for air electrodes of lithium-air batteries is to build a unique porous electrode structure with new composite oxide catalysts, to achieve high-capacity, long-life lithium-air batteries.
applied chemistry; lithium-air battery; air electrode; reaction mechanism; carbon materials; catalysts
:Luo Zhongkuan, Yin Chunli, Wu Qixing, et al.Research progress on air electrode in organic electrolyte lithium-air battery [J]. Journal of Shenzhen University Science and Engineering, 2015, 32(2): 111-120.(in Chinese)
O 69
A
10.3724/SP.J.1249.2015.02111
广东省自然科学基金资助项目(S2013040016860);深圳市战略新兴产业发展专项基金资助项目(JCYJ20130329102936684)
罗仲宽(1962—),男(汉族),浙江省岱山县人,深圳大学教授、博士生导师,E-mail:lzk@szu.edu.cn
Received:2014-10-13;Accepted:2014-12-12
Foundation:Natural Science Foundation of Guangdong Province (S2013040016860); Shenzhen Science and Technology Fund (JCYJ20130329102936684)
† Corresponding author:Professor Wang Fang.E-mail: wangfsz@szu.edu.cn
引 文:罗仲宽,尹春丽,吴其兴,等. 有机电解液型锂空气电池空气电极研究进展[J]. 深圳大学学报理工版,2015,32(2):111-120.
