致白内障基因Hsf4b K65R位点突变对下游热休克蛋白表达的影响*
2015-04-27谢盼盼崔秀坤马远方胡延忠河南大学医学院医学与分子免疫学实验室抗体药物河南省工程实验室河南开封475004
娄 强,谢盼盼,崔秀坤,马远方,胡延忠(河南大学医学院医学与分子免疫学实验室,抗体药物河南省工程实验室,河南开封475004)
致白内障基因Hsf4b K65R位点突变
对下游热休克蛋白表达的影响*
娄强,谢盼盼,崔秀坤,马远方,胡延忠△
(河南大学医学院医学与分子免疫学实验室,抗体药物河南省工程实验室,河南开封475004)
[摘要]目的:探讨致白内障基因热休克因子4b(Hsf4b) K65R位点突变对其调控下游热休克蛋白(HSP)表达的影响。方法:采用KOD-Plus-Mutagenesis-Kit试剂盒构建pWZL-blast-HA-Hsf4b/K65R赖氨酸突变质粒;通过慢病毒感染小鼠晶状体上皮细胞mLEC构建稳定表达Hsf4b/K65R突变质粒的细胞株; Western blotting检测Hsf4b 在mLEC K65R点突变细胞株和野生株中的表达; Western blotting及real-timePCR检测K65R点突变后下游蛋白Hsp70、Hsp90、Hsp27和CryAB表达的变化。结果:阳性克隆PCR及基因测序证明慢病毒载体pWZL-blast-HAHsf4b/K65R构建成功。K65R点突变后不影响Hsf4b在小鼠晶状体上皮细胞mLEC中的表达,但能影响下游蛋白CryAB、Hsp27、Hsp70i和Hsp90a的表达。结论: pWZL-blast-HA-Hsf4b/K65R载体可用于慢病毒感染稳定细胞株构建。Hsf4b K65R位点突变能显著影响其对热休克蛋白的调控功能。
[关键词]热休克因子4b;晶状体上皮细胞;热休克蛋白;点突变
先天性白内障是导致儿童失明的主要原因,其主要病理改变为晶状体发育迟缓、晶状体内非透明瘢块组织形成。热休克因子4b(heat shock factor 4b,Hsf4b)主要在晶状体内表达,是调控新生儿期晶状体发育的关键转录因子,其通过调控热休克蛋白(heat shock protein,HSP)和晶状体蛋白的表达影响新生期晶状体上皮细胞的增生和纤维细胞分化[1]。正常情况下,Hsf4蛋白在胚胎E13.5晶状体组织内开始表达,在新生儿期达到高峰,随着晶状体成熟而逐渐减少[2]。敲除小鼠Hsf4基因能使晶状体在新生期发育受阻,晶状体呈现非透明状白内障[3]。在晶状体发育过程中,Hsf4b赖氨酸位点易被类泛素化、乙酰化和泛素化修饰,从而调控Hsf4b转录活性和蛋白稳定性[4-5]。Hsf4 DNA结合域密码错义突变(如L115P、I87V、A20D、R120C和R74H)与家族常染色体显性遗传性白内障的发生密切相关[6-7]。Hsf4b DNA结合域错义突变与人和动物遗传性白内障的发生密切相关[8-10]。然而,Hsf4b DNA结合域赖氨酸位点如何影响其对热休克蛋白的调控仍不清楚。
在本研究中,在前期构建Hsf4-/-小鼠晶状体永生化上皮细胞系的基础上[11],采用定点突变技术将Hsf4b DNA结合域第65位赖氨酸位点错义突变为精氨酸,研究Hsf4b对热休克蛋白表达的调控,进而为研究第65位赖氨酸点的修饰在晶状体发育过程中的调控提供基础。
材料和方法
1菌种、细胞、载体来源
DH5α大肠杆菌本实验室保存; 293T细胞、小鼠晶状体上皮细胞mLEC细胞来自本实验室; PWZL-blast-HA-Hsf4b真核表达载体由本实验室保存。
2主要方法
2.1PWZL-blast-Hsf4b/S15A突变质粒的构建使用KOD-Plus-Mutagenesis-Kit试剂盒(Toyobo)构建点突变表达质粒;由上海生工生物工程公司设计引物,K65R的上游引物为5’-CTGCCCCAGTATTTCCGCCATAGCAACATGGCG-3’,下游引物为5’-CGCCATGTTGCTATGGCGGAAATACTGGGGCAG-3’,其中字体加粗部分为突变后碱基。以pWZL-blast-HA-Hsf4b为模板,使用导入了突变的引物进行反向PCR;在PCR产物中添加限制酶Dpn I,消化质粒模板(Dpn I只有在识别位点(GATC)中的腺嘌呤被甲基化后才会对其进行切断。由于用一般的Dam甲基(+ )的大肠杆菌(JM109、DH5α等)制备的质粒已被甲基化,因而会被Dpn I切断;直链状的质粒PCR产物通过自连接环化以后,用于转化大肠杆菌DH5α,取得突变导入克隆。
2.2Hsf4b野生型和Hsf4b/K65R突变型表达细胞株的筛选及建立将PWZL-blast-Hsf4b质粒和PWZL-blast-Hsf4b/S15A质粒分别与慢病毒包装质粒pLECO共转染293T细胞,48 h后收集细胞培养液,经0.45 μm滤膜过滤,慢病毒感染小鼠晶状体上皮细胞(mLEC/Hsf4b-/-),同时加入2 mg/L的polybrane,48 h后换液,在含有4 mg/L blasticidin的 DMEM培养基中培养3 d,然后在含有2 mg/L blasticidin的DMEM培养基中维持培养,至此已成功构建并筛选到稳定株mLEC/Hsf4b和mLEC/Hsf4b/K65R。
2.3Western blotting分析K65位氨基酸突变对Hsf4b下游蛋白表达的影响mLEC/Hsf4b、mLEC/Hsf4b-/-、mLEC/Hsf4b/K65R细胞分别经PBS洗3次,加细胞裂解液(50 mmol/L Tris-HCl,150 mmol/L氯化钠,1% NP-40和蛋白水解酶抑制剂)冰上裂解30 min。10 000×g离心10 min,弃沉淀,分别取上清液与SDS上样缓冲液混匀,100℃煮沸10 min。用10% SDS-PAGE分离,分离的蛋白质转移到PVDF膜上,5 %脱脂奶封闭1 h,I抗[CryAB,1∶200,Santa Cruz; Hsp70i,1∶1 000,CST; Hsp90a,1∶1 000,CST; Hsp27,1∶500,Sigma;β-actin,1∶5 000,Sigma; HA-Tag (6E2),1∶2 000,CST]于4℃孵育过夜,PBS洗去未结合的I抗,辣根过氧化物酶标记的II抗于37℃孵育1 h,随后用PBST洗膜,洗膜后用ECL化学发光法检测信号。
2.4Real-time PCR实验采用TRIzol试剂(Invitrogen)分离纯化各组细胞的总RNA,分光光度法测定计算提取的总RNA含量及浓度。参照cDNA Synthesis Kit和Universal SYBR Green Supermix(Bio-Rad)实验操作说明进行PCR,采用Step One Plus real-time PCR system,总反应体积20.0 μL,其中2×Universal SYBR Green Supermix 10.0 μL,cDNA 0.1 μg,引物0.5 μmol/L。PCR扩增条件为: 95℃15 s,60°C 1 min,35~40个循环。所用引物由上海吉凯基因技术有限公司根据设计合成,见表1。
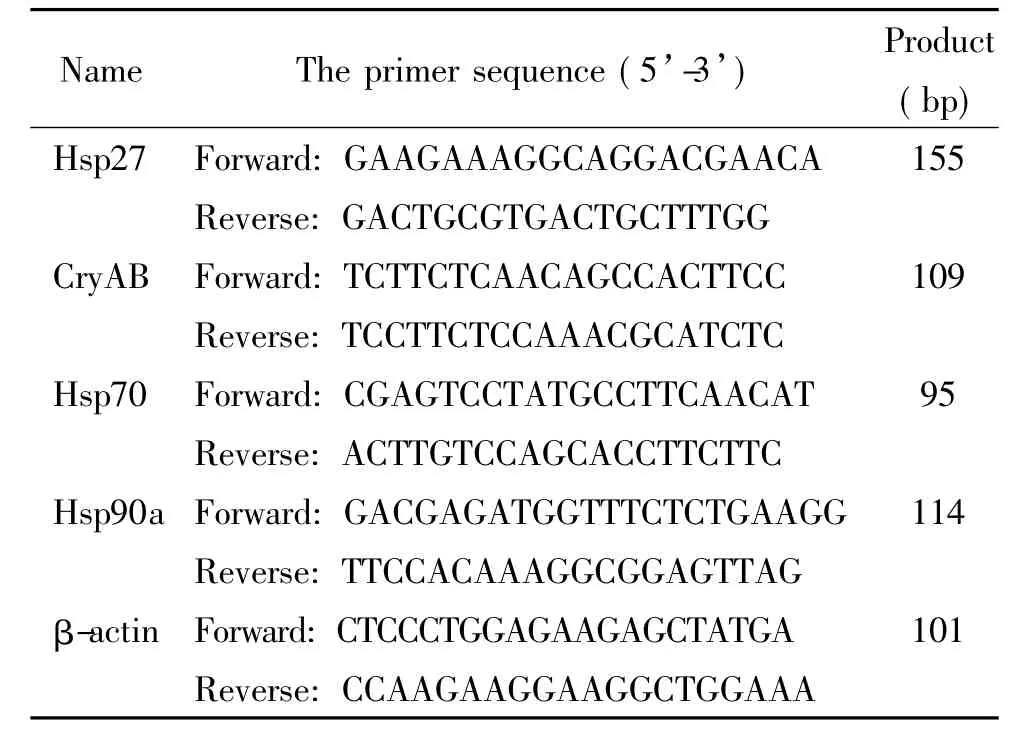
表1 实时荧光定量PCR引物序列Table 1.Sequences of the primers for real-time PCR
3统计学处理
用GraphPad Prism 6.0软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用Student t-test分析。以P<0.05为差异有统计学意义。
结果
1 Hsf4b蛋白结构域生物信息学分析
Hsf4b全长1 482 kb,编码493个氨基酸,含有5个重要的结构域,见图1。其中DNA结合结构域在调控下游蛋白表达上发挥重要作用。从BLASTW的分析结果来看,该DNA结合结构域高度保守,与其它物种的基因同源性很高,见图2。

Figure 1.Structural domain analysis of human Hsf4b protein (GI: 5921135) (http://smart.embl-heidelberg.de/and http://cplm.biocuckoo.org/).The K65R mutation site and the S299 phosphoserine site were directed by arrow heads.图1人Hsf4b蛋白结构域分析
2 Hsf4b/K65R的测序结果比对
在本研究中,采用KOD-Plus-Mutagenesis-Kit试剂盒将DNA结合结构域的赖氨酸位点突变为精氨酸。图3显示了Hsf4b突变后的测序比对结果。
3 Western blotting分析K65R位点突变后Hsf4b及下游蛋白的表达
已有报道CryAB基因错义突变能显著降低分子伴侣活性,在应激状态下,蛋白质聚集沉淀,能够导致白内障[12]。热休克蛋白Hsp27、Hsp70和Hsp90在生理和应激情况下的晶状体上皮细胞中均有表达[13-14]。本文推测,Hsf4b可能通过调控晶状体上皮细胞内热休克蛋白家族成员的表达来调控细胞的生物学功能。本室的前期工作[15]已报道,Hsp27和CryAB是Hsf4b的直接下游靶点。用免疫印迹法测定了CryAB和Hsp27蛋白在mLEC/Hsf4b/K65R、mLEC/Hsf4b-/-及mLEC/Hsf4b细胞内的表达。结果显示,HA-Hsf4b在重建的mLEC/HA-Hsf4b细胞中稳定表达,并上调CryAB和Hsp27蛋白的表达、下调Hsp70i和Hsp90a的表达(图4),结果说明构建细胞株成功。进而发现,CryAB和Hsp27蛋白在mLEC/HSF4b细胞中的表达水平明显高于它在mLEC/Hsf4b/K65R细胞中的表达,而Hsp70i和Hsp90a的表达降低。
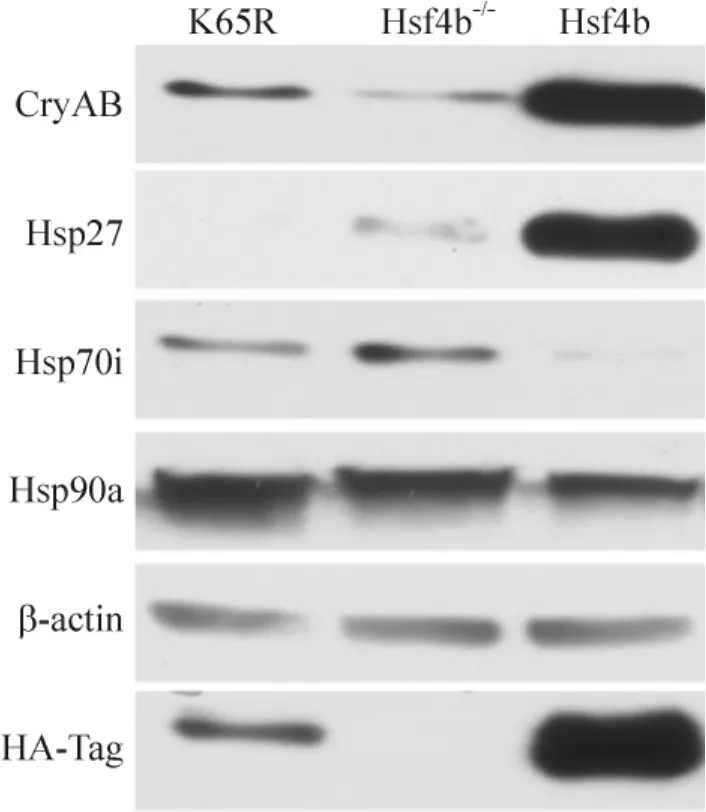
Figure 4.The images of Western blotting showed the effects of Hsf4b overexpression and Hsf4b/K65R site-mutagenisis on the expression levels of CryAB,Hsp27,Hsp70i and Hsp90a in mLEC.图4 Western blotting检测Hsf4b及Hsf4b/K65R突变的表达对人晶状体上皮细胞中CryAB、Hsp27、Hsp70i及Hsp90a表达的影响
4 Real-time PCR分析Hsf4b K65R位点突变后热休克蛋白的转录水平
CryAB和Hsp27基因在mLEC/Hsf4b细胞中较未转染Hsf4b的mLEC细胞表达明显增加,Hsp70表达明显下降,有显著差异,而Hsp90表达没有明显变化,见图5。mLEC/Hsf4b/K65R细胞组与mLEC/Hsf4b细胞组相比,CryAB、Hsp27表达明显减少,Hsp70的表达明显增加。
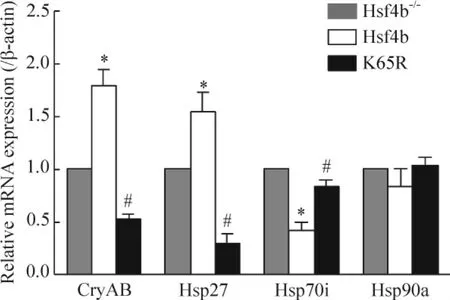
Figure 5.The mRNA expression of CryAB,Hsp27,Hsp90a,and Hsp70i in mLEC/Hsf4b/K65R (K65R),mLEC/Hsf4b-/-(Hsf4b-/-),and mLEC/Hsf4b cells (Hsf4b) determined by real-time PCR.Mean± SD.n=3.*P<0.05 vs Hsf4b-/-;#P<0.05 vs Hsf4b.图5 CryAB、Hsp27、Hsp90a和Hsp70i的mRNA在K65R,Hsf4b-/-和Hsf4b细胞中的表达
讨论
DNA结合结构域在用于转录因子的生物学功能研究中起到重要作用。人Hsf4b的DNA结合结构域在进化上高度保守,显示其可能参与基本的与下游蛋白结合与调控功能; Hsf4b第65位赖氨酸是乙酰化修饰的位点,与蛋白质发挥作用密切相关。在本研究中采用了KOD-Plus-高保真性的Inverse PCR法的位点特异性突变导入试剂盒进行K65R基因定点突变。Inverse PCR法以质粒为模板,使用反向引物进行PCR,对质粒全长进行扩增,整个过程包括转化在内只需3个步骤,比较简便。通过采用KOD -plus聚合酶及降低PCR循环数,使可能来自PCR错误的2nd-site mutation(目的突变以外的突变)的可能性降到最低,可以获得最大的突变导入率。
小鼠晶状体上皮细胞mLEC来源于新生6 d的Hsf4-/-小鼠晶状体前囊膜,在培养皿中经含有10%胎牛血清和青链霉素的DMEM培养液培养成单层后即传代,然后用猴肾病毒(SV40)大T-抗原转染mLEC细胞,G418筛选建立永生化细胞系mLEC/Hsf4-/-。因此本研究中小鼠晶状体上皮细胞mLEC没有Hsf4b的内源性表达。
Hsf4是热休克转录因子家族成员之一,在机体内有Hsf4a和Hsf4b 2种亚型。它们来源于同一个基因的不同mRNA剪辑过程。Hsf4a和Hsf4b因结构不同造成其转录活性相反。Hsf4a为转录抑制子,而Hsf4b则为转录激活子。Hsf4b感受外界环境刺激(比如细胞老化、加热、紫外线照射、糖皮质激素刺激等)后,形成3聚体后和热休克元件(HSE)结合,调控下游Hsp27、αB晶状体蛋白、Hsp70、Hsp90的表达[6,16],这些蛋白质对维持晶状体的正常结构和功能具有重要的调控作用,并可调节晶状体上皮细胞的生长[17-18]。在本研究中,Hsf4b在RNA及蛋白水平上正向调控小分子量热休克蛋白Hsp27及CryAB的表达,负向调控热休克蛋白Hsp70的表达,但并不显著影响Hsp90的表达。Hsf4b的K65R位点突变能够回复下游热休克蛋白的表达,即HSP27和Cry-AB表达降低,而HSP70表达增加,提示Hsf4b的第65位赖氨酸位点在调控热休克蛋白的表达中发挥重要作用,进而可能与白内障的发生密切相关。在本研究中构建的K65R突变稳定细胞株,可以用来进一步分析Hsf4b对下游蛋白的调控机理,深入认识其在导致白内障中发挥的作用。
[参考文献]
[1]张军,马增翼,李淑莲,等.HSF4B通过上调RhoA和Rac1促进晶状体上皮细胞迁移[J].中国生物化学与分子生物学报,2013,29(4) : 377-382.
[2]Min JN,Zhang Y,Moskophidis D,et al.Unique contribution of heat shock transcription factor 4 in ocular lens development and fiber cell differentiation[J].Genesis,2004,40(4) : 205-217.
[3]Merath K,Ronchetti A,Sidjanin DJ.Functional analysis of HSF4 mutations found in patients with autosomal recessive congenital cataracts[J].Invest Ophthalmol Visual Sci,2013,54(10) : 6646-6654.
[4]Zhang J,Ma Z,Wang J,et al.Regulation of Hsf4b nuclear translocation and transcription activity by phosphorylation at threonine 472[J].Biochim Biophys Acta,2014,1843(3) : 580-589.
[5]Hu Y,Zhang J,Wang C,et al.The transcription activity of heat shock factor 4b is regulated by FGF2[J].Int J Biochem Cell Biol,2013,45(2) : 317-325.
[6]Nakai A,Tanabe M,Kawazoe Y,et al.HSF4,a new member of the human heat shock factor family which lacks properties of a transcriptional activator[J].Mol Cell Biol,1997,17(1) : 469-481.
[7]Ke T,Wang QK,Ji B,et al.Novel HSF4 mutation causes congenital total white cataract in a Chinese family[J].Am J Ophthalmol,2006,142(2) : 298-303.
[8]Bu L,Jin Y,Shi Y,et al.Mutant DNA-binding domain of HSF4 is associated with autosomal dominant lamellar and Marner cataract[J].Nat Genet,2002,31(3) : 276-278.
[9]Cui X,Zhang J,Du R,et al.HSF4 is involved in DNA damage repair through regulation of Rad51[J].Biochim Biophys Acta,2012,8(15) : 1308-1315.
[10]Enoki Y,Mukoda Y,Furutani C,et al.DNA-binding and transcriptional activities of human HSF4 containing mutations that associate with congenital and age-related cataracts[J].Biochim Biophys Acta,2010,1802(9) : 749-753.
[11]张军,马增翼,王悦玲,等.Hsf4-/-小鼠晶状体永生化上皮细胞系建立的研究[J].中华眼科杂志,2013,49(11) : 1029-1031.
[12]Chen Q,Ma J,Yan M,et al.A novel mutation in CRYAB associated with autosomal dominant congenital nuclear cataract in a Chinese family[J].Mol Vis,2009,15: 1359-1365.
[13]Banh A,Deschamps PA,Vijayan MM,et al.The role of Hsp70 and Hsp90 in TGF-beta-induced epithelial-to-mesenchymal transition in rat lens epithelial explants[J].Mol Vis,2007,13: 2248-2262.
[14]Yao K,Rao H,Wu R,et al.Expression of Hsp70 and Hsp27 in lens epithelial cells in contused eye of rat modulated by thermotolerance or quercetin[J].Mol Vis,2006,12: 445-450.
[15]Hu Y,Mivechi NF.Association and regulation of heat shock transcription factor 4b with both extracellular signalregulated kinase mitogen-activated protein kinase and dualspecificity tyrosine phosphatase DUSP26[J].Mol Cell Biol,2006,26(8) : 3282-3294.
[16]Miao A,Zhang X,Jiang Y,et al.Proteomic analysis of SRA01/04 transfected with wild-type and mutant HSF4b identified from a Chinese congenital cataract family[J].Mol Vision,2012,18: 694-704.
[17]季樱红,卢奕,李娜,等.遗传性白内障小鼠晶状体的比较蛋白质组分析[J].中国病理生理杂志,2009,25(7) : 1415-1419.
[18]吴明星,吴开力,卞庆宁,等.年龄相关性白内障晶体上皮细胞的基因表达谱变化的初步分析[J].中国病理生理杂志,2006,22(7) : 1429-1434.
(责任编辑:陈妙玲,余小慧)
Eeffect of K65R site-mutagenesis of cataracts-related gene Hsf4b on downstream heat shock proteins expression
LOU Qiang,XIE Pan-pan,CUI Xiu-kun,MA Yuan-fang,HU Yan-zhong
(Antibody Drug Engineering Laboratory of Henan Province,Medical and Molecular Immunology Laboratory,Medical School of Henan University,Kaifeng 475004,China.E-mail: hyz@henu.edu.cn)
[ABSTRACT]AIM: To clarify the impact of heart shock factor 4b (Hsf4b) K65R mutation on the regulation of downstream protein expression.METHODS: Non-functional Lys mutant plasmid pWZL-blast-HA-Hsf4b/K65R was generated by replacing single,homologous amino acids using KOD-Plus-Mutagenesis-Kit.Mouse lens epithelial mLEC stable cell lines expressing Hsf4b or Hsf4b/K65R were constructed by lentivirus infection.The expression of Hsf4b in the mutant and the wildtype mLEC cells was confirmed by Western blotting.The expression of Hsf4b downstream proteins such as heat shock protein (Hsp) 70,Hsp90,Hsp27 and CryAB was examined by Western blotting and real-time PCR.RESULTS: The results of PCR and DNA sequencing confirmed the successful construction of mLEC Hsf4b/K65R mutant.The K65R mutation didn’t influence Hsf4b expression in the mLEC cells.After K65R mutation in Hsf4b,the expression levels of Hsp27 and CryAB were down-regulated and the expression of Hsp70i and Hsp90a upregulated.CONCLUSION: pWZL-blast-HA-Hsf4b/K65R can be used to construct a stable cell line by infecting with lentivirus.Hsf4b/K65R mutation influences the regulation of downstream heat shock proteins.
[KEY WORDS]Heat shock factor 4b; Lens epithelial cells; Heat shock proteins; Site-mutagenesis
通讯作者△Tel: 0371-23885036; E-mail: hyz@henu.edu.cn
*[基金项目]国家自然科学基金资助项目(No.U1404826) ;河南省教育厅项目(No.14B310015) ;河南大学基本科研业务费科研专项(青年科研人才种子基金)
[收稿日期]2015-03-25[修回日期]2015-05-15
[文章编号]1000-4718(2015)09-1699-05
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.030
