慢性支气管炎小鼠模型构建方法的改良与评价*
2015-04-27杜秀婷谢宛君肖志勋卓桂锋广州中医药大学广东广州510405
杜秀婷,罗 良,谢宛君,肖志勋,卓桂锋,苏 宁(广州中医药大学,广东广州510405)
慢性支气管炎小鼠模型构建方法的改良与评价*
杜秀婷,罗良,谢宛君,肖志勋,卓桂锋,苏宁△
(广州中医药大学,广东广州510405)
[摘要]目的:结合慢性支气管炎的发病机制及致病因素,在以往单因素致病建模方法的基础上进行改良,探究一种较为准确、可靠、符合慢性支气管炎病理变化的模型。方法:慢支改良组(复合组)小鼠于实验第1、14天分别经气管和经鼻腔注入LPS,同时,于第2~30天(第14天除外)进行被动吸烟及SO2吸入; SO2组小鼠每天熏SO22 min;烟熏组小鼠每天吸烟4支/次,直至1包烟燃烧完毕,共约1 h;脂多糖组小鼠在造模第1天气管注入LPS,第14天、30天进行LPS滴鼻。各模型组均连续造模30 d。造模结束后通过对小鼠一般情况的观察、肺泡灌洗液结果分析以及支气管肺组织形态学观察等评价改良后的慢支模型。结果:造模后各模型组小鼠出现鼻部潮湿,咳嗽,体毛干枯无光泽,拱背蜷缩,少动,反应较为迟钝等症状,复合组的体质量增长最慢。从各组模型组病理切片可观察到细支气管壁周围有炎性细胞浸润,腔内炎性渗出明显,气道内分泌物增多等病变;与烟熏组、二氧化硫组比较,慢支改良组肺泡灌洗液白细胞总数显著增高(P<0.01) ;慢支改良组与其它3组比较肺组织炎症细胞浸润程度显著升高(P<0.01),且烟熏组与LPS组比较差异有统计学意义。结论:烟熏、二氧化硫、LPS均可导致小鼠慢支疾病的发生,而从支气管及肺组织病理学、肺泡灌洗液细胞学以及慢支的发病学等方面分析,复合因素造模更为符合慢支模型的构建。
[关键词]慢性支气管炎;烟熏;二氧化硫;脂多糖
慢性支气管炎(慢支)是由于感染、理化因素等长期刺激而引起的气管、支气管黏膜及其周围组织的慢性非特异性炎症。临床上以咳嗽、咯痰或伴有喘息为主要症状[1]。慢支加速肺功能的下降,且病情日益恶化,降低了患者的生活质量[2]。其经常反复发作可并发慢性阻塞性肺气肿、慢性肺源性心脏病等疾病。目前对慢支的防治研究已受到国内外医学研究者的关注。对于慢支的基础研究,往往离不开慢支模型的成功复制。Kodavanti等[3]利用二氧化硫建立动物气道炎症模型,Vlahos等[4]利用烟熏法建立小鼠肺部炎症模型,近年来较为常用的是烟熏联合脂多糖法。慢性支气管炎由于病因复杂,临床症状多样,病程反复迁延,给动物模型的合理模拟及观测指标的客观、精确与量化带来很大难度,研究进展甚缓,多数研究仍停留于应用传统经典方法,近年来虽有新的探索,但实用者甚少[5]。而到目前为止,国内外仍未有一套标准化的慢支造模方式,各种造模方法良莠不齐,慢支模型的复制质量仍是慢支基础研究的一大障碍。为探究一种切实可行、复制成功率高的慢支模型建造方法,本实验通过总结近几年来国内外的慢支造模方式,结合慢性支气管炎的发病机制及致病因素,在以往单因素致病建模方法的基础上进行改良,设计出脂多糖(lipopolysaccharide,LPS)+烟熏-二氧化硫(sulfur dioxide,SO2)吸入交替法建造慢性支气管炎动物模型。
材料和方法
1材料
1.1动物健康4周龄昆明小鼠32只,雌雄不限,体质量(20±4) g,由广州中医药大学动物中心提供,许可证号为SCXK(粤) 2013-0020。
1.2烟熏材料芙蓉牌香烟(焦油量11 mg,烟气烟碱量0.9 mg,烟气一氧化碳量13 mg)购自湖南中烟工业有限责任公司。
1.3主要试剂与仪器Leica TP1020脱水机、Leica EG1600包埋机、Leica RM 2135轮转式切片机、Leica ST4040染色机、Olympus生物显微镜均由广州中医药大学西医基础实验室提供;水合氯醛、静脉导管针套管、LPS购自Sigma;自制密闭烟熏箱;无水亚硫酸钠、磷酸盐缓冲液、甲醛溶液均为国产分析纯。
2实验方法
2.1动物分组健康4周龄昆明种小鼠32只,按随机数字表法分为4组,分别为复合组(脂多糖+烟熏-SO2吸入交替法)、SO2组(SO2吸入法)、烟熏组(烟熏法)、脂多糖组(脂多糖法),每组8只。
2.2建造模型复合组小鼠:于实验第1天用5%剂量为0.1 mL/10 g的水合氯醛[6]麻醉后,仰卧、固定,剪开颈部皮肤,分离气管,用微量进样器快速注入浓度为1 g/L的LPS 50 μg[7],第14天按上述剂量麻醉后,用浓度为1 g/L的LPS滴鼻;同时,于第2~30天(第14天除外)在自制密闭烟熏箱(50 cm×50 cm×30 cm)内交替进行被动吸烟及SO2吸入;吸烟4支/次,直至1包烟燃烧完毕,每天共约1 h; SO2吸入则取无水亚硫酸钠0.4 g盛于小烧杯置于干燥瓶(7 L)中,加入30%硫酸0.4 mL反应产生SO2气体,将8只改良组小鼠分2次放入干燥瓶各熏2 min,每只小鼠每天熏1次。SO2组:取无水亚硫酸钠0.4 g盛于小烧杯置于干燥瓶(7 L)中,加入30%硫酸0.4 mL反应产生SO2气体,将SO2组小鼠(8只)分2次放入干燥瓶中各熏2 min,每天1次,连续30 d。烟熏组小鼠置于自制密闭烟熏箱(50 cm×40 cm×30 cm)内交替进行被动吸烟;吸烟4支/次,直至1包烟燃烧完毕,共约1 h,造模30 d。脂多糖组小鼠(8 只)在第1天用5%剂量为0.1 mL/10g的水合氯醛腹腔注射麻醉后,仰卧位固定于操作台,剪开颈部皮肤,分离气管,用微量进样器快速注入浓度为1 g/L 的LPS 50 μg;第14天、30天按上述剂量麻醉后,用浓度为1 g/L的LPS滴鼻,共造模30 d。
2.3一般情况的观察观测小鼠的活动度、对外界反应的灵敏度、皮毛光泽、饮食、饮水、死亡情况。造模前、造模1月后,取标本前称重,观察体重的变化。慢支模型组小鼠有明显的咳嗽、鼻部潮湿,食少,体毛干枯无光泽,拱背蜷睡,少动,反应迟钝,食少,体重下降等表现[8]。
2.4支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)分析用5%剂量为0.1 mL/10 g的水合氯醛麻醉小鼠,气管前方切开皮肤,钝性分离暴露气管,使用磷酸盐缓冲液1.5 mL行支气管肺泡灌洗(分3次,每次0.5 mL),回收肺泡灌洗液共约1 mL,4℃离心10 min,1 500 r/min,回收上清液-20℃保存,用1 mL含有1% BSA的PBS重悬细胞沉淀,取10 μL重悬液于血细胞计数板中进行白细胞计数。
2.5支气管肺组织形态学观察取左肺于10%的甲醛溶液中固定,乙醇梯度脱水,二甲苯透明标本,浸蜡、包埋、切片、HE染色。于光学显微镜下观察组织形态学改变。
2.6炎症细胞计数取每个样本切片置于400倍的光学显微镜下观察,随机抽取5个视野,使用Image-Pro Plus 6.0软件手动进行细胞计数。
3统计学处理
实验数据以均数±标准差(mean±SD)表示,采用SPSS 17.0统计分析软件行单因素方差(one-way ANOVA)分析,2组间比较采用SNK-q检验,以P<0.05为差异有统计学意义。

Figure 1.The mice were induced by different methods for modeling of chronic bronchitis.A: in the smoking process (smoking group),the mice were restless and tachypneic in the first half hour; B: in the smoking process (smoking group),the mice were slow down in response in the other half hour; C: in the SO2group,the mice had experienced symptoms including wet nose,cough,moist hair,dysphoria,dyspnea,etc; D: after intratracheal instillation of LPS (LPS group),the mice were under anaesthetic.图1小鼠受不同方法诱导建立慢性支气管炎病理模型的大体表现
结果
1小鼠慢支模型的一般状况观察
造模前,小鼠活动度正常,对外界反应灵敏,皮毛有光泽,饮食、饮水均正常,体重为20~25 g。造模过程中,烟熏组小鼠在烟熏过程的前半小时躁动不安,跳动,呼吸急促;后半小时全身湿润,鼻部潮湿,呼吸急促,少动,反应迟钝。二氧化硫组小鼠躁动,攀爬,呼吸急促困难,口张开,皮毛湿润。LPS组小鼠第1次气管内注入LPS,其后2次均滴鼻注入LPS,麻醉过程中活动度减少,逐渐昏迷,滴鼻后全部苏醒。复合组上述表现较为明显,外形较显出消瘦。造模后各模型组小鼠出现鼻部潮湿,咳嗽,体毛干枯无光泽,拱背蜷缩,少动,反应较为迟钝等症状,见图1。
2支气管肺组织形态学观察
各组小鼠肺组织均有不同程度的渗出、水肿、出血,支气管周围可见炎症细胞浸润,黏膜上皮细胞脱落,管腔内有少量分泌物和炎症细胞,肺泡间隔增宽,内有炎细胞浸润及毛细血管扩张、充血,部分肺泡壁变薄、断裂,肺泡过度扩大融合,肺泡数减少,呈肺气肿病变,部分肺泡腔内可见渗出物、红细胞。其中烟熏组细支气管管腔内分泌物增多,肺泡形态破坏情况较轻;二氧化硫组肺泡形态破坏较为严重,大量肺泡壁变薄、断裂,融合成肺大泡,正常肺泡数明显减少;脂多糖组黏膜上皮损伤较严重,肺泡腔内可见炎性细胞;复合组气管周围有炎性细胞浸润、管腔内渗出物增多,见图2。
3支气管肺泡灌洗液分析结果
由不同造模方式建造的4组慢支模型的小鼠均出现不同程度的慢支病变。小鼠造模后进行肺泡灌洗液白细胞计数,各组结果如表1所示。与烟熏组比较,其它3组肺泡灌洗液的白细胞总数增高,差异显著(P<0.05) ;与二氧化硫组比较,LPS组和复合组肺泡灌洗液的白细胞总数增高(P<0.05) ;与LPS组比较,复合组肺泡灌洗液的白细胞总数增高,但差异不显著。说明不同的单因素刺激对小鼠慢支的形成存在一定的差异,而复合因素造模后使肺泡灌洗液的白细胞总数增高最为明显。
4病理切片炎症细胞计数结果
运用4种不同造模方式造模后,与烟熏组比较,其它3组小鼠肺组织炎症细胞数均有增高,其中LPS组与复合组具有显著差异(P<0.05) ;与二氧化硫组比较,复合组肺组织炎症细胞数增高(P<0.01) ;与LPS组比较,复合组肺组织炎症细胞数增高,具有显著差异(P<0.01)。说明不同造模方式可促进小鼠支气管、肺泡、肺泡间隔、血管等肺部结构的炎症细胞浸润,其中复合因素刺激作用更为明显,见表1。
讨论
吸烟所致烟雾对呼吸道的长期刺激是慢性支气管炎最重要的病因。纸烟所含的焦油和菸碱可增加副交感神经兴奋性,使支气管收缩痉挛,增加气道阻力;同时,支气管黏膜腺体增生与肥大,杯状细胞增生与鳞状上皮细胞化生,黏膜分泌增多与积聚,上皮细胞纤毛运动受抑制;黏膜充血、水肿,肺泡吞噬细胞功能降低,使气道净化能力减弱,均易引起感染。吸烟时间愈长,烟量愈大,患病率也愈高。吸烟者的患病率比不吸烟者高约2~8倍。戒烟后可缓解病情,使症状减轻或消失。烟熏法可成功复制慢性支气管炎动物模型。吸入刺激性气体SO2,复制慢性支气管炎,能可靠地引起慢性支气管炎病理变化和气流阻塞。脂多糖是革兰阴性菌的外膜结构,也是重要的致炎因子,可直接引起气道上皮损伤,导致各种炎症细胞激活和细胞因子的释放,诱发气道炎症[9]。大鼠气管内滴注脂多糖1 mg/kg可复制急性肺损伤模型,出现富含蛋白、纤维蛋白的肺泡分泌液和弥漫性嗜中性细胞肺泡炎。大鼠气管内滴注胰弹性蛋白酶和人嗜中性细胞弹性蛋白酶引起可逆性支气管上皮黏液细胞化生[10]。因此,根据慢支的病因病机和病理变化,慢支模型常来源于肺炎克雷伯杆菌和肺炎链球菌、脂多糖、香烟烟雾、刺激气体等致病因素。

Figure 2.The biopsy of the lung tissues in the mice with different chronic bronchitis modeling methods (HE staining).图2不同方法诱导慢性支气管炎小鼠模型的支气管肺组织形态学观察
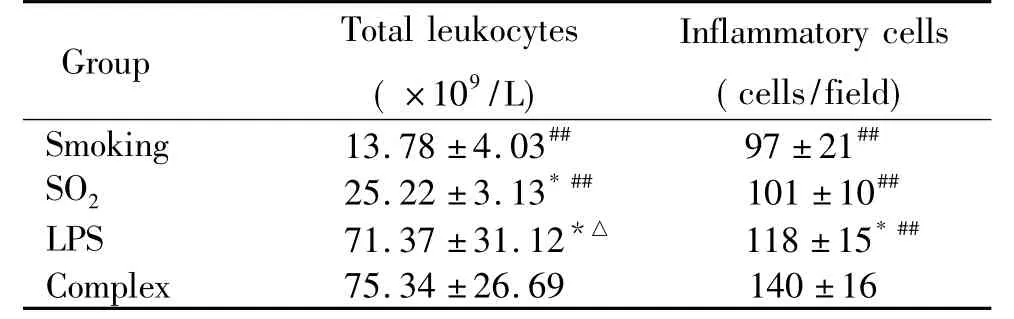
表1 不同造模方法对小鼠肺泡灌洗液白细胞和肺组织炎症细胞的影响Table 1.The effects of 4 modeling methods on the leukocyte count in BALF and inflammatory cells number in the lung tissue of the mice (Mean±SD.n=8)
现代医学对痰多、黏稠主要从气道黏液高分泌的角度研究。慢支、COPD的发生发展过程中,由于感染、变应原、刺激性气体和烟雾等有害因素的作用,使炎性细胞和气道黏膜、黏膜下细胞受损而释放多种炎性介质,刺激气道上皮杯状细胞增生、化生及黏膜下腺体增生肥大,导致气道分泌亢进,表现为黏液的量和黏稠度明显增高[11]。气道炎症是慢支病理机制中的一个关键环节[12]。烟草中含有多种有害成分如焦油、尼古丁、一氧化碳和各种粉尘颗粒[13]。长期吸烟可引发慢性支气管炎、肺气肿及慢性阻塞性肺疾病等肺损害[14-15]。因此,吸烟是慢支形成的一个重要的致病因素;脂多糖存在于革兰阴性菌的细胞外壁,主要由类脂质和多糖构成,在环境中普遍存在。研究表明,慢支并非全部由吸烟引起的,其它一些环境暴露或职业性暴露也是慢支的重要致病因素,而这些环境或职业性暴露如有机粉尘等的微生物成分就含内毒素。另外,刺激性烟雾、有害气体如SO2,对支气管黏膜造成损伤,造成支气管杯状细胞增生,黏膜分泌增加,为细菌侵入创造条件。
慢性支气管炎可能是多种因素长期相互作用的结果。根据导致慢支发生的感染、刺激性气体、吸烟等致病因素,本实验通过烟熏、二氧化硫、LPS以及复合法建造4组慢支模型,从小鼠的临床症状,体征以及病理分析、肺泡灌洗液白细胞总数增加、肺组织炎症细胞浸润量增高等说明成功建立小鼠慢性支气管炎模型,其中复合组的体质量增长幅度较小,肺泡灌洗液白细胞总数和炎症细胞数目增长幅度较大,以及结合慢支致病因素的多元化表明复合因素刺激更为符合慢支模型的构建。
复合致病因素改良法和以往的吸烟与脂多糖联合法相比,其特点是增加了以二氧化硫为代表的空气污染致病因素,体现了在慢支发生过程中,空气中的刺激性烟雾和有害气体如二氧化硫的危害性,更有力地说明慢支是由多种因素长期作用的结果,提示在临床上避免吸烟、空气污染、感染等慢支主要致病因素的侵袭将有利于降低慢性支气管炎的发病率,进一步揭示了人类日常生活中多因素致病的现实情况。
[参考文献]
[1]王吉耀.内科学[M].第2版.北京:人民卫生出版社,2010.31-34.
[2]Kim V,Criner GJ.The chronic bronchitis phenotype in chronic obstructive pulmonary disease: features and implications[J].Curr Opin Pulm Med,2015,21(2) :133-141.
[3]Kodavanti UP,Schladweiler MC,Ledbetter AD,et a1.The spontaneously hypertensive rat: experimental model of sulfur dioxide-induced airways disease[J].Toxicol Sci,2006,94(1) : 193-205.
[4]Vlahos R,Bozinovski S,Chan SP,et a1.Neutralizing granulocyte/macrophage colon-stimulating factor inhibits cigarette smoke-induced lung inflammation[J].Am J Respir Crit Care Med,2010,182(1) : 34-40.
[5]钱伯初,史红,郑晓亮.慢性支气管炎动物模型研究进展[J].中国比较医学杂志,2008,18(8) : 53-57.
[6]周洁,李旸,张稳燕.水合氯醛和戊巴比妥钠对KM小鼠麻醉效果实验研究[J].医学信息:上旬刊,2010,23(10) : 3795-3796.
[7]吕小琴,唐法娣,王砚,等.蓝桉油对脂多糖引起的大鼠慢性支气管炎及黏蛋白高分泌的影响[J].中国中药杂志,2004,29(2) : 168-171.
[8]温丽雅,余红,颜宇琦,等.益气化痰组方对慢性支气管炎模型小鼠的药理学作用研究[J].河北医药,2010,32(21) : 2949-2951.
[9]李红梅,崔德健,佟欣,等.熏香烟加气管注内毒素和单纯熏香烟法建立大鼠COPD模型[J].中国病理生理杂志,2002,18(7) : 808-812.
[10]Nields HM,Snider GL,Breuer R,et al.Reversible pancreatic elastase-induced bronchial secretory cell metaplasia in the rat[J].Exp Pathol,1991,41(4) : l85-193.
[11]邓春南,周建龙,郭振辉,等.清气化痰汤对慢性支气管炎大鼠气道黏液高分泌的影响[J].中华中医药学刊,2009,27(8) : 1698-1700.
[12]唐光华,黄启福,姜良铎.艾麻口服液对慢性支气管炎大鼠支气管TNF-α、ICAM-1蛋白及mRNA表达的影响[J].中国病理生理杂志,2002,18(7) : 834-836.
[13]Borgerding M,Klus H.Analysis of complex mixtures-cigarette smoke[J].Exp Toxicol Pathol,2005,57 Supp1 1: 43-73.
[14]Hallberg J,Dominicus A,Eriksson UK,et a1.Interaction between smoking and genetic factors in the development of chronic bronchitis[J].Am J Respir Crit Care Med,2008,177(5) : 486-490.
[15]Gietema HA,Schilharn AM,van Ginneken B,et a1.Monitoring of smoking-induced emphysema with CT in a 1ung cancer screening setting: detection of real increase in extent of emphysema[J].Radiology,2007,244(3) :890-894.
(责任编辑:林白霜,余小慧)
Improvement and evaluation of chronic bronchitis modeling methods in mice
DU Xiu-ting,LUO Liang,XIE Wan-jun,XIAO Zhi-xun,ZHUO Gui-feng,SU Ning
(Guangzhou University of Chinese Medicine,Guangzhou 510405,China.E-mail: d1121352956@163.com)
[ABSTRACT]AIM: To explore a more accurate and reliable pathological model of the chronic bronchitis,which has improved from the former single-factor modeling method of the disease.METHODS: The mice in complex group were treated with lipopolysaccharide (LPS) by tracheal injection on the 1st day and nasal drops on the 14th day,and from the 2nd day to 30th day,the animals were given passive smoking and sulfur dioxide (SO2) inhalation (except on the 14th day).The mice in SO2group were exposed to SO22 min per day,while in smoking group,the mice were exposed to smoke for about 1 h per day (4 cigarettes each time until one pack of cigarettes were burning up).In LPS group,the mice had tracheal injection of LPS on the 1st day and nasal drops of LPS on the 14th day and 30th day.Every modeling process lasted for 30 days.After modeling,the improvement of chronic bronchitis model was evaluated by testing the general conditions of the mice,analyzing leukocyte count in bronchoalveolar lavage fluid (BALF),and observing the morphological changes of the bronchial and lung tissues.RESULTS: After modeling,the mice in every model group experienced symptoms including wet nose,cough,dry and lusterless hair,arched back and curled-up body,showing inactive,and slow down in response.The mice in complex group gained the lowest weight compared to other groups.From each model group,the inflammatory cells infiltrated evidently around the bronchial walls,especially in the bronchial cavity,and the mucilage secretion in the airway increased.The total number of leukocytes in BALF increased significantly in complex group.The inflammatory cell count in the lung tissue indicated that the mice in complex group had significantly higher levels of inflammatory cell infiltration.Besides,the comparison between smoke group and LPS group was statistically significant.CONCLUSION: Smoking,SO2inhalation and LPS injection induce bronchial lung disease in mice,and the complex chronic bronchitis mouse model is a better model with the pathological changes of bronchus,lung tissue and BALF,and pathogenesis of chronic bronchitis.
[KEY WORDS]Chronic bronchitis; Smoking; Sulfur dioxide; Lipopolysaccharide
通讯作者△Tel: 020-39358038; E-mail: d1121352956@163.com
*[基金项目]广东省大学生创新实验项目(No.1057213013)
[收稿日期]2015-04-20[修回日期]2015-05-29
[文章编号]1000-4718(2015)09-1724-05
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.035
