苯中毒病人TOPOⅡα启动子调控因子Sp1组蛋白化学修饰改变*
2015-04-27施益芬甘一峰沈志坚温州医科大学附属第一医院血液科浙江温州325015
施益芬,甘一峰,沈志坚,俞 康(温州医科大学附属第一医院血液科,浙江温州325015)
苯中毒病人TOPOⅡα启动子调控因子Sp1组蛋白化学修饰改变*
施益芬,甘一峰,沈志坚,俞康△
(温州医科大学附属第一医院血液科,浙江温州325015)
[摘要]目的:研究拓扑异构酶Ⅱα(TOPOⅡα)启动子调控因子SP1组蛋白化学修饰在苯中毒病人中的改变。方法: 25例临床慢性苯中毒患者骨髓单个核细胞为病例组,25例正常人骨髓单个核细胞为对照组,染色质免疫沉淀技术探讨TOPOⅡα启动子调控因子Sp1组蛋白乙酰化和甲基化水平的变化,RT-PCR法测定Sp1 mRNA的表达水平。结果:与对照组相比,临床苯中毒病例TOPOⅡα启动子调控因子Sp1组蛋白H4和H3乙酰化水平下降(P<0.01),组蛋白H3K9甲基化水平升高(P<0.01),组蛋白H3K4甲基化水平无明显改变。与正常对照组相比,临床苯中毒病例TOPOⅡα启动子调控因子Sp1的mRNA表达水平降低(P<0.05)。结论:慢性苯中毒TOPOⅡα启动子调控因子Sp1组蛋白H4、H3乙酰化及H3K9甲基化修饰水平的改变伴随着mRNA水平的变化。TOPOⅡα启动子调控因子Sp1可能通过组蛋白H4、H3乙酰化及H3K9甲基化修饰改变在苯中毒所致的造血毒性中发挥作用。
[关键词]苯; SP1;组蛋白乙酰化;组蛋白甲基化;染色质免疫沉淀
[修回日期]2015-05-26
苯作为一种常用工业原料,可经多途径进入人体,而骨髓细胞则为苯诱导产生毒性的靶器官之一,可造成多种骨髓造血功能障碍,引起血液系统严重而不可逆的损害,可致外周血血细胞减少甚至再生障碍性贫血、白血病。但迄今为止,苯导致造血系统毒性和白血病的分子机制尚未阐明清楚[1]。近年来,拓扑异构酶(topoisomerase,TOPO)在苯致造血毒性中的作用日益受到关注和确定[2-3]。本课题组前期的研究显示,苯及其代谢物影响骨髓单个核细胞TOPOⅡα表达及活性,TOPOⅡα启动子组蛋白乙酰化和甲基化水平改变是其含量下降的机制之一[3-5]。Sp1是TOPOⅡα启动子重要的调控因子,使TOPO Ⅱα表达增加[6]。本研究进一步探讨TOPOⅡα表达降低是否还伴随着TOPOⅡα启动子调控因子Sp1组蛋白化学修饰水平的改变,为进一步认识苯中毒相关疾病的发病机制提供依据。
材料和方法
1对象
取本院血液内科临床慢性苯中毒患者的骨髓标本25份,该组患者男性9例,女性16例;平均年龄32.5岁(20~56岁),苯接触时间≥6月(6个月~5 年)。工作环境中苯浓度平均87 mg/m3(50~1 000 mg/m3),超过时间加权平均容许浓度(PC-TWA,6 mg/m3)及短时间接触容许浓度(PC-STEL,10 mg/m3)。25例年龄、吸烟、饮酒习惯等匹配的健康志愿者骨髓标本作为对照,男性11例,女性14例;平均年龄33.8岁(19~58岁)。苯中毒患者诊断依据: GBZ 68-2002《职业性苯中毒诊断标准》诊断。本研究已通过温州医科大学附属第一医院伦理委员会的认证。所有骨髓捐献者签署知情同意书。
2主要试剂
淋巴细胞分离液(天津TBD生物技术发展中心) ;染色质免疫沉淀(chromatin immunoprecipitation,ChIP)检测试剂盒、抗乙酰化组蛋白H3抗体、抗乙酰化组蛋白H4抗体、抗二甲基组蛋白H3(K9)抗体和抗三甲基组蛋白H3(K4)抗体(Upstate) ; 37%甲醛(Sigma) ; TRIzol和PlatinumPCR Super-Mix (Invitrogen) ; GeneRulerTM50 bp DNA Ladder (Fermentas)。
3主要方法
3.1骨髓单核细胞悬液的制备取临床苯中毒及健康志愿献髓员的骨髓5 mL,肝素抗凝(5×104U/L),淋巴细胞分离液密度梯度离心法分离制备成单个核细胞悬液,调整细胞终浓度为1×109/L。台盼兰染色检测活细胞率,要求拒染率达95%以上。
3.2ChIPChIP检测用ChIP分析试剂盒,按产品说明书进行。简言之,悬浮的骨髓单个核细胞用终浓度为1%的甲酰胺固定10 min,使转录因子与DNA交联,用细胞裂解液破膜后,用超声将DNA打碎成250~1 000 bp(此处提取的DNA片段命名为input DNA)。用特异性抗体[抗乙酰化组蛋白H3抗体、抗乙酰化组蛋白H4抗体和抗二甲基组蛋白H3 (K9)抗体、抗三甲基组蛋白H3(K4)抗体]沉淀DNA-蛋白复合物,用蛋白A琼脂吸附复合物,经洗去非特异性吸附后,解交联,沉淀的DNA片段-20℃保存备用(此DNA片段命名为ChIPed DNA)。ChIPed DNA通过PCR法对目标基因(TOPO Ⅱα启动子调控因子Sp1)进行分析。
3.3PCR扩增ChIP后DNA产物针对Sp1的DNA序列设计的引物见表1。扩增条件为94℃5 min; 94℃30 s,58℃30 s,72℃1 min,35个循环; 72℃10 min,4℃30 min。反应完成后用1.8%琼脂糖凝胶电泳并照相,Quantity One图象分析系统分析实验结果。Sp1水平变化=(IP苯中毒组/Input苯中毒组)/(IP对照组/Input对照组)。
3.4RT-PCR采用TRIzol法提取实验组及对照组细胞总RNA;采用随机引物法合成cDNA。针对Sp1 的mRNA序列设计引物(表1)。引物与GenBank基因序列核对无误,采用β2微球蛋白作为内参照(表1),进行PCR扩增,扩增条件为: 95℃10 min; 95℃30 s,62℃30 s,72℃30 s,35个循环; 72℃10 min。经1.5%的琼脂糖凝胶电泳后,Quantity One图像分析系统分析实验结果。以目标基因与β2微球蛋白扩增产物的吸光度值的比值计算表达水平。
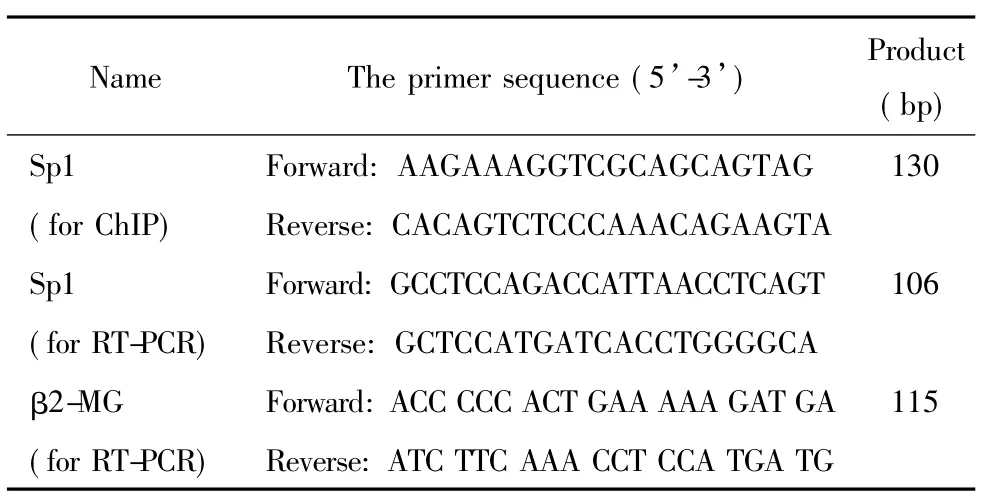
表1 引物序列Table 1.The sequences of the primers
4统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,单因素方差分析及Turkey’s检验来确定组间差异,以P<0.05为差异有统计学意义。
结果
1与乙酰化组蛋白H4结合的Sp1水平
病例组Sp1组蛋白H4乙酰化水平较对照组明显下降(P<0.01),见图1、表2。
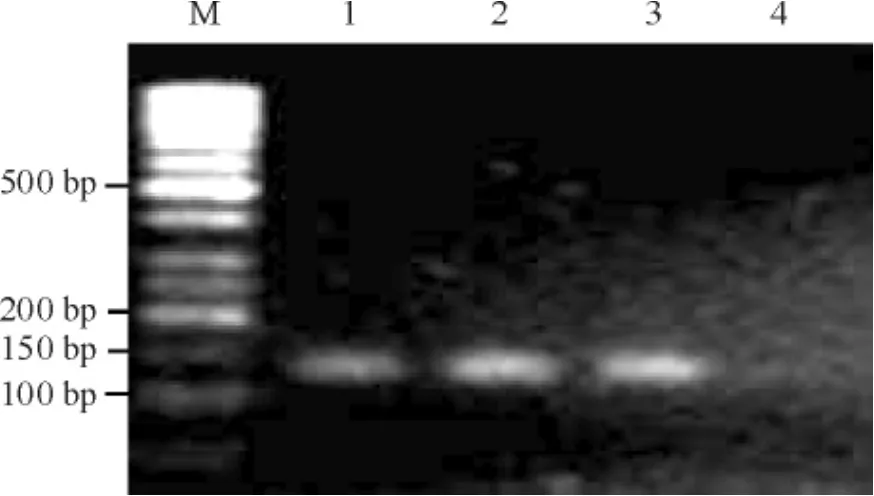
Figure 1.The result of ChIP analysis for acetylated histone H4 binding Sp1 DNA level.M: marker; 1: input control; 2: IP AceH4 control; 3: input benzene; 4: IP AceH4 benzene.图1乙酰化组蛋白H4结合的Sp1的ChIP分析
2与乙酰化组蛋白H3结合的Sp1水平
病例组Sp1组蛋白H3乙酰化水平较对照组下降(P<0.01),见图2、表2。
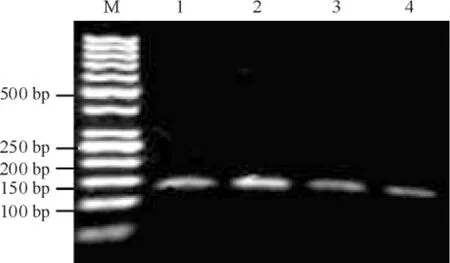
Figure 2.The results of ChIP analysis for acetylated histone H3 binding Sp1 DNA level.M: marker; 1: input control; 2: IP AceH3 control; 3: input benzene; 4: IP AceH3 benzene.图2乙酰化组蛋白H3结合的Sp1的ChIP分析
3与甲基化组蛋白H3K4结合的Sp1水平
病例组Sp1组蛋白H3K4甲基化水平较对照组稍下降,但差异无统计学意义,见图3、表2。
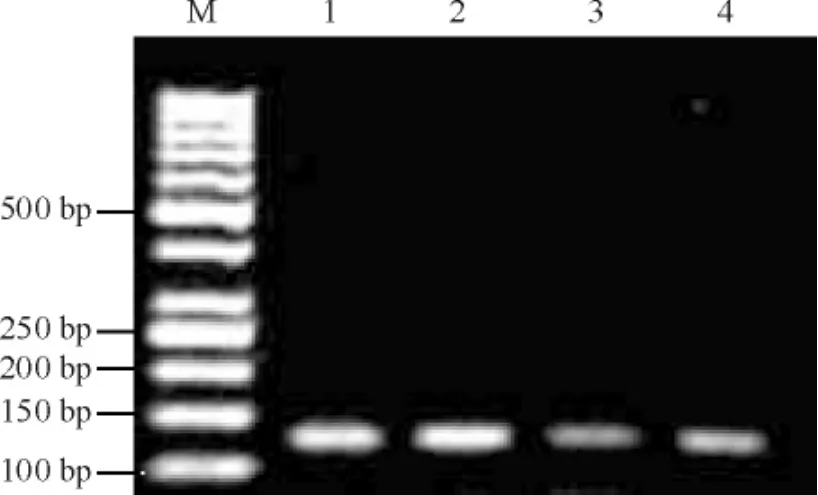
Figure 3.The results of ChIP analysis for methylation histone H3K4 binding Sp1 DNA level.M: marker; 1: input control; 2: input benzene; 3: IP MethH3K4 control; 4: IP MethH3K4 benzene.图3甲基化组蛋白H3K4结合的Sp1的ChIP分析
4与甲基化组蛋白H3K9结合的Sp1水平
病例组Sp1组蛋白H3K9甲基化水平较对照组升高(P<0.01),见图4、表2。
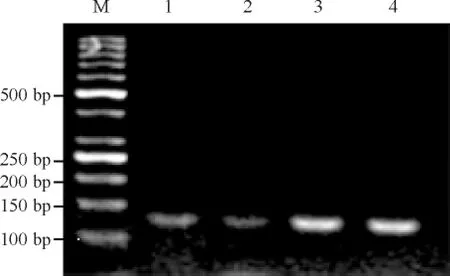
Figure 4.The results of ChIP analysis for methylation histone H3K9 binding Sp1 DNA level.M: marker; 1: input control; 2: IP MethH3K9 control; 3: input benzene; 4: IP MethH3K9 benzene.图4甲基化组蛋白H3K9结合的Sp1的ChIP分析
5 RT-PCR结果
Sp1的mRNA水平较对照组降低(P<0.05),见图5。
讨论
苯所致造血毒性已得到广泛重视,但其毒性机制仍远未阐明。普遍认为苯造血毒性是氧化损伤、拓扑异构酶功能失调、DNA损伤、免疫异常等多因素多水平综合作用的结果[7-8],推测苯诱发造血毒性涉及关键靶基因的细胞遗传学改变(通过诱导造血干细胞基因突变,染色质或表观遗传学、基因组不稳定通路),最终导致白血病干细胞形成及克隆演变[1]。表观遗传机制的改变导致的基因失活是近年来科学研究的热点,主要包括组蛋白乙酰化、组蛋白甲基化、DNA甲基化和染色质高级结构中其它成分的修饰,这些修饰改变染色质构型,导致基因转录调节发生变化,进而导致细胞增殖失常。组蛋白乙酰化与基因转录激活有关,去乙酰化常见基因转录沉默[9],组蛋白H3K4甲基化与基因转录活化相关[10],而组蛋白H3K9甲基化常见基因转录沉默[11]。我们的前期研究发现苯所致造血毒性与TOPOⅡα的表达下降相关,而TOPOⅡα启动子组蛋白乙酰化、甲基化化学修饰改变是其表达下降的机制之一[3-5]。
有学者认为TOPOⅡ的mRNA水平降低与其稳定性无关,而是由于其上游的转录因子表达水平降低,导致拓扑异构酶Ⅱ的启动子区活性下降,转录减少所致[12]。我们前期的研究提示TOPOⅡα表达降低与TOPOⅡα启动子组蛋白乙酰化、甲基化水平改变有关,是否TOPOⅡα表达降低还伴随着TOPOⅡα启动子调控因子组蛋白乙酰化、甲基化水平的改变?HeLa cell[J].Int J Mol Sci,2009,10(7) : 3255-3268.

表2 Sp1组蛋白乙酰化和甲基化化学修饰水平的变化Table 2.Histone acetylated and methylation modification change of Sp1 (Mean±SD.n=5)
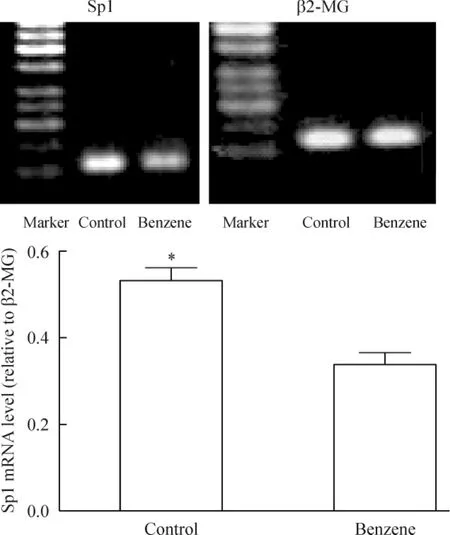
Figure 5.The results of RT-PCR for determining Sp1 mRNA expression level.Mean±SD.n=5.*P<0.05 vs control.图5 TOPOⅡα启动子调控因子Sp1 mRNA水平的变化
已知的TOPOⅡα启动子调控因子包括Sp1、ATF-2、Sp3、NF-YA、c-MYB、P53、ICBP90和c-Jun。Sp1是TOPOⅡα启动子重要的调控因子。人类TOPOⅡα启动子功能区有5个CCAAT盒及2个GC盒。2个GC盒GC1和GC2位于TOPOⅡα启动子的最近及最远区域,Sp1通过其3个“锌指结构”与TOPOⅡα启动区的GC/GT盒结合,招募启动子区的RNA聚合酶,增强TOPOⅡmRNA的转录,上调TOPOⅡ的表达[6,13-14]。我们针对TOPOⅡα启动子调控因子Sp1设计了相应的适合ChIP后产物的引物,来观察临床病例研究中Sp1水平的改变。我们的实验结果发现:临床苯中毒患者TOPOⅡα启动子调控因子Sp1结合的组蛋白H4和H3乙酰化水平降低,组蛋白H3K9甲基化水平升高,组蛋白H3K4甲基化水平无明显改变。结合组蛋白乙酰化与基因转录激活有关,去乙酰化常见基因转录沉默,组蛋白H3K4甲基化与基因转录活化相关,而组蛋白H3K9甲基化常见基因转录沉默,Sp1组蛋白H4、H3乙酰化及H3K9甲基化水平的改变可能参与了TOPOⅡα表达的降低,DNA水平证实了苯中毒患者骨髓单个核细胞中TOPOⅡα启动子的调控因子水平Sp1的改变,且伴随着Sp1的mRNA表达水平降低,与TOPOⅡα启动子的调控因子DNA水平的变化平行,为Sp1组蛋白乙酰化、甲基化水平改变参与TOPOⅡα表达降低提供了一定的依据。
本课题组将进一步研究组蛋白去乙酰化酶抑制剂和组蛋白去甲基化酶对造血损伤的逆转及对TOPOⅡα启动子、启动子调控因子Sp1组蛋白化学修饰的改变,为更进一步认识苯中毒相关疾病的发病机制及相关疾病的诊疗提供一定的依据。
[参考文献]
[1]McHale CM,Zhang L,Smith MT.Current understanding of the mechanism of benzene-induced leukemia in humans: implications for risk assessment[J].Carcinogenesis,2012,33(2) : 240-252.
[2]Lindsey RH,Bender RP,Osheroff N.Stimulation of topoisomerase II-mediated DNA cleavage by benzene metabolites[J].Chem Biol Interact,2005,153-154: 197-205.
[3]Yu K,Shi YF,Yang KY,et al.Decreased topoisomerase IIα expression and altered histone and regulatory factors of topoisomerase IIα promoter in patients with chronic benzene poisoning[J].Toxicol Lett,2011,203(2) : 111-117.
[4]施益芬,俞康,陈怡,等.氢醌对人骨髓单个核细胞拓扑异构酶Ⅱα表达的影响[J].中华劳动卫生职业病杂志,2010,28(9) : 660-663.
[5]施益芬,俞康,陈怡,等.氢醌对人骨髓单个核细胞拓扑异构酶Ⅱα表达的影响及其可能机制[J].温州医学院学报,2010,40(2) : 164-167.
[6]Zhou N,Yan Y,Li W,et al.Genistein inhibition of topoisomerase IIα expression participated by Sp1 and Sp3 in
[7]Smith MT.The mechanism of benzene-induced leukemia: a hypothesis and speculations on the causes of leukemia [J].Environ Health Perspect,1996,104 (Suppl 6) : 1219-1225.
[8]曾可静,李萡,牛宇哲,等.职业苯接触工人外周血T-bet和GATA-3表达变化的特点[J].中国病理生理杂志,2011,27(9) : 1807-1810.
[9]Backs J,Olson EN.Control of cardiac growth by histone acetylation/deacetylation[J].Circ Res,2006,98(1) : 15-24.
[10]Hampsey M,Reinberg D.Tails of intrigue: phosphorylation of RNA polymerase II mediates histone methylation [J].Cell,2003,113(4) : 429-432.
[11]Richards EJ,Elgin SC.Epigenetic codes for heterochromatin formation and silencing: rounding up the usual suspects[J].Cell,2002,108(4) : 489-500.
[12]Mo YY,Wang Q,Beck WT.Down-regulation of topoisomeraseⅡα in CEM cells selected for merbarone resistance is associated with reduced expression of Sp3[J].Cancer Res,1997,57(22) : 5004-5008.
[13]Suske G.The Sp-family of transcription factors[J].Gene,1999,238(2) : 291-300.
[14]Magan N,Szremska AP,Isaacs RJ,et al.Modulation of DNA topoisomerase IIα promoter activity by members of the Sp (specificity protein) and NF-Y (nuclear factor Y) families of transcription factors[J].Biochem J,2003,374(Pt 3) : 723-729.
(责任编辑:卢萍,罗森)
Histone acetylation and methylation modification of topoisomeraseⅡα promoter regulatory factor Sp1 in patients with chronic benzene poisoning
SHI Yi-fen,GAN Yi-feng,SHEN Zhi-jian,YU Kang
(Department of Hematology,The First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325015,China.E-mail: kangyu62@hotmail.com)
[ABSTRACT]AIM: To investigate the histone modification changes of topoisomeraseⅡα(TOPOⅡα) promoter regulatory factor Sp1 in the patients with chronic benzene poisoning.METHODS: The bone marrow samples were collected from 25 chronic benzene poisoning cases and 25 controls.The chromatin immunoprecipitation assay was carried out to study the possible mechanism of TOPOⅡα promoter regulatory factor Sp1 expression changes.The mRNA expression of Sp1 was detected by RT-PCR.RESULTS: Compared with the controls,the histone H4 acetylation and histone H3 acetylation of Sp1 in the chronic benzene poisoning patients significantly decreased (P<0.01),and histone H3K9 methylation level of Sp1 increased (P<0.01),but the histone H3K4 methylation level of SP1 was not obviously changed (P>0.05).The mRNA expression of Sp1 in the chronic benzene poisoning patients was significantly lower than that in the controls (P<0.05).CONCLUSION: In chronic benzene poisoning patients,the histone acetylation and methylation modification changes of TOPOⅡα promoter regulatory factor Sp1 accompanied with the changes of mRNA level are observed.Histone H4 and H3 acetylation and H3K9 methylation modification of Sp1 may play an important role in the benzene’s hematopoietic toxicities.
[KEY WORDS]Benzene; Sp1; Histone acetylation; Histone methylation; Chromatin immunoprecipitation
通讯作者△Tel: 0577-55578489; E-mail: kangyu62@hotmail.com
*[基金项目]国家自然科学基金资助项目(No.81172613) ;温州市科技局科研基金资助项目(No.Y20120004; No.Y20090238)
[收稿日期]2015-04-24
[文章编号]1000-4718(2015)09-1662-05
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.024
