抑制自噬促进MK-2206诱导SGC-7901胃癌细胞发生DNA损伤*
2015-04-27姜文艳吴玉梅庄梦玮王西双泰山医学院生命科学学院山东泰安706胜利油田机关医院药剂科山东东营57000泰山医学院生命科学研究中心山东泰安706
张 翠,姜文艳,吴玉梅,庄梦玮,王西双,焦 鹏(泰山医学院生命科学学院,山东泰安706;胜利油田机关医院药剂科,山东东营57000;泰山医学院生命科学研究中心,山东泰安706)
抑制自噬促进MK-2206诱导SGC-7901胃癌细胞发生DNA损伤*
张翠1,姜文艳1,吴玉梅2,庄梦玮1,王西双1,焦鹏3△
(1泰山医学院生命科学学院,山东泰安271016;2胜利油田机关医院药剂科,山东东营257000;3泰山医学院生命科学研究中心,山东泰安271016)
[摘要]目的:探讨蛋白激酶B(protein kinase B,Akt)抑制剂MK-2206对胃癌细胞SGC-7901DNA损伤的影响。方法:不同浓度的MK-2206作用于SGC-7901细胞后,免疫荧光检测细胞内DNA损伤标记分子磷酸化组蛋白H2AX(γ-H2AX)焦点的生成,Western blot检测DNA损伤相关蛋白的表达水平,同时观察MK-2206对自噬标志蛋白LC3-II表达量的影响,用以确定MK-2206是否促进细胞发生自噬。结果: MK-2206能够诱导SGC-7901细胞发生DNA损伤,促进细胞内γ-H2AX焦点生成,并且激活DNA损伤相关蛋白的表达; MK-2206作用细胞后,LC3-II的生成增加;抑制细胞的自噬显著增强了MK-2206诱导的H2AX磷酸化水平。结论: Akt抑制剂MK-2206能够诱导细胞发生DNA损伤和自噬,抑制自噬促进了MK-2206诱导的DNA损伤。
[关键词]MK-2206; Akt抑制剂; DNA损伤;γ-H2AX;细胞自噬
磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)信号通路参与细胞的增殖、存活和迁移等多种生命活动过程,与肿瘤的发生发展关系密切[1-2]。近年来,该通路多作为研究抗肿瘤治疗的靶点[3]。MK-2206是PI3K下游底物分子Akt的变构抑制剂,在多种肿瘤中显示出良好的抑癌活性,具有广阔的应用前景[4-6]。我们前期研究发现,MK-2206能够抑制肿瘤细胞的增殖并诱导细胞发生凋亡和自噬,协同促进肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)的抗肿瘤活性[7]。本研究以SGC-7901胃癌细胞为研究对象,检测MK-2206对肿瘤细胞DNA损伤和自噬的作用,观察抑制自噬对MK-2206诱导DNA损伤的影响,为MK-2206的临床用药提供理论依据。
材料和方法
1材料
MK-2206购自Selleck Chemicals; RPMI-1640培养基和胎牛血清购自Gibco; DAPI、氯喹(chloroquine,CQ)、3-甲基腺嘌呤(3-methyladenine,3-MA)、β-actin和LC3-II抗体购自Sigma; p-Akt抗体和细胞周期检测点激酶(checkpoint kinase,Chk) 1抗体购自Abcam;磷酸化组蛋白H2AX(phosphorylated histone H2AX,γ-H2AX)抗体、Akt抗体、p-Chk1抗体、Chk2抗体和p-Chk2抗体购自CST; HRP标记的Ⅱ抗均购自北京中杉金桥生物技术有限公司; FITC标记的羊抗兔Ⅱ抗购自Life Technologies。
2主要方法
2.1细胞培养胃癌细胞株SGC-7901由本室保存,常规传代培养。培养基采用含有10%胎牛血清的RPMI-1640培养基。
2.2免疫荧光检测γ-H2AX焦点细胞接种于盖玻片上,继续培养24 h,然后用不同浓度的MK-2206 (10、20 μmol/L)作用18 h。PBS洗涤玻片2次,4%多聚甲醛固定20 min,Triton X-100打孔5 min,BSA室温封闭30 min,I抗室温孵育2 h,加入荧光II抗37℃孵育1 h,荧光显微镜下观察并采集图像。实验重复3次。
2.3Western blot法细胞用预冷的PBS洗2次后加入RIPA细胞裂解液,冰上放置20 min,4℃13 000×g离心20 min,收集上清,然后进行蛋白定量。取30 μg总蛋白进行SDS-PAGE,电转移至PVDF膜上,5%脱脂奶粉封闭过夜。加入相关I抗室温孵育3 h,II抗室温孵育1.5 h。最后ECL显色试剂盒于暗室曝光显影,实验重复3次。
2.4细胞内GFP-LC3融合蛋白的表达接种SGC-7901细胞于6孔板中,待细胞融合至80%左右使用Lipofectamine 2000转染GFP-LC3质粒。细胞转染24 h后,加入MK-2206继续处理24 h,倒置荧光显微镜下观察。GFP-LC3融合蛋白一般呈弥散状态分布于胞浆中;当细胞发生自噬时,GFP-LC3融合蛋白转位至自噬体膜,在荧光显微镜下形成明亮的绿色斑点。
3统计学处理
采用SPSS 16.0统计软件分析,数据用均数±标准差(mean±SD)表示,多组间比较应用单因素方差分析,组间两两比较应用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1 MK-2206抑制SGC-7901细胞内Akt的磷酸化水平
Western blot结果显示,MK-2206显著抑制了胃癌SGC-7901细胞中Akt的磷酸化水平,见图1。
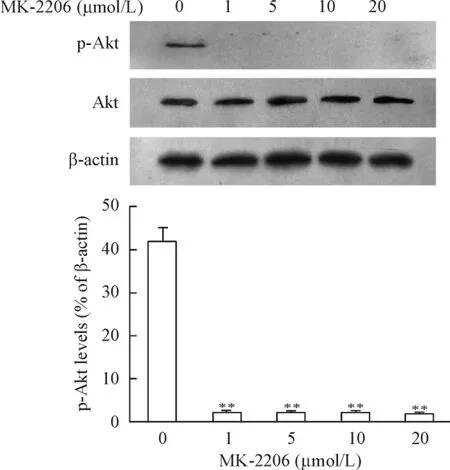
Figure 1.The effect of MK-2206 on the phosphorylation of Akt in the SGC-7901 cells treated with different concentrations of MK-2206 determined by Western blot.Mean ±SD.n=3.**P<0.01 vs 0 μmol/L.图1 Western blot检测MK-2206对SGC-7901细胞内Akt磷酸化水平的影响
2 MK-2206增加细胞内γ-H2AX焦点的生成
接着,采用免疫荧光检测了MK-2206对细胞内γ-H2AX焦点数量的影响,从而来确定细胞内的DNA损伤的变化。从图中可以看出,SGC-7901细胞经MK-2206作用后,γ-H2AX的焦点数目明显增多,且随着MK-2206浓度的增加,细胞内γ-H2AX焦点数量呈递增趋势。以上结果表明,MK-2206可能诱导SGC-7901细胞发生DNA损伤,见图2。
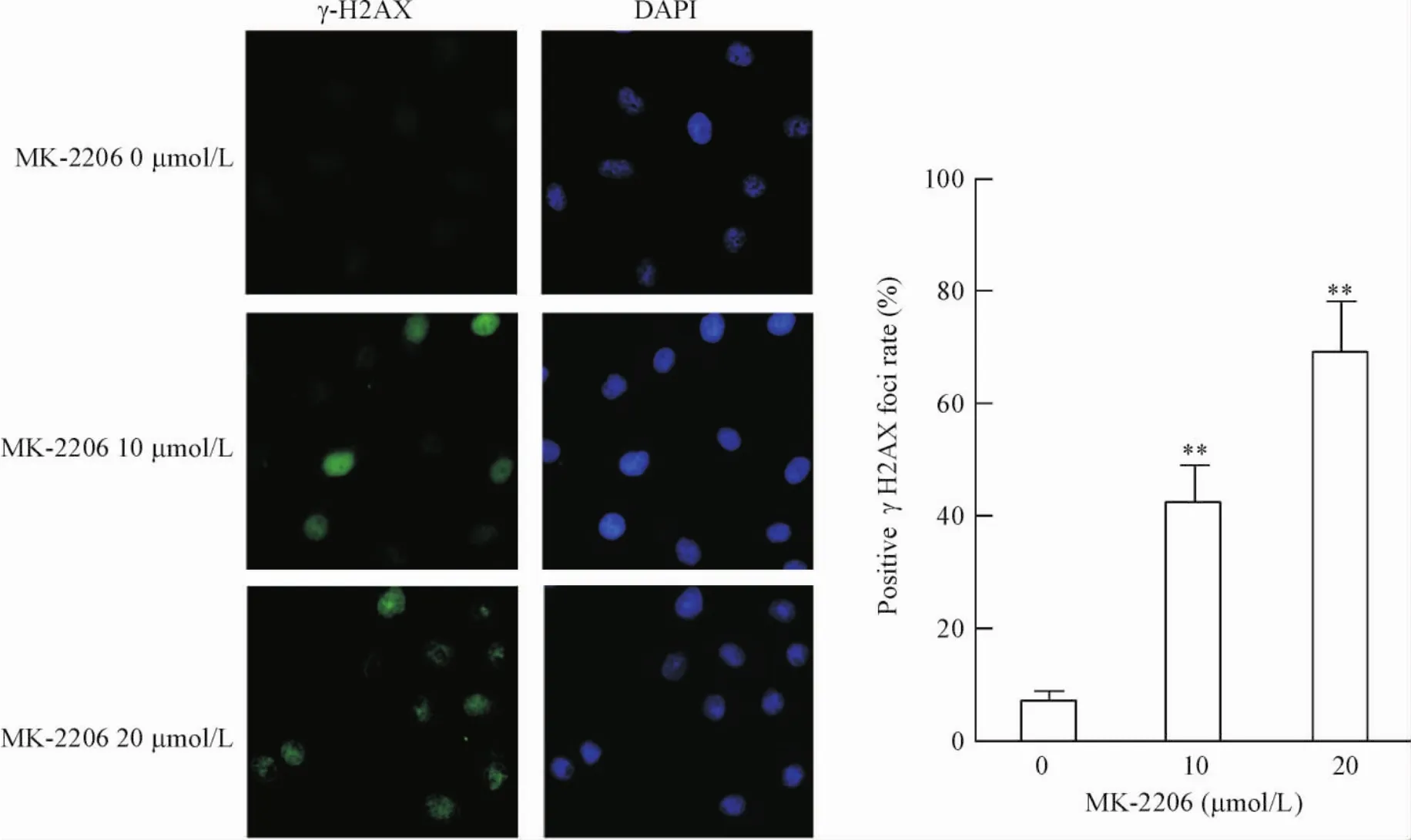
Figure 2.The formation of γ-H2AX foci in the SGC-7901 cells treated with different concentrations of MK-2206.Mean±SD.n=3.**P<0.01 vs 0 μmol/L.图2 MK-2206对SGC-7901细胞中γ-H2AX焦点生成的影响
3 MK-2206上调DNA损伤相关蛋白的表达
20 μmol/L的MK-2206上调了细胞内γ-H2AX的蛋白表达;与此同时,在MK-2206处理的细胞中,Chk2的磷酸化水平增加,而Chk1的磷酸化水平未见明显变化,见图3。
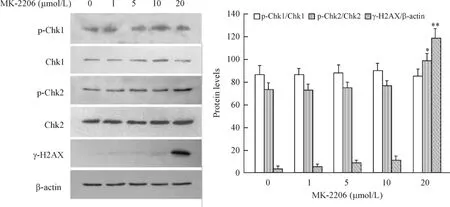
Figure 3.The effect of MK-2206 on the expression of DNA damage-related proteins detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs 0 μmol/L.图3 Western blot检测MK-2206对DNA损伤相关蛋白表达水平的影响
4 MK-2206诱导胃癌细胞发生自噬
转染GFP-LC3质粒的胃癌细胞经MK-2206作用24 h后,荧光显微镜观察到细胞内LC3蛋白的绿色点状荧光,而对照组绿色荧光呈弥散分布,见图4。
同时,免疫印迹检测了细胞内LC3-II的表达。从图中可以看出,MK-2206处理SGC-7901细胞后,LC3-II的生成量明显增加;另外,自噬相关蛋白beclin-1的表达水平也上调,见图5。

Figure 4.The formation of LC3-positive vesicles in MK-2206-treated GFP-LC3 transfected cells.图4荧光显微镜观察MK-2206处理的SGC-7901细胞中GFP-LC3荧光的分布
5阻断自噬促进MK-2206诱导的DNA损伤
胃癌细胞经过自噬抑制剂CQ和3-MA预处理后,促进了MK-2206诱导的γ-H2AX表达,表明抑制自噬能够促进MK-2206诱导的SGC-7901细胞损伤,见图6。
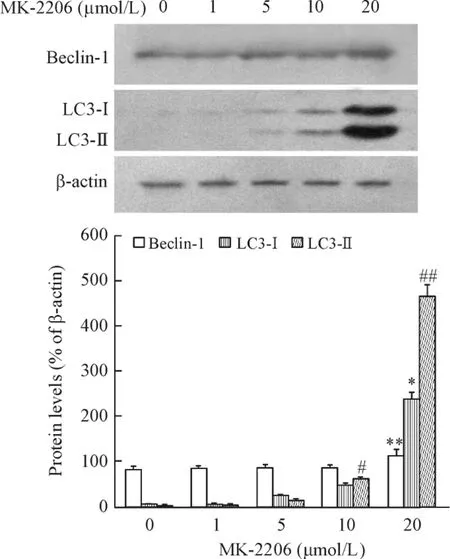
Figure 5.MK-2206 increased the expression of beclin-1 and LC3-Ⅱ.Mean±SD.n=3.*P<0.05 vs control (0 μmol/L) ;#P<0.05,##P<0.01 vs LC3-I.图5 MK-2206促进胃癌细胞内beclin-1和LC3-Ⅱ的表达
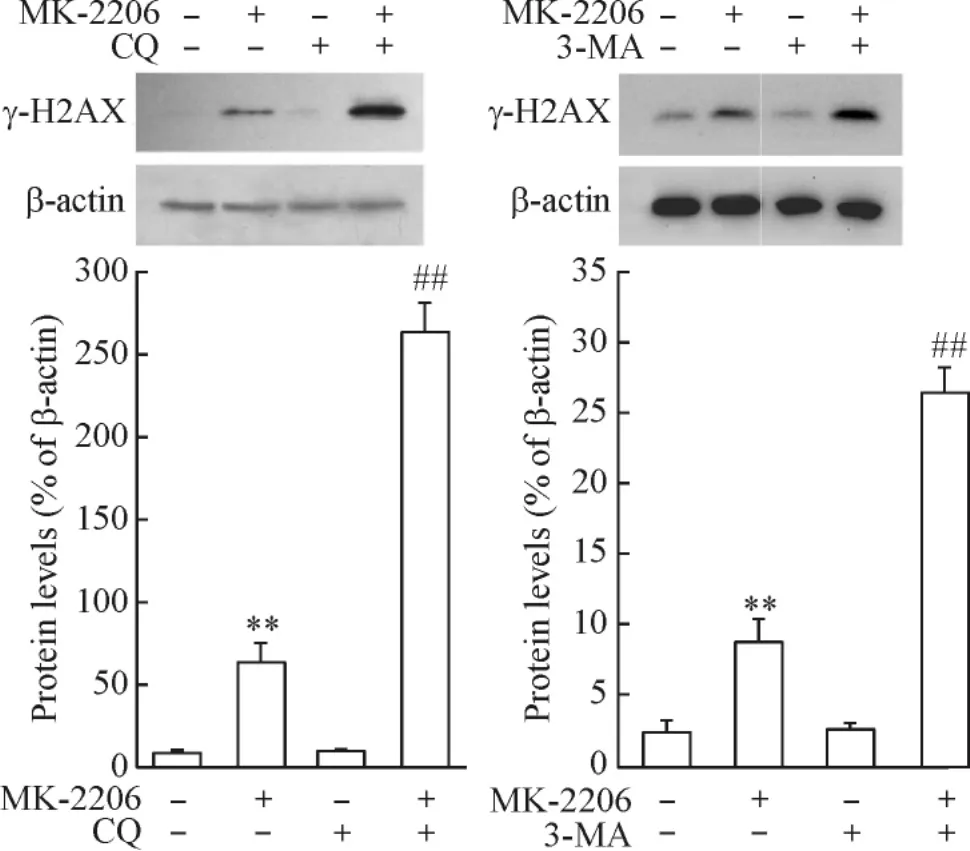
Figure 6.Inhibition of autophagy enhanced MK-2206-mediated H2AX phosphorylation.Mean±SD.n=3.**P<0.01 vs control;##P<0.01 vs MK-2206.图6抑制自噬促进MK-2206诱导的H2AX磷酸化
讨论
损伤DNA是临床治疗肿瘤常用的放、化疗治疗的手段,自噬与DNA损伤关系密切[8-9]。当细胞发生DNA损伤后,损伤识别因子便对损伤部位进行识别并修复,依据损伤的类型和程度不同,细胞会启动不同的信号转导通路。参与DNA损伤应答的关键因子有ATM、ATR和DNA-PK,其下游原件包括p53 和Akt等[10]。如果细胞有能力修复损伤的DNA,则出现细胞周期阻滞,进而促进DNA损伤修复;当DNA损伤严重或修复能力丧失,细胞启动线粒体凋亡通路诱导细胞发生凋亡[11-12]。因此,DNA修复能力异常激活和增强是导致肿瘤对DNA损伤剂耐药的重要分子基础,抑制DNA的修复则促进肿瘤对药物的敏感性。
H2AX是组蛋白的一个种类,普遍存在于整个基因组中。据报道,DNA双链断裂后可诱导位于丝氨酸-139位C-端保守区域内的组蛋白H2AX磷酸化形成γ-H2AX,在荧光显微镜下形成可见的γ-H2AX焦点。用特异性抗体的免疫荧光法检测γ-H2AX已成为衡量DNA双链断裂(double strand breaks,DSB)的标准[13]。当DNA损伤时,γ-H2AX招募修复蛋白并在DSB周围形成焦点。目前,γ-H2AX已经成为评价DSBs发生的标记分子,其形成与DNA双链损伤程度成正比。
调控细胞周期是抗肿瘤药物研究的重要方面。Chk1和Chk2在药物、电离辐射和紫外线等引起DNA损伤后被ATM和ATR磷酸化激活,在S期和G2期检测点调节中发挥重要作用,有可能成为肿瘤治疗放化疗增敏的新靶点[14]。
在本研究中,我们以胃癌SGC-7901细胞为研究对象,通过免疫荧光观察细胞内γ-H2AX焦点的生成来确认MK-2206对DNA损伤的诱导作用;通过免疫印迹检测细胞内DNA损伤应答相关因子表达水平的变化来探讨MK-2206诱导DNA损伤的可能作用机制。我们发现MK-2206处理SGC-7901细胞后,细胞内γ-H2AX的焦点增多,γ-H2AX的表达水平也增加,Chk2的磷酸化水平升高,表明MK-2206能够诱导SGC-7901细胞发生损伤,DNA损伤应答分子Chk2参与了该过程。
自噬是一种进化上高度保守的,由溶酶体介导的动态过程,是细胞在某些刺激因素(如DNA损伤、营养缺乏和缺氧等)作用下,细胞内膜性结构包围并降解损伤的细胞器或蛋白质的过程,参与了调节细胞物质的合成、降解和重新利用之间的代谢平衡[15-16],以达到细胞更新作用。在本研究中,我们首先观察了MK-2206对SGC-7901细胞自噬的影响。与MK-2206作用于其它肿瘤细胞类似,MK-2206也能够诱导SGC-7901细胞发生自噬。细胞自噬与DNA损伤间有着密切的关系。一方面,DNA损伤能诱导细胞自噬的发生,这在多种DNA损伤诱导剂的细胞毒性模型中都得到了证实;另一方面,自噬同样参与调控受损DNA的修复,参与调节多种损伤修复关键酶的表达而加速受损DNA的修复进程。
为了探讨MK-2206诱导的胃癌细胞自噬与DNA损伤应答的相关性,我们应用自噬特异抑制剂氯喹和3-甲基腺嘌呤来观察自噬的发生对MK-2206诱导DNA损伤的影响。研究结果表明,与MK-2206单药作用细胞相比,自噬抑制剂氯喹和3-甲基腺嘌呤联合MK-2206处理SGC-7901细胞,对细胞内γ-H2AX的诱导作用明显增强。这说明MK-2206诱导的自噬可能是保护性自噬,它部分抑制了MK-2206诱导的胃癌细胞DNA损伤。MK-2206和自噬抑制剂的联合应用可能为胃癌的临床治疗提供新策略。
[参考文献]
[1]Ma X,Hu Y.Targeting PI3K/Akt/mTOR cascade: the medicinal potential,updated research highlights and challenges ahead[J].Curr Med Chem,2013,20(24) : 2991-3010.
[2]王海燕,邹正渝,段亮,等.S100A6通过PI3K/Akt信号通路促进人骨肉瘤细胞143B增殖和迁移[J].中国病理生理杂志,2013,29(11) : 1928-1933.
[3]Garcia-Echeverria C,Sellers WR.Drug discovery approaches targeting the PI3K/Akt pathway in cancer[J].Oncogene,2008,27(41) : 5511-5526.
[4]Somnay Y,Simon K,Harrison AD,et al.Neuroendocrine phenotype alteration and growth suppression through apoptosis by MK-2206,an allosteric inhibitor of AKT,in carcinoid cell lines in vitro[J].Anticancer Drugs,2013,24 (1) : 66-72.
[5]Sangai T,Akcakanat A,Chen H,et al.Biomarkers of response to Akt inhibitor MK-2206 in breast cancer[J].Clin Cancer Res,2012,18(20) : 5816-5828.
[6]Jin R,Nakada M,Teng L,et al.Combination therapy using Notch and Akt inhibitors is effective for suppressing invasion but not proliferation in glioma cells[J].Neurosci Lett,2013,534: 316-321.
[7]Jiao P,Zhou YS,Yang JX,et al.MK-2206 induces cell cycle arrest and apoptosis in HepG2 cells and sensitizes TRAIL-mediated cell death[J].Mol Cell Biochem,2013,382(1-2) : 217-224.
[8]Woods D,Turchi JJ.Chemotherapy induced DNA damage response: convergence of drugs and pathways[J].Cancer Biol Ther,2013,14(5) : 379-389.
[9]Cavallo F,Feldman DR,Barchi M.Revisiting DNA damage repair,p53-mediated apoptosis and cisplatin sensitivity in germ cell tumors[J].Int J Dev Biol,2013,57(2-4) : 273-280.
[10]Ho SR,Mahanic CS,Lee YJ,et al.RNF144A,an E3 ubiquitin ligase for DNA-PKcs,promotes apoptosis during DNA damage[J].Proc Natl Acad Sci U S A,2014,111 (26) : E2646-E2655.
[11]Surova O,Zhivotovsky B.Various modes of cell death induced by DNA damage[J].Oncogene,2013,32(33) : 3789-3797.
[12]Darzynkiewicz Z,Zhao H,Halicka HD,et al.DNA damage signaling assessed in individual cells in relation to the cell cycle phase and induction of apoptosis[J].Crit Rev Clin Lab Sci,2012,49(5-6) : 199-217.
[13]胡波,施资坚,王遥,等.雪胆素乙诱导刀豆蛋白A刺激的小鼠淋巴细胞凋亡及其机制的研究[J].中国病理生理杂志,2014,30(3) : 509-513.
[14]王玉祥,祝淑钗.细胞周期检测点激酶CHK1、CHK2与放射敏感性[J].肿瘤学杂志,2007,13 (3) : 178-181.
[15]Gewirtz DA.The four faces of autophagy: implications for cancer therapy[J].Cancer Res,2014,74(3) : 647-651.
[16]MarioñG,Niso-Santano M,Baehrecke EH,et al.Selfconsumption: the interplay of autophagy and apoptosis [J].Nat Rev Mol Cell Biol,2014,15(2) : 81-94.
(责任编辑:卢萍,余小慧)
Blocking autophagy magnifies MK-2206-induced DNA damage in SGC-7901 cells
ZHANG Cui1,JIANG Wen-yan1,WU Yu-mei2,ZHUANG Meng-wei1,WANG Xishuang1,JIAO Peng3
(1School of Life Sciences,Taishan Medical University,Tai’an 271016,China;2Department of Pharmacy,Office Hospital of Shengli Oil Field,Dongying 257000,China;3Life Sciences Research Centre,Taishan Medical University,Tai’an 271016,China.E-mail: jiaopeng196@163.com)
[ABSTRACT]AIM: To investigate the effect of MK-2206,an inhibitor of protein kinase B (Akt),on the DNA damage of SGC-7901 cells.METHODS: SGC-7901 cells were treated with different concentrations of MK-2206,and phosphorylated histone H2AX (γ-H2AX) foci formation was detected by immunofluorescence staining.Western blot analysis was used to exam the levels of DNA damage-related protein.The expression of LC3-Ⅱwas determined to evaluate the change of autophagy.RESULTS: MK-2206 treatment increased the formation of γ-H2AX foci and histone H2AX phosphorylation in the SGC-7901 cells.The levels of DNA damage response protein were also increased.In addition,MK-2206-treated SGC-7901 cells increased the expression of LC3-II,a hallmark of autophagy.Inhibition of autophagy significantly enhanced MK-2206-mediated histone H2AX phosphorylation.CONCLUSION: MK-2206 induces DNA damage and autophagy in SGC-7901 cells.Blocking autophagy potentiates the response of MK-2206-induced DNA damage.
[KEY WORDS]MK-2206; Akt inhibitor; DNA damage;γ-H2AX; Cell autophagy
通讯作者:△ Tel: 0538-6225275; E-mail: jiaopeng196@163.com
*[基金项目]国家自然科学基金资助项目(No.81272683) ;山东省自然科学基金资助项目(No.ZR2014HL107) ;泰安市科技发展计划项目(No.201440774-14)
[收稿日期]2015-03-31[修回日期]2015-06-16
[文章编号]1000-4718(2015)09-1545-05
[中图分类号]R730.23; R735.2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.002
