脂多糖诱导的急性肺损伤模型建立
2015-04-26梁臣艳
冯 旭,郭 蕊,梁臣艳,吴 玲,李 盼
(广西中医药大学,广西 南宁 530001)
脂多糖诱导的急性肺损伤模型建立
冯 旭,郭 蕊,梁臣艳*,吴 玲,李 盼
(广西中医药大学,广西 南宁 530001)
目的:建立脂多糖诱导的急性肺损伤模型。方法:随机将60只昆明种小鼠分为5组,分别向小鼠尾静脉注射生理盐水和不同剂量的脂多糖,12h后检查并评估各组小鼠的急性肺损伤情况,以确定合适的建模脂多糖剂量。确定合适的脂多糖剂量后,采用ELISA法分别于2、6、12h末摘取小鼠眼球取血并分离血清,测定血清中hs-CRP、IL-1β、TNF-α水平;采用HE染色观察小鼠肺脏病理形态变化。结果:脂多糖剂量为4mg/kg时,小鼠血清hs-CRP、IL-1β、TNF-α可持续保持较高水平。HE染色后,AIL组小鼠光镜下可见以肺泡正常结构消失、肺泡间隔明显增厚、肺泡腔内出血、大量炎性细胞浸润为主要表现的组织病理变化,肺损伤6h最为明显。结论:向小鼠尾静脉注射脂多糖4mg/kg可成功复制AIL小鼠动物模型。
脂多糖;急性肺损伤;动物模型
急性肺损伤(ALI)是指由心源性因素以外的各种肺内外致病因素导致的急性、进行性缺氧性呼吸衰竭,以肺部容积减少、肺顺应性降低、通气/血流比例失调为病理特征,肺部影像学表现为非均一性渗出性病变,主要临床症状为进行性低氧血症和呼吸窘迫[1]。ALI发展至严重阶段被称为急性呼吸窘迫综合征(ARDS)。近年来,ALI/ARDS的发病率逐年升高,且死亡率高达30%~40%[2]。内毒素是G-细菌细胞壁的重要成分,又名脂多糖。当细菌死亡溶解或被人工破坏时,其可被释放到细胞外,对宿主产生毒性效应[3]。大量炎症细胞参与了机体炎症反应,其中中性粒细胞(PMN)是导致细胞损害和肺组织损伤的主要效应细胞,也是造成过度性、失控性炎症反应的主要因素。炎症介质是参与和介导炎症反应的化学因子,其中超敏C反应蛋白(hs-CRP)、肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)等是重要的细胞炎症介质,是研究表征炎症是否存在以及严重程度的重要指标,已成为临床测试是否有炎症存在及其严重程度的通用指标[4-6]。
1 材料与试剂
1.1 动物
健康昆明小鼠,体重(18.0±2.0)g,雄性,由广西医科大学实验动物中心提供 (合格证号:SCXK桂2009-0002)。
1.2 试剂
大肠杆菌脂多糖(批号:1010A032,美国Sigma公司);无菌生理盐水(批号:A12061505,广西裕源药业有限公司);多聚甲醛(批号:20100626,天津市博迪化工有限公司);小鼠hs-CRP ELISA试剂盒(批号:201010,美国 R&D 公司);小鼠TNF-α ELISA试剂盒(批号:201010,美国R&D公司); 小鼠IL-1βELISA 试剂盒(批号:201010,美国 R&D 公司)。其余试剂均为分析纯。
1.3 仪器
电热恒温培养箱(型号:HHBII,上海跃进医疗器械厂);电热恒温鼓风干燥箱(型号:101-1-BS,上海跃进医疗器械厂);高压自动灭菌器(型号:MLS-3750,日本三洋公司);低温高速离心机(型号:ST16R,美国热电公司);冰箱(型号:BCD-192DC,青岛海尔公司);全波长酶标仪(型号:Epoch,美国伯腾仪器有限公司)。
2 方法
2.1 脂多糖溶液配制
将适量LPS溶于生理盐水中配制成500μg/mL的溶液,临用现配,剩余溶液暂放 4℃ 冰箱内储存,储存时间不超过24h。
2.2 4%多聚甲醛溶液配制
精确称取40g多聚甲醛,加入pH7.4 PBS溶液800mL,磁力搅拌器搅拌加热至60℃,滴加NaOH溶液,完全溶解后,冷却定容至1L,4℃储藏备用。
2.3 小鼠尾静脉注射脂多糖剂量确定
2.3.1 动物分组与处理 选择健康昆明种小鼠50只,按照LPS剂量(1、2、3、4 及5mg/kg)分为5组,各组小鼠尾静脉注射相应剂量的脂多糖,另选择10只小鼠作为对照组,采用等体积无菌生理盐水以同样方法尾静脉注射。摘取小鼠眼球取血,室温下血液自然凝固30min后,于4℃下3 000r·min-1离心20min,分离血清,分装冻存于-20℃。采用ELISA法检测血清中hs-CRP、IL-1β、TNF-α含量。随后摘取小鼠左肺上叶,以4%多聚甲醛溶液固定,常规石蜡切片,HE染色后进行病理组织镜检。
2.3.2 血清 hs-CRP、IL-1β、TNF-α检测 分别采用hs-CRP、IL-1β、TNF-α的ELISA检测试剂盒,按照说明书操作。
2.4 尾静脉注射脂多糖诱导小鼠急性肺损伤的时间效应
2.4.1 动物分组与处理 取雄性小鼠40只,随机分为空白对照组(空白组),不同给药时间组(2、6、12h)ALI组,每组10只。根据小鼠体重尾静脉注射 LPS 4mg/kg,并于给药2、6、12h后取样,空白组小鼠尾静脉注射等体积无菌生理盐水,于2、6、12h后取样。
2.4.2 动物标本采集 ALI各组小鼠注射LPS后,于 2、6、12h 末摘取小鼠眼球取血,室温下血液自然凝固30min后,于4℃下 3 000r·min-1离心20min,血清分离后分装,-20℃冻存。采用ELISA法检测血清中hs-CRP、IL-1β、TNF-α含量。摘取小鼠左肺上叶,置于4%中性甲醛溶液中固定24h,常规脱水石蜡包埋,制作切片,厚度为5μm,伊红染色(HE 染色)。
2.4.3 血清hs-CRP、L-1β、TNF-α检测 操作同“2.3.2”。
2.5 观察指标
在实验期间,即从开始进行尾静脉注射至实验结束为止,观察各组小鼠的一般状态和大体标本。
2.6 检测方法
取处理好的动物标本,于光镜下观察病理组织的形态变化。肺损伤评价指标为肺泡和间隙水肿程度、中性粒细胞浸润程度以及出血程度。设置的评估标准[22]为(视野里):无损伤=0;25%损伤=1;50%损伤=2;75%损伤=3;全都损伤=4。
2.7 统计学方法

3 结果
3.1 小鼠一般状态和大体标本观察
对照组小鼠呼吸平稳,进食正常,对外界刺激反应无异常,无死亡;肺叶外观无异常,质软,弹性好,呈粉红色。脂多糖各剂量组小鼠精神萎靡,活动减少、食欲下降、呼吸急促,四肢、口唇发绀。脂多糖剂量达到4mg/kg后,小鼠肺脏可见明显淤血点、出血点和水肿,尤以6h组最为明显。
3.2 各剂量组小鼠血清L-1β、TNF-α及hs-CRP水平比较
尾静脉注射LPS后,小鼠血清中炎症细胞因子hs-CRP、IL-1β、TNF-α 水平均明显升高,LPS1组、LPS2组、LPS3组小鼠血清hs-CRP、TNF-α水平与空白对照组比较差异无统计学意义(P>0.05);LPS4组、LPS5组小鼠血清hs-CRP、IL-1β、TNF-α水平显著高于空白组,差异具有统计学意义(P<0.01)。见表1。
3.3 时间效应的血清hs-CRP、IL-1β、TNF-α水平比较
尾静脉注射 LPS 后,ALI 组小鼠血清炎性细胞因子IL-1β、TNF-α、hs-CRP水平均明显增加且显著高于空白组,与空白组比较差异均有统计学意义(2h组vs空白组、6h组vs空白组、12h组vs空白组P均<0.01)。随着时间的延长,小鼠血清 hs-CRP水平呈逐渐上升趋势;血清TNF-α水平经LPS处理2h后达到高峰,6h时有所降低;血清IL-1β水平2h时达到高峰,6h时IL-1β水平有所降低,但仍高于空白组。结果见表2与图1。
3.4 水平剂量的肺组织病理学评分比较
染色HE结果显示,空白组小鼠无明显炎症反应。对照组小鼠尾静脉注射LPS后, LPS3、LPS4、LPS5剂量均可引起小鼠肺组织充血、水肿及炎症细胞浸润,与空白组比较差异具有统计学意义(P<0.01)。LPS3组小鼠肺脏HE染色镜检中仅见轻度炎症细胞浸润,炎症反应轻微;LPS4组小鼠肺脏可见炎症细胞轻到中度浸润,伴有组织淤血水肿,水肿程度不等,炎症反应较明显;LPS5组小鼠可见大量炎症细胞浸润,并伴有淤血。LPS1组、LPS2组小鼠肺组织病理学表现与空白组比较,差异无统计学意义(P>0.05)。见表3。
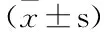

组别剂量(mg/kg)hs-CRP(mg/L)TNF-α(ng/L)IL-1β(ng/L)空白组-24.03±1.19228.04±22.5457.55±3.40LPS1124.55±1.27262.56±28.6370.31±3.94▲▲LPS2225.21±1.34248.10±31.0173.75±6.745▲▲LPS3325.36±1.08253.88±32.5369.87±6.00▲▲LPS4425.91±0.78▲▲268.99±33.85▲76.13±5.20▲▲LPS5527.25±2.07▲▲290.47±58.35▲▲83.11±13.29▲▲


组别hs-CRP(μg/L)TNF-α(ng/L)IL-1β(ng/L)空白组4.07±0.49416.27±49.2739.42±9.39LPS2h5.34±0.92▲▲582.08±70.98▲▲76.18±7.45▲▲LPS6h5.89±0.81▲▲561.96±71.94▲▲65.75±10.88▲▲LPS12h6.29±0.97▲▲528.45±64.16▲▲58.59±10.15▲▲

图1 各组小鼠血清hs-CRP、TNF-α、IL-1β水平比较

表3 水平剂量的肺部炎症组织病理学评分比较
3.5 时间效应的肺组织病理学评分比较
染色HE结果显示,空白组小鼠无明显炎症反应。对照组小鼠肺组织在光镜下发生病理学改变,可见肺泡间隔增宽,部分肺泡塌陷,内浸润有较多数量的中性粒细胞,明显充血,中性粒细胞浸润程度与出血程度均显著高于空白组,差异具有统计学意义(P<0.01),以6h最为显著,12h次之,2h最弱。见表4。


组别给药剂量(mg/kg)炎症评分空白组-0.50±0.53LPS2h42.60±0.70▲▲LPS6h43.20±0.63▲▲LPS12h42.00±0.67▲▲
4 讨论
本研究设置了不同剂量的LPS(1、2、3、4、5mg/kg) ,旨在确定复制小鼠ALI模型的最佳条件,通过测定血清中炎症细胞因子的水平和病理变化,综合评价ALI模型是否成功建立。从实验结果可知,不同剂量的脂多糖可引起不同程度的ALI:当LPS≥4mg/kg时,小鼠出现明显的呼吸困难、四肢、口唇发绀等症状,血清中TNF-α、IL-1β、hs-CRP水平均显著升高,出现炎症细胞浸润与组织瘀血水肿等病理学变化。该变化与ALI病程发展过程相似,说明当LPS≥4mg/kg时,可显著引发小鼠释放抗炎因子。当LPS剂量为5mg/kg时,可导致小鼠死亡现象,因此4mg/kg LPS为建立小鼠急性肺损伤模型的安全剂量。
本实验采用小鼠制备急性肺损伤模型,尾静脉注射LPS 4mg/kg后,对3个时间点的小鼠血清促炎因子hs-CRP、TNF-α、IL-1β水平以及肺损伤程度进行检测,初步探讨肺损伤过程中炎性介质的相互关系及其变化规律。病理结果显示,空白组小鼠肺组织形态结构变化不明显,小鼠在注射LPS 2h后出现肺损伤,损伤程度随时间变化,6h时损伤最明显,表现为肺泡间隔明显增厚,部分肺泡塌陷,大量中性粒细胞浸润,明显充血;但至12h时,病理变化又趋向减轻。实验结果表明,LPS注射6h时小鼠出现明显的肺组织结构损伤,证实ALI模型复制成功。
综上所述,从开始进行尾静脉注射至观察终点为止,各组小鼠全部存活,表明4mg/kg剂量的 LPS 安全性较高,用于静脉注射建模安全性良好,且病理学改变以6h时最为显著。
[1] 钱桂生.急性肺损伤和急性呼吸窘迫综合征研究现状与展望[J].解放军医学杂志,2003,28(2):97-101.
[2] 缪李丽,骆玲,王导新.Ang-2在大鼠内毒素性急性肺损伤中的作用[J].细胞与分子免疫学杂志,2009,25(11):1005.
[3] 张霞,剡根强,王静梅.细菌内毒素的研究概况[J].上海畜牧兽医通讯, 2006(4):4-5.
[4] KANEHARA M,YOKOYAMA A,TOMODA Y,et al. Anti-inflammatory effects and clinical efficacy of theophylline and tulobuterol in mild-to-moderate chronic obstructive pulmonary disease[J]. Pulmonary pharmacology & therapeutics,2008,21(6):874-878.
[5] WITONSKI D,WAGROWSKA-DANILEWICZ M,KESKA R,et al. Increased interleukin 6 and tumour necrosis factor alpha expression in the infrapatellar fat pad of the knee joint with the anterior knee pain syndrome: a preliminary report[J]. Polish Journal of Pathology, 2010,61(4):213-218.
[6] SUHWM, PARK SB, LEE S,et al. Suppression of mast-cell-mediated allergic inflammation by Lindera obtusiloba[J]. Experimental biology and medicine,2011,236(2):240-246.
(责任编辑:尹晨茹)
Establishment of Animal Model of Acute Lung Injury in Mice Induced by Lipopolysacharide
Feng Xu,Guo Rui,Liang Chenyan*,Wu Ling,Li Pan
(Guangxi University of Chinese Medicine, Nanning 530001,China)
Objective:To establish acute lung injury(ALI) model induced by liPopolysaccharide in mice. Methods:Kun-ming mice were injected respectively with isometric stroke-physiological saline solution and LPS, An evaluation on acute lung injury was been executed at the end of 12h to confirmed anappropriate LPS dose for establishing mice model. The mice were culled eye ball after injected proper dose of LPS for 2h, 6h, 12h. The levels of serum high-sensitivity C-reactive protein (hs-CRP), tumor necrosis factor alpha (TNF-α), interleukin-1β (IL-1β) and were detected by enzyme-linked immunosorbent assay. Regular HE staining was applied to evaluate the inflammatory reaction of lung tissue. Results:The level of mice serum IL-1β,TNF-α and hs-CRP were raised after injection of LPS 4mg/kg. By microscopy, the lung tissue strueture of mices in ALI group were damaged, a large mount of neutrophil recruitment and the thiekened interalveolar septum with signifieantly hyperemia in lung tissue of the LPS group. Such changes listed above appeared most severely at the time Point of 6h after the injection of LPS. The ALI pathological score of the mices of the LPS group was higher than that of NS group. Conclusion:The ALI mice model could be duplicated successfully infusing by injection of LPS 4mg/kg in caudal vein.
LPS; ALI; Animal Model
2015-03-27
国家自然科学基金(81060336);广西自然科学基金( 2011GXNSFF018006);“八桂学者”工程专项经费
冯旭(1976-),男,广西中医药大学副教授,研究方向为中药、民族药有效成分和质量控制。
梁臣艳,女,广西中医药大学副教授,硕士生导师,研究方向为中药有效成分和质量控制。
R363
A
1673-2197(2015)14-0005-03
10.11954/ytctyy.201514003
