丙氨酰谷氨酰胺注射液处方筛选及稳定性研究
2015-04-26徐志文刘小娟陈晓云任泽林
徐志文,王 静,刘小娟,陈晓云,任泽林
(1.山东大学 药学院,山东 济南,250012;2.辰欣药业股份有限公司,山东 济宁272073;3.济宁市第二人民医院,山东 济宁272049;4.济宁京华眼科医院,山东 济宁272000)
丙氨酰谷氨酰胺注射液处方筛选及稳定性研究
徐志文1,2,王 静2,刘小娟3,陈晓云4,任泽林2
(1.山东大学 药学院,山东 济南,250012;2.辰欣药业股份有限公司,山东 济宁272073;
3.济宁市第二人民医院,山东 济宁272049;4.济宁京华眼科医院,山东 济宁272000)
目的:筛选丙氨酰谷氨酰胺注射液的制备工艺并进行初步稳定性研究。方法:通过对关键控制点活性炭用量、pH值、灭菌参数、充氮与否的筛选确定最佳处方,考察样品的稳定性。结果:最佳处方关键控制点为活性炭用量0.05%,pH值为5.4~6.0,灭菌参数为115℃、30min,配制及灌装过程全程充氮,以该处方制备的样品在市售包装条件下经加速、室温留样考察,质量稳定。结论:该处方设计合理,制备的注射液稳定。
丙氨酰谷氨酰胺注射液;制备工艺;稳定性
丙氨酰谷氨酰胺注射液主要成分为丙氨酰谷氨酰胺,其在体内可迅速分解为谷氨酰胺和丙氨酸,作为营养物质在机体内进行代谢。适用于需要补充谷氨酰胺的患者,包括处于分解代谢和高代谢状况的患者[1-3]。国家药品标准提高后,发现本品的已知杂质环-(L-丙氨酰-L-谷氨酰)超过限度(≤0.05%),因此本研究对其生产工艺严格筛选,制备出稳定的样品。
1 仪器与试药
1.1 仪器
日本岛津LC-20AT高效液相色谱仪(SPD-20A二极管阵列检测器、RID-10A泵),紫外-可见分光光度计,XS205Du型电子分析天平(梅特勒-托利多仪器上海有限公司)、HWS-12电热恒温水浴锅(上海精密科学仪器有限公司);320-S型酸度计(梅特勒-托利多仪器上海有限公司)。
1.2 试药
丙氨酰谷氨酰胺(批号140421301;厂家:辰欣药业股份有限公司)、环-(L-丙氨酰-L-谷氨酰胺)对照品(批号:1049962;厂家:瑞士巴亨公司(Bachem))、环-(L-丙氨酰-L-谷氨酰)对照品(批号:0546372;厂家:瑞士巴亨公司(Bachem))、L-焦谷氨酰-L-丙氨酸对照品(批号:1049580;厂家:瑞士巴亨公司(Bachem))、L-焦谷氨酸对照品(批号:1.2;厂家:EDQM)、D-丙氨酰-L-谷氨酰胺对照品(批号:1034612;厂家:瑞士巴亨公司(Bachem))、丙氨酰谷氨酰胺对照品(批号:X2GBC-MS;厂家:东京化成工业株式会社(Tokyo Chemical Industry Co.,Ltd))、L-丙氨酰-L-谷氨酸对照品(批号:1034574;厂家:瑞士巴亨公司(Bachem));活性炭(批号:1001087,厂家:上海兴长活性炭有限公司)。
2 制备工艺
2.1 充氮工艺
为提高样品稳定性,选择在配料和灌封时充入氮气,以置换存在于溶液中和玻璃瓶上方的氧气,提高本品的稳定性。为此,进行了充氮气与不充氮气的比较研究。
充氮气样品制备:量取800mL注射用水,持续充入氮气,冷却至50℃,加入丙氨酰谷氨酰胺200g,搅拌使完全溶解。用0.1mol/L盐酸或者氢氧化钠调节pH值至5.4~6.0,补加注射用水至全量。充氮下灌封于常规工艺洗净的50mL输液瓶中,上塞、轧盖。115℃灭菌30min。
不充氮气样品制备:除配制和灌封全过程不充氮气外,其他操作同充氮气样品的制备。
将充氮与不充氮的灭菌样品分别在高温60℃下放置10天,取样检测关键质量指标,并与0天数据比较,结果见表1。

表1 充氮工艺研究结果
结果表明,0时充氮样品质量要好于0时不充氮样品;60℃放置10天后,充氮样品与0时相比,pH值、有关物质及含量变化不大,均合格;未充氮样品与0时相比,pH值及含量基本没变,但有关物质变化较大,部分杂质超限。故本品在配制和灌装时充氮进行氧气置换对产品质量有明显的提高,选择在生产工艺中全程充氮。
2.2 不同pH值筛选
国内已上市的丙氨酰谷氨酰胺注射液(50mg∶10g) pH值范围为5.4~6.0,据此,对本品在该pH值范围内的稳定性进行试验,以最终确定本品的pH值范围。
样品制备方法:量取1 200mL注射用水,持续充入氮气,冷却至50℃,加入丙氨酰谷氨酰胺300g,搅拌使完全溶解。
将配制好的样品平均分为3份,分别用0.1mol/L盐酸或氢氧化钠调节pH值至5.4、5.7、6.0,补加注射用水至全量。充氮下灌封于常规工艺洗净的50mL输液瓶中,上塞、轧盖。115℃灭菌30min,将灭菌后的成品于60℃下放置10天考察样品的稳定性。结果见表2。
经试验证明,本品在pH 5.4~6.0范围内,经115℃灭菌30min得到的成品高温放置10天后与0时相比:pH值、性状几无变化;已知杂质有所增大;含量基本没变;三个不同pH值的样品平行性良好,因此,选择本品的pH值为5.4~6.0。
2.3 活性炭用量筛选
样品制备方法:量取1 200mL注射用水,持续充入氮气,冷却至50℃,加入丙氨酰谷氨酰胺300g,搅拌使完全溶解。用0.1mol/L盐酸或者氢氧化钠调节pH值至5.4~6.0。
将配制好的样品平均分为3份,一份不加药用炭吸附,另外两份分别加入0.05%(g/mL)、0.08%(g/mL)药用炭,搅拌15min,脱碳后,补加注射用水至全量,搅匀。过滤后考察半成品的性状、可见异物、细菌内毒素、pH值和含量。结果见表3。

表2 不同pH值筛选结果
试验结果说明,在配制过程中加0.05%(g/mL)及0.08%(g/mL)药用炭,所制成样品的性状、可见异物符合规定,对pH值没有影响,对主药略有少量吸附,为保证在以后生产过程中产品的质量,确定在配制过程中加入0.05%(w/v)活性炭。

表3 活性炭用量筛选
2.4 灭菌温度选择
样品制备方法为:量取1 200mL注射用水,持续充入氮气,冷却至50℃,加入丙氨酰谷氨酰胺300g,搅拌使完全溶解。用0.1mol/L盐酸或者氢氧化钠调节pH值至5.4~6.0,加入0.75g活性炭,搅拌吸附15min,脱碳后,补加注射用水至全量。
充氮下灌封于常规工艺洗净的50mL输液瓶中,上塞、轧盖。将样品分为3份,一份留作半成品,另两份分别选用115℃灭菌30min,121℃灭菌15min。考察两种灭菌条件下成品的情况。结果见表4。
从上述实验结果看,121℃、15min下,样品的含量略有下降,有关物质增加较大,且有大部分已超过限度。115℃、30min灭菌条件与半成品相比,pH值、含量及有关物质变化均不大。故选择115℃、30min为最终的灭菌温度。
3 制备样品初步稳定性分析
通过上述筛选,最佳处方关键控制点定位活性炭用量为0.3%,pH值为5.4~6.0,灭菌参数为115℃、30min,配制及灌装过程全程充氮,以该处方制备的样品置于加速条件温度(40±2)℃、相对湿度(75±5)%及长期条件温度(25±2)℃、相对湿度(60±10)%进行初步稳定性考察。结果见表5、表6。

表4 灭菌温度选择

表5 加速试验结果
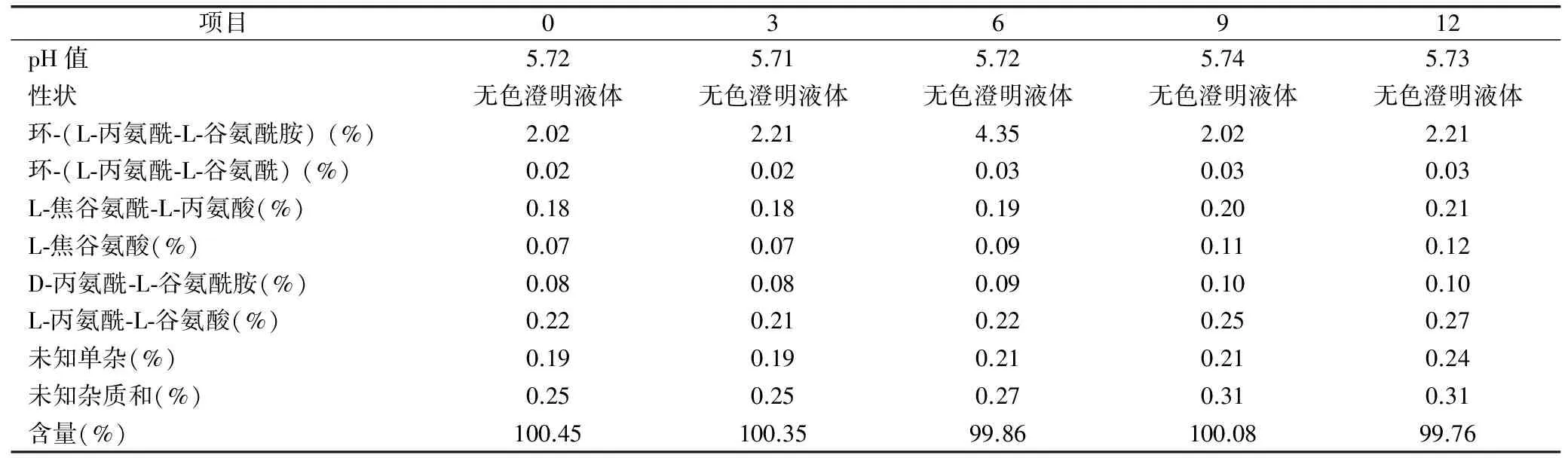
表6 长期试验结果
从以上实验结果可以看出该产品在加速6个月内、长期12个月内pH值、性状、有关物质及含量均符合规定,表明该产品质量较稳定。
4 讨论
从氮气处方筛选结果看,氮气对产品质量影响较大,因此为保证产品质量,实际生产时配制及灌装过程要全程充氮。从pH值、活性炭及灭菌参数筛选结果看,pH值定在5.4~6.0,活性炭用量为0.05%,灭菌参数为115℃、30min,生产出来的样品已知杂质环-(L-丙氨酰-L-谷氨酰)均小于0.05%,且样品较稳定,工艺可行。
[1] 刘敬臣,王海棠,王维.丙氨酰—谷氨酰胺对脓毒症大鼠肺损伤的保护作用[J].中南大学学报:医学版,2008,33(12):1095-1100.
[2] 孙忠民,杨岚,于楠等.丙氨酰—谷氨酰胺在有创机械通气时防治肠功能衰竭的作用[J].中国医师进修杂志,2007,30(11):53-54.
[3] 杨清茹,张敬浩等.丙氨酰—谷氨酰胺对重症肺炎患者肠黏膜及免疫功能的影响[J].中外医学,2013,32(36):105-108.
(责任编辑:魏 晓)
Alany Glutamine Injection Prescription Screening and Preliminary Stability Study
Xu Zhiwen1,2,Wang Jing2,Liu Xiaojuan3,Chen Xiaoyun4,Ren Zhelin2
(1.Shandong University School of Pharmacy,Jinan 250012,China;2.Chen xin pharmaceutical co.,Ltd.,Jining 272073,China; 3.Shandong Jinig NO.2.People's hospital,Jining 272049,China;4.Jining jinghua eye hospital,Jining 272000,China)
Objective:Screening the preparation technology of Alany glutamine injection through the scientific method and carries on the preliminary stability study.Methods:To determine the best prescription according to the key control point activated carbon dosage,pH value,the sterilization parameters and nitrogen or not and inspection the stability of the samples.Results:the key control point in optimized formula was the following:the activated carbon dosage was 0.05%,the pH value was 5.4~6.0,and the sterilization parameters was 115℃,30min;The samples prepared in this formula were stable in quality in the accelerated,room temperature storage test under the condition of commercial packing.Conclusion:The prescription is reasonable in design and the injection is stable in quality.
Alany Glutamine Injection;Preparation Technology;Stability
2015-07-07
徐志文(1980-),男,辰欣药业股份有限公司助理工程师,研究方向为制药工程。
R284.1
A
1673-2197(2015)19-0025-03
10.11954/ytctyy.201519011
