固相萃取-高效液相色谱法测定废水中的酚类化合物
2015-04-26李爱民贺小敏陈瑞文
刘 彬,李爱民,贺小敏,2,陈瑞文,张 强
1.湖北省环境监测中心站,湖北 武汉 430072
2.华中农业大学食品科技学院,湖北 武汉 430070
3.湖北省环境科学研究院,湖北 武汉 430072
4.浠水县环境保护局,湖北 浠水 438200
酚类化合物是一类重要的有毒有害物质,它既有亲水性基团,又有疏水性基团,其中疏水性基团会与生物体细胞的某些结构片段结合,导致细胞的组织结构发生改变,于是亲电的代谢产物就能结合在生物体细胞上,严重损害DNA和酶[1-2]。美国环保署早在20世纪70年代就将11种酚类化合物列入129种环境优先污染物之中[3-4],中国也于20世纪90年代提出了符合国情的68种水中优先控制污染物,其中6种是酚类化合物[5]。环境中的酚类化合物主要来自于制药、印染、造纸、农药等工农业生产过程的废水排放[6],因此对相关行业废水中酚类化合物的测定具有非常重要的意义。
目前对水样中酚类化合物的测定主要是基于色谱技术建立的,包括气相色谱法[7]、气相色谱-质谱法[8]、高效液相色谱法[9]等。以气相色谱为基础的分析方法往往需要对目标化合物进行衍生来产生检测信号,避免峰拖尾和变宽或是增加其挥发性,在这个过程中常常会造成目标化合物的损失和污染,相比之下,高效液相色谱法就显得更为方便恰当。然而用高效液相色谱法对环境水样(特别是废水样品)中酚类化合物进行分析时,又会经常遇到基质复杂、目标化合物浓度低等不利因素,因此合适的样品前处理手段必不可少。其中液-液萃取法(LLE)是最为常见的经典方法[10-11],缺点是有机溶剂使用量大、耗时较长、对较脏水样净化效果差,于是渐渐被固相萃取法(SPE)所取代[12]。固相萃取法的基本原理是先将大体积水样连续通过充有填料的固相萃取柱,目标化合物和部分杂质会同时被吸附在填料上,此后再用小体积的洗脱剂将目标化合物选择性淋洗下来,可同时起到净化和浓缩的效果,并且有机溶剂用量小[13-16]。废水中酚类化合物的固相萃取方法中,最普遍的是 GDX-502树脂层析柱法[17],该法需要手动填充,且操作较为繁琐。本文建立了商业化Supelclean ENVI-Chrom P小柱固相萃取与高效液相色谱联用的分析方法,测定某造纸厂废水样品中的酚类化合物,操作简单、净化效果好且具有较高的精密度和准确度。
1 实验部分
1.1 仪器与试剂
Agilent1200高效液相色谱仪(配有二极管阵列检测器,美国安捷伦公司);Eclipse XDB-C18(5 μm×4.6 mm×150 mm)色谱柱;Acclaim 120 C18(5 μm ×4.6 mm ×250 mm)色谱柱;VisiprepTMDL 12孔固相萃取装置(配有真空泵和虹吸管,美国);SupelcleanTMENVITMChrom P小柱(3 mL/250 mg,美国);带5 mL准确刻度的玻璃离心管;100 mL玻璃烧杯;精密 pH试纸(pH为0.5~5);0.22 μm滤膜;棕色进样小瓶(2 mL,德国)。
甲醇中11种酚类化合物混合标准溶液,浓度为0.5 mg/mL(美国Accustandard标准品M-604,包括苯酚、对硝基酚、邻氯酚、2,4-二硝基酚、邻硝基酚、2,4-二甲酚、4-氯间甲酚、2,4-二氯酚、4,6-二硝基邻甲酚、2,4,6-三氯酚、五氯酚,保质期到2021年11月4日。);乙酸、丙酮、乙腈、甲醇均为色谱纯(美国Tedia公司);盐酸(分析纯);碳酸氢钠(分析纯,国药集团化学试剂有限公司);实验用纯水均为屈臣氏蒸馏水(经空白试验检验,确认在目标化合物的保留时间区间内没有干扰色谱峰出现或其中的目标化合物浓度低于方法检出限);试剂水:1%(体积)乙酸水溶液。
1.2 样品前处理
小柱活化:将Supelclean ENVI-Chrom P小柱组装于固相萃取装置上,依次用3 mL乙腈、3 mL纯水进行淋洗(1.5 mL/min),最后保持适当的液面防止柱子干裂。
富集淋洗:量取50 mL废水样品于100 mL玻璃烧杯中(可根据样品中目标化合物的浓度适当增加或减少取样量),用6 mol/L盐酸调节pH小于2(保证其分子形态和稳定性),以3 mL/min速度加至活化好的小柱中,然后滴加5 mL、0.05 mol/L的NaHCO3溶液来除去多余的有机酸并将小柱抽干。
洗脱过程:用4 mL乙腈以3 mL/min的流速进行洗脱,下接带5 mL准确刻度的玻璃离心管,洗脱完毕后用乙腈准确定容至5 mL,混匀后过0.22 μm滤膜,待分析测定。
1.3 仪器分析
Eclipse XDB-C18色谱柱梯度洗脱条件:初始乙腈-试剂水(乙腈40%),保持6 min,20 min时升至 90%乙腈、25 min时乙腈-试剂水(乙腈40%),然后运行1 min。Acclaim 120 C18色谱柱梯度洗脱条件:初始乙腈-试剂水(乙腈30%),保持6 min,35 min时升至90%乙腈、40 min时乙腈-试剂水(乙腈30%),然后运行1 min。
流速为1 mL/min,柱温为30℃,进样量为20 μL,DAD 检测波长为270、280、290、305 nm。
1.4 质量控制
采用全程空白、平行分析、加标回收实验对分析过程进行质量控制。全程空白即以纯水为空白样品,与废水样品一起完成全部分析流程,用以考察实验过程的沾污情况;平行分析即制备6份相同的水样,分别完成全部分析流程,用以考察分析方法的精密度;加标回收实验即在样品处理前加入一定量的11种酚混合标准溶液,与本底样品同时完成全部分析流程,测定其回收率,用以考察分析方法的准确度。用该方法的系列标准方程测定相关有证标准样品溶液,所得结果都在误差允许的范围内。
2 结果与讨论
2.1 干扰与消除
废水样品可能存在悬浮物较多的情况,在固相萃取之前需先用玻璃纤维滤膜进行过滤;若水样中含油量较高也会影响分析过程,可预先用正己烷或者环己烷进行液-液萃取去除干扰;对于含有残留氯的水样,需要在分析前加入硫代硫酸钠加以去除。
仪器分析时,当测定高浓度样品后可能会存在记忆效应,可通过分析空白样品,直到空白样品中目标化合物的浓度低于测定下限时,方可分析下一样品。
2.2 固相萃取条件的选择
废水样品基质十分复杂,除了酚类化合物以外,还含有大量在紫外光区有吸收的干扰物质[18],这些物质可能会与酚类化合物出峰时间相同,干扰测定。可根据酚类化合物的特性(如在酸性条件下以中性分子形态存在、疏水性强、在反相柱上有保留等[19]),建立合适的固相萃取方法来实现废水样品中酚类化合物与其他物质的有效分离。
目前针对废水中酚类化合物,最常见的固相萃取填料是GDX-502树脂,它是一种苯乙烯型大孔吸附树脂,既有较大的比表面和适当的孔径结构,又因含有极性基团氰基(-CN)而具有中强极性,有利于通过分子间作用力和较氢键弱的作用力从水中富集弱极性的酚类化合物[20]。然而基于GDX-502树脂所建立的层析柱法需要经过丙酮浸泡、乙腈回流、手动填充等繁琐操作[17],不仅耗时,而且会大量使用有机溶剂。本方法选用的商业化Supelclean ENVI-Chrom P小柱填料是苯乙烯二乙烯基苯聚合物,其比表面较大孔型吸附剂更大,对酚类化合物的吸附能力也更强,更重要的是,商业化小柱避免了填料的预处理和手动填充等操作,大大节省了时间、人力。
样品溶液经Supelclean ENVI-Chrom P小柱富集后,需要用0.05 mol/L NaHCO3溶液去除多余的有机酸以防其影响后续的洗脱过程。此时由于pH升高,大多数酚类化合物的形态会发生改变,进而引起颜色上的变化(无色变为淡黄色),因此用乙腈进行淋洗时,可根据有色物质的移动状态来判断洗脱剂对目标化合物的洗脱进度。实验过程中发现,当乙腈的用量为3 mL时,有色物质可完全被淋洗至玻璃离心管中。测定比较了乙腈用量分别为3、4、5 mL时11种酚类化合物的空白加标回收率,结果差别不大,于是在后期实验中选用4 mL乙腈对目标物化合物进行淋洗。
2.3 液相色谱条件的选择
乙腈与甲醇相比,具有紫外吸收小、产生鬼峰少、产生柱压小等优势,所以选用乙腈和纯水作为流动相对目标化合物进行梯度洗脱。另外,纯水中含有1%的乙酸是为了保持弱酸性,防止酚类化合物成盐。分别用Eclipse XDB-C18色谱柱、Acclaim 120 C18色谱柱对11种酚类化合物进行分析。按照第“1.3”小节所述的梯度洗脱条件,可实现标准混合溶液中酚类化合物的较好分离(图1),且能得到尖锐的色谱峰。
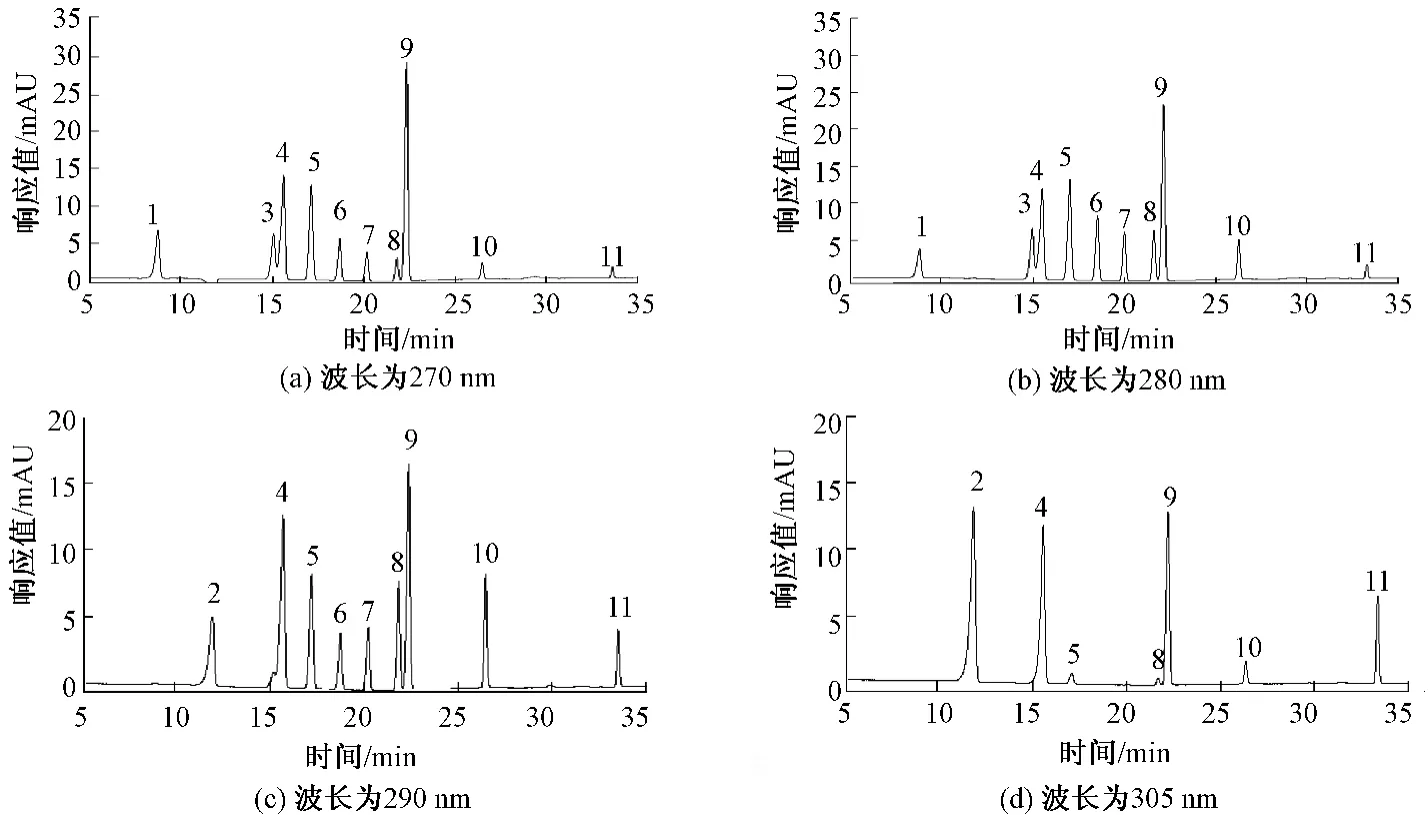
图1 4个波长下的11种酚类化合物混合标准溶液色谱图(Acclaim 120 C18色谱柱)
不同化合物的最大紫外吸收波长不同。二极管阵列检测器(DAD)与普通紫外检测器相比,具有可以同时对样品在不同波长下吸收值进行全扫描的优势。通过DAD扫描和相关文献调研[20-21]确定11种酚类化合物的最大吸收波长如下:苯酚、4,6-二硝基邻甲酚为 270 nm,邻氯酚、2,4-二硝基酚、邻硝基酚、2,4-二甲酚、4-氯间甲酚为280 nm,2,4-二氯酚、2,4,6-三氯酚为 290 nm,对硝基酚、五氯酚为305 nm。
2.4 标准曲线系列及方法检出限
配制系列浓度为 0.2、0.5、1.0、2.0、4.0、5.0、6.0、8.0、10 mg/L 的 11 种酚类化合物混合标准溶液,直接进高效液相色谱检测。以质量浓度为横坐标(x)、峰面积为纵坐标(y)分别绘制了11种酚类化合物的标准曲线,在浓度点较为密集的情况下,大多数化合物的线性回归方程相关系数也都在0.999以上(表1)。
在50 mL空白水样中加入低浓度酚类化合物(加标量均为0.25 μg),按照样品分析步骤平行测定7份,根据3倍标准偏差计算11种酚类化合物的方法检出限,结果见表1。11种酚类化合物的方法检出限为 2×10-3~2×10-2mg/L,低于《污水综合排放标准》(GB 8978—2002)的限值,能够满足检测要求。

表1 11种酚类化合物标准曲线系列和方法检出限
2.5 方法精密度、准确度
制备6份相同的水样(加标量均为25 μg),分别完成全部分析过程,所得结果的相对标准偏差(RSD)为2.7% ~16.4%,表明该方法具有良好的精密度。
11种酚类化合物6次平行分析结果见表2。
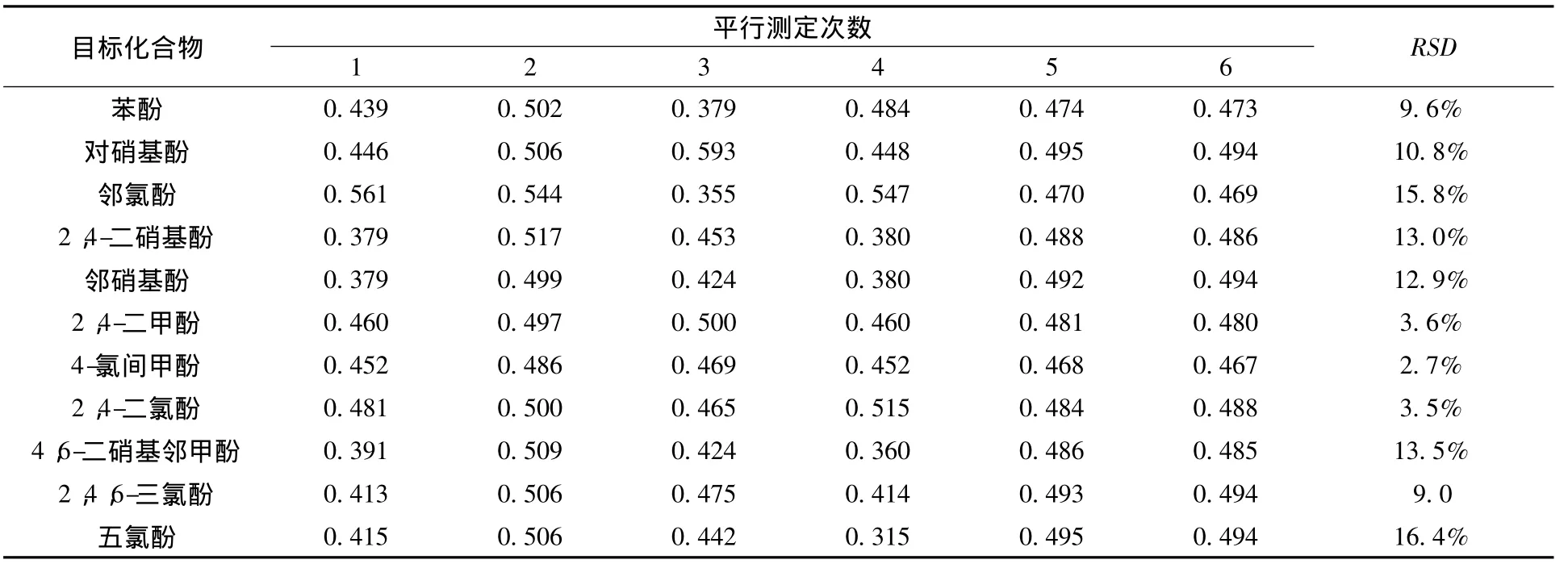
表2 11种酚类化合物6次平行分析结果 mg/L
对水样进行加标回收实验来考察方法的准确度。由表3可知,对空白样品进行3个浓度水平的加标,回收率为92.3% ~113.8%;对两份基质较为复杂的废水样品加标,除2,4-二硝基酚的回收率偏低以外,其他酚类化合物的回收率为61.4% ~115.8%之间。
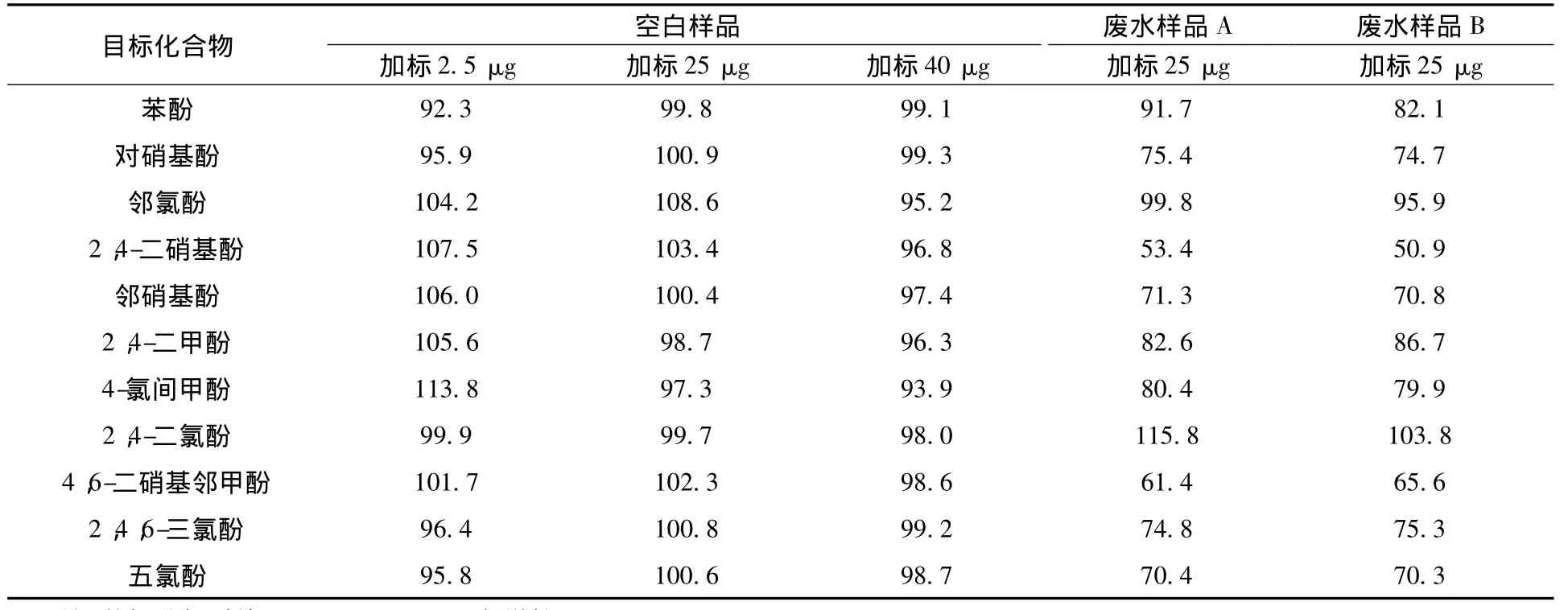
表3 11种酚类化合物的加标回收率结果 %
2.6 实际样品分析
采集某造纸厂的两种废水样品A、B,均为不透明的深色均相样品,用Supelclean ENVI-Chrom P小柱对其进行固相萃取,平行两份,处理后的样品溶液透明度大大提升,且仪器分析时杂质峰较少,可见该方法净化效果优良。两种废水样品均有部分酚类化合物被检出(表4),但是没有超过《污水综合排放标准》(GB 8978—2002)所规定的三级标准限值。与《水和废水监测分析方法》(第四版)所述的GDX-502树脂层析柱法测定结果较为一致。
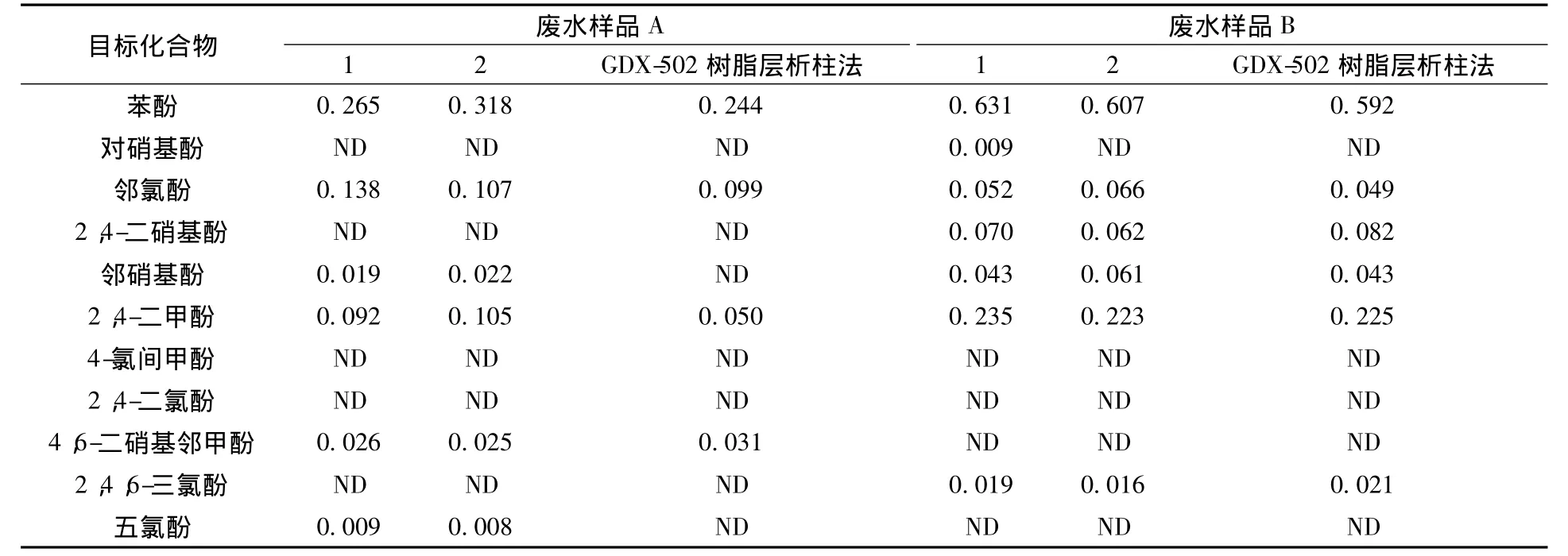
表4 11种酚类化合物的实际样品分析结果 mg/L
3 结论
Supelclean ENVI-Chrom P柱固相萃取-高效液相色谱法通过固相萃取过程对废水样品中的目标化合物进行提取和富集,并通过设定合适的仪器分析条件实现了11种酚类化合物的有效分离,与传统分析方法相比,具有操作简单、耗时短、有机溶剂用量少的优点。采用该方法对废水样品中的11种酚类化合物进行测定,方法检出限为2×10-3~2 ×10-2mg/L,且具有良好的精密度和准确度,能够满足《污水综合排放标准》(GB 8978—2002)的分析要求。
[1]Hansch C, McKarnsSC, SmithC J, etal.Comparative QSAR evidence for a free-radical mechanism of phenol-induced toxicity[J].Chemico Biological Interactions,2000,127:61-72.
[2]MichalowiczJ, Duda W. Phenols—sourcesand toxicity [J].Polish Journal Environmental Studies,2007,16:347-362.
[3]中国环境优先监测研究课题组.环境优先污染物[M].北京:中国环境科学出版社,1989.
[4]Santana C M,Ferrera Z S,Padron M E,et al.Methodologies for the extraction of phenolic compounds from environmental samples:New approaches [J].Molecules,2009,14:298-320.
[5]周文敏,付得黔,孙宗光.水中优先控制污染物黑名单[J].中国环境监测,1990,6(4):1-3.
[6]Bruzzoniti M C,Sarzanini C,Mentasti E,et al.Preconcentration of contaminants in water analysis[J].Journal of Chromatography A,2000,902:289-309.
[7]Liu H,Li J,Liu X,et al.A novel multiwalled carbon nanotubes bonded fused-silica fiber for solid phase microextraction-gas chromatographic analysis of phenols in water samples[J].Talanta,2009,78(3):929-935.
[8]杨丽莉,胡恩宇,母应锋,等.环境水体中痕量酚类化合物气相色谱-质谱联用测定法研究[J].中国环境监测,2007,23(4):40-43.
[9]Hu C,Chen B B,He M,et al.Amino modified multiwalled carbonnanotubes/polydimethylsiloxane coated stir bar sorptive extractioncoupled to high performance liquid chromatography-ultravioletdetection for the determination of phenols in environmental samples[J].Journal of Chromatography A,2013,1 300:165-172.
[10]Cladera A, Miro M, Estela J M, et al.Multicomponent sequential injection analysis determination of nitro-phenols in waters by on-line liquid-liquid extraction and preconcentration [J].Analytica Chimica Acta,2000,421:155-166.
[11]肖小华,尹怡,胡玉玲,等.水中酚类化合物的液-液微萃取/高效液相色谱联用分析研究[J].分析测试学报,2007,26(6):797-801.
[12]李娟,王荟.固相萃取法提取水中酚类化合物的研究[J].环境监测管理与技术,2012,24(6):46-49.
[13]王静,刘铮铮.固相萃取-液相色谱/紫外法测定地表水中百草枯和敌草快[J].中国环境监测,2011,27(4):50-51.
[14]贺小敏,李爱民,杨登,等.固相萃取-高效液相色谱法测定武汉东湖水体中微囊藻毒素[J].中国环境监测,2012,28(1):53-56.
[15]沈斐,苏晓燕,李睿,等.固相萃取-气相色谱法测定水环境中邻苯二甲酸酯[J].中国环境监测,2014,30(1):150-153.
[16]葛璇,刘莉,王明泉,等.固相萃取-液相色谱-串联质谱法测定水中5种雌激素[J].中国环境监测,2014,30(5):73-76.
[17]国家环保局.水和废水监测分析方法[M].4版.北京:中国环境出版社,2002:588-590.
[18]席宏波,周岳溪.气相色谱法测定苯酚生产废水中芳香族化合物[J].中国环境监测,2012,28(4):37-40.
[19]张丽,李楠,万延延.固相萃取-高效液相色谱法测定饮用水中酚类化合物[J].环境监测管理与技术,2010,22(1):49-51.
[20]何森,饶竹,苏劲,等.GDX-502树脂富集高效液相色谱法测定地表水中酚类化合物[J].岩矿测试,2007,26(2):101-104.
[21]张建玲,赵辉,邸尚志.固相萃取-高效液相色谱法测定饮用水中酚类化合物和2,4-滴[J].环境化学,2006,25(2):240-241.
