硫酸溶液中[双(4-甲氧基苯基)]二硫代磷酸二乙铵对碳钢的缓蚀性能研究
2015-04-25赖川
赖 川
(1.四川文理学院化学化工学院,四川 达州 635000;2.材料腐蚀与防护四川省重点实验室,四川 自贡 643000)
引言
金属材料是现代社会中使用最广泛的工程材料,被广泛地应用于各领域,在它们广泛应用的同时其腐蚀问题也严重影响着国民经济各领域的发展[1-2]。众所周知,金属材料腐蚀不仅给人类社会带来巨大经济损失,还会造成灾难性事故,也会浪费宝贵资源和能源、造成环境污染,同时还将阻碍国民经济和高新科技正常发展和威胁国防安全[3-4]。使用缓蚀剂进行防腐蚀是目前最有效和最直接的方法之一,该方法因具有操作工艺简便、高效、成本低廉、适用性强、可不改变金属构件性质和无需特殊附加设备等突出优点所以被广泛应用于金属酸洗防腐[5-6]。
尽管现在所报道的缓蚀剂其种类繁多、数量庞大,但不同类型的缓蚀剂仍各自存在如缓蚀效果差、刺激性气味、热稳定性差、有一定毒性、制备成本高和水溶性差等不同缺点[7-8]。因此,开发新型缓蚀剂有着重大的理论意义和不可估量的现实意义。近年,已报道过不同二取代烃基二硫代磷酸二乙铵作为新型酸洗缓蚀剂,但所报道的缓蚀剂取代基均为苯基、环己基、苯甲基和苯乙基等烃基[9-11],而关于含杂原子的基团作为取代基所得缓蚀剂却至今未见报道。基于此,本文将合成含杂原子(O原子)取代基的[双(4-甲氧基苯基)]二硫代磷酸二乙铵作为新型缓蚀剂,然后通过失重法和电化学法初次评价该化合物在H2SO4溶液中对碳钢的缓蚀性能。
1 试验部分
1.1 试剂与仪器
试剂:五硫化二磷(P2S5)、4-甲氧基苯酚(对甲氧基苯酚,CH3OPhOH)、二乙胺(NHEt2)甲苯(PhCH3)、丙酮(CH3COCH3)、石油醚(90~120℃)、氢氧化钠(NaOH)、浓硫酸(H2SO4,98%),所用试剂均为分析纯且未作进一步处理。
仪器:X-4数字显示显微熔点仪(北京泰克仪器有限公司),Carlo erba 1106元素分析仪(意大利CARLO ERBA公司),Nicolet 6700傅立叶变换红外光谱仪(美国THERMO公司,KBr压片),CHI440A电化学工作站(上海辰华仪器有限公司),SHB-IV双A循环水式多用真空泵(郑州长城科工贸有限公司),HJ-8系列磁力搅拌器(郑州长城科工贸有限公司)。
1.2 缓蚀剂合成
依据文献[8,10-11]报道的合成原理,经多步优化与改进后合成[双(4-甲氧基苯基)]二硫代磷酸二乙铵(DEDP)。具体合成过程:准确称取11.2 g五硫化二磷(约 0.05 mol)和24.8 g 对甲氧基苯酚(约 0.2 mol,4-甲氧基苯酚)后分批加入250 mL三口烧瓶,同时以120 mL甲苯作溶剂。搅拌,加热升温,用恒温水浴锅控制整个反应体系温度不超过80℃,直至整个反应体系中固体原料完全消失至澄清,保持此温度继续反应3 h即可停止,反应过程所产生H2S尾气用浓氢氧化钠溶液吸收。第一步反应结束后,将反应体系自然冷却至室温,然后活性炭脱色,减压抽滤。将抽滤后滤液转移至500 mL烧杯中并再加50 mL甲苯作溶剂,然后在冰水浴条件下搅拌并缓慢滴加11 mL二乙胺(约0.1 mol),立即可见大量白色沉淀生成,静置过夜。将第二步反应所得白色沉淀减压抽滤,用甲苯3次抽洗,然后将固体产物用1:1的丙酮:石油醚(90~120℃)重结晶,最终得白色晶体 DEDP 37.6 g,产率90.6%,熔点164 ~165 ℃。
1.3 试片与电极
实验试片:选择市售Q235钢加工成规格为40.0 mm ×25.0 mm ×2.0 mm 的规则小片作为实验碳钢试片,试片一端开孔。实验前准确测量试片尺寸并计算表面积,然后将分别用 100#、360#、600#、800#、1000#和1200#金相砂纸逐级打磨,使其表面光洁度一致,最后用蒸馏水冲洗,丙酮除油,再用无水乙醇洗后冷风吹干,滤纸包好置于干燥器中备用。每次失重法测试前用电子天平准确称量试片质量。
工作电极:选择市售圆柱状Q235钢,用环氧树脂封装作为碳钢工作电极,其工作面积为0.785 cm2,电化学测试前将其用金相砂纸逐级(360#,600#,800#,1000#,1200#,1500#)打磨,去离子水冲洗,丙酮清洗,吹干待用;参比电极为饱和甘汞电极(SCE);辅助电极为石墨电极。
1.4 缓蚀性能评价
采用电化学法对DEDP的缓蚀剂类型和缓蚀性能进行评价时,选用CHI440A电化学工作站进行测试,动电位极化曲线(Tafel)测试过程中扫描速度设置为0.5 mV·s-1,极化范围选择 E ±250 mV。测试所得DEDP缓蚀率(IE%):

式(1)中,I为空白H2SO4腐蚀溶液中碳钢的腐蚀电流密度,μA·cm-2;I'为添加有DEDP后的H2SO4腐蚀液中碳钢的腐蚀电流密度,μA·cm-2。
用失重法对缓蚀剂DEDP在H2SO4溶液中对碳钢的缓蚀性能和表面吸附规律进行研究,同时考察腐蚀体系温度、H2SO4浓度和缓蚀液存储时间对缓蚀效率的影响。

式(2)和式(3)中,v为碳钢试片的腐蚀速率,mg·cm-2·h-1;w0为失重前碳钢试片的质量,mg;w1为失重后碳钢试片的质量,mg;S为碳钢试片的面积,cm2;t为碳钢试片的腐蚀时间,h;v0为H2SO4空白腐蚀溶液中碳钢试片的腐蚀速率,mg·cm-2·h-1;v1为添加有 DEDP 后的 H2SO4腐蚀溶液中碳钢试片的腐蚀速率,mg·cm-2·h-1。
2 试验结果与讨论
2.1 缓蚀剂表征
DEDP(C18H26NO4PS2,MDEDP=415)元素分析:Calcd.(%)C 52.05,H 6.27,N 3.37;Found(%)C 52.02,H 6.30,N 3.38。从元素分析结果可知,DEDP 分子中C、H和N三元素的理论计算值含量(Calcd.)与实验值(Found)相差较小。此结果说明所合成的缓蚀剂与DEDP具有基本相同的化学组份。
DEDP红外吸收光谱分析(KBr压片)如图1所示。图1中3436.4 cm-1处中强峰为N-H伸缩振动吸收峰,相应1590.8 cm-1处弱吸收峰归属于N-H弯曲振动弱吸收峰,1606.7 cm-1和 1503.4 cm-1处吸收峰归属于苯环的骨架振动,而834.2 cm-1处出现的吸收峰为对位取代苯环的特征吸收峰,2977.7 cm-1处出现的吸收峰为-CH3不对称伸缩振动,2834.4 cm-1为-CH3对称伸缩振动吸收峰,1464.9 cm-1归属于-CH2-的变形振动和-CH3的反对称变形振动,1389.0 cm-1归属于-CH3的对称变形振动,1210.2 cm-1和 1191.7 cm-1处强吸收双峰归属于与N原子相连的两个-CH2-在振动偶合效应下裂分所形成的双峰;724.0 cm-1和888.9 cm-1处分别为P-(O)2对称和不对称伸缩振动特征吸收峰;563.7 cm-1处出现的吸收峰为P-S键伸缩振动吸收峰。红外光谱测试结果解析显示所得缓蚀剂与理论上DEDP分子结构中各基团的吸收吻合。由红外光谱和元素分析结果共同推断所合成的缓蚀剂即为目标缓蚀剂DEDP。
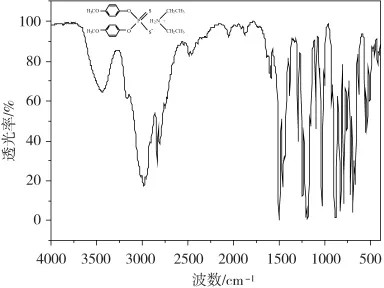
图1 缓蚀剂DEDP的红外吸收光谱图
2.2 缓蚀剂浓度对缓蚀性影响
2.2.1 电化学法
300 K条件下1.0 M H2SO4溶液中DEDP浓度不同时,采用电化学法研究其缓蚀性所得的电化学参数和缓蚀率见表1,动电位极化曲线如图2所示。由表1可知,300 K条件下,与 1.0 M H2SO4空白溶液(未添加DEDP)相比,碳钢电极在添加有DEDP的1.0 M H2SO4溶液中发生腐蚀反应腐蚀电流密度(Icorr)显著减小。同时基于式(1)计算所得缓蚀率随DEDP浓度升高而增大,这是由于DEDP分子在碳钢表面吸附成膜阻碍H2SO4溶液中H+进攻Fe,而对碳钢与酸的腐蚀反应起到有效抑制作用。300 K条件下1.0 M H2SO4溶液中DEDP浓度为160 mg·L-1时缓蚀率高达96.29%,这说明DEDP是一种缓蚀性能优异的新型酸洗缓蚀剂。

表1 不同浓度缓蚀剂时相应电化学参数和缓蚀率
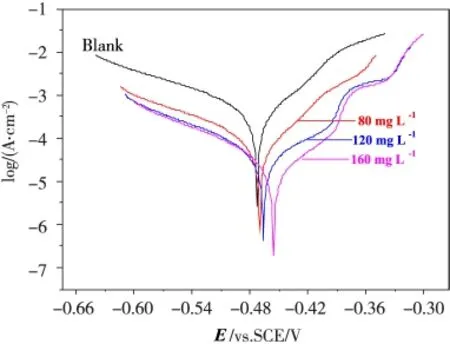
图2 不同浓度缓蚀剂时碳钢的极化曲线
另外,由表1可知随DEDP在H2SO4溶液中浓度增加相应腐蚀电位(Ecorr)呈正移趋势(图2),说明碳钢在添加有缓蚀剂的H2SO4溶液中发生腐蚀反应其腐蚀趋势较空白H2SO4溶液中减弱,同时也表明所合成的缓蚀剂DEDP在H2SO4溶液中为抑制阳极反应为主的混合型缓蚀剂[2,6,12]。
2.2.2 失重法
300 K条件下1.0 M H2SO4溶液中DEDP浓度不同时失重法研究腐蚀速率,结果如图3所示。由图3可知,碳钢在1.0 M H2SO4溶液中发生腐蚀反应腐蚀速率随DEDP浓度增加逐渐降低,相应缓蚀率相应升高。300 K条件下1.0 M H2SO4溶液中DEDP浓度160 mg·L-1时,腐蚀速率和缓蚀率分别为 0.1116 mg·cm-2·h-1和94.27%。此结论印证了电化学测试结果,同时更进一步确证了DEDP对碳钢在H2SO4溶液中的腐蚀行为表现为较强抑制作用和优良的缓蚀性能。
同时,为了研究缓蚀剂DEDP在碳钢表面的吸附行为,分别以 Langmuir、Temkin、Freundlich吸附等温式对失重法所得实验数据(图3)进行拟合,其中Langmuir吸附等温式:

式(4)中,C为缓蚀剂DEDP浓度,mg·L-1;θ为表面覆盖率(数值上与缓蚀率近似相等);K为以质量浓度表示的吸附与脱附之间平衡常数,(mg·L-1)-1。
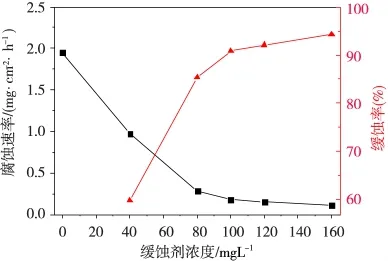
图3 不同浓度缓蚀剂时碳钢腐蚀速率与相应缓蚀率
依据Langmuir吸附等温式,用C/θ-C作图并进行线性拟合,拟合结果如图4所示。由图4可知,C/θ-C表现出良好线性关系(R=99488),说明该缓蚀剂在碳钢表面的吸附符合 Langmuir等温式模型[1,9,11]。
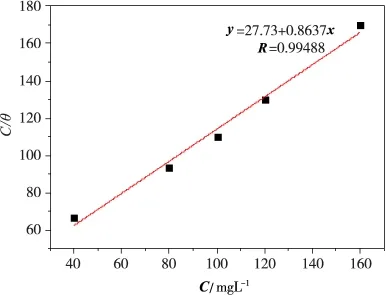
图4 缓蚀剂的C/θ与C关系图

式中,R 为气体常数,8.314 J·(K·mol)-1;T热力学温度,K;K'为以摩尔浓度表示的吸附与脱附之间平衡常数,(mol·L-1)-1。
基于式(4)和式(5)并结合图4拟合结果可知,K'=MDEDP×K ×103=415/27.73 ×103=1.497 ×104(mol·L-1)-1。通常情况下Δ为 -20 kJ·mol-1时,其吸附为带电荷的分子和带电荷的金属之间的静电作用,通常归属于物理吸附;而当Δ为-40 kJ·mol-1或者更负时,吸附为带电荷的分子通过与金属共用电子成键,即化学吸附。将计算所得K'值代入式(5)得到 Δ=34.00 kJ·mol-1,即-40 kJ·mol-1< Δ< -20 kJ·mol-1,此结果表明DEDP在碳钢表面上的吸附属于自发进行的物理和化学吸附[1,3,7,13-14]。
2.3 腐蚀体系温度对缓蚀性影响
1.0 M H2SO4溶液中 DEDP 浓度为 160 mg·L-1时,失重法研究腐蚀体系温度与缓蚀率关系,结果如图5所示。由图5可知,腐蚀体系温度对缓蚀率影响非常大,随腐蚀体系温度升高,DEDP对碳钢的缓蚀率明显降低,温度从300 K上升至343 K,缓蚀率将从94.27%下降至50.07%。这说明DEDP并不适合在较高温度下使用,较高温度下DEDP对碳钢缓蚀效果明显减弱是由于温度升高将导致H2SO4对碳钢腐蚀加剧,同时缓蚀剂DEDP在碳钢表面吸附作用减弱而脱附作用明显。
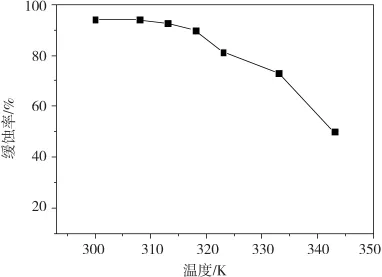
图5 腐蚀体系温度与缓蚀率关系
2.4 硫酸浓度对缓蚀性影响
300 K条件下缓蚀剂浓度为160 mg·L-1时,失重法研究H2SO4浓度与缓蚀率关系,结果如图6所示。由图6可知,缓蚀率随H2SO4浓度增大而降低,当H2SO4浓度为0.5 M、1.0 M 和2.0 M 时,缓蚀率分别为96.45%、94.27%和92.78%。由此可知,缓蚀率随H2SO4浓度增大而降低,这主要是由于随酸浓度增加溶液中H+浓度增大,从而加剧与Fe原子反应,并伴随大量H2气泡产生,这些气泡也将直接阻碍DEDP分子在碳钢表面吸附成膜,从而导致缓蚀效果有所减弱。
2.5 缓蚀剂时效应
图7为失重法研究300 K条件下1.0 M H2SO4溶液中DEDP浓度为160 mg·L-1时缓蚀剂的时效应关系图。由图7可知,随时间推移,H2SO4溶液中DEDP对碳钢的缓蚀效果呈现减弱趋势,即随存储时间延长,缓蚀剂有逐渐失效的趋势。120 h后,DEDP对碳钢的缓蚀率仍高达91.32%,说明该缓蚀剂在较长时间范围内同样具有较好缓蚀性能。
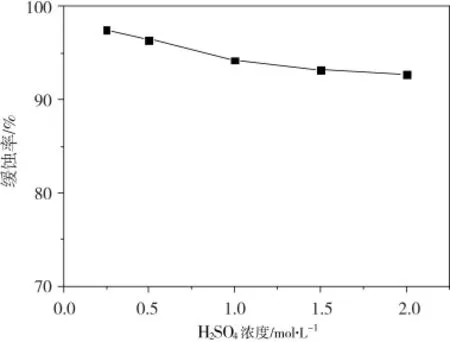
图6 H2SO4浓度与缓蚀率关系

图7 缓蚀剂的时效应关系图
3 结论
(1)[双(4-甲氧基苯基)]二硫代磷酸二乙铵在H2SO4溶液中对碳钢表现出优异的缓蚀性能,其缓蚀率随缓蚀剂浓度增加而升高,随腐蚀体系温度升高、H2SO4浓度增大和缓蚀液存储时间延长而分别呈下降趋势。
(2)[双(4-甲氧基苯基)]二硫代磷酸二乙铵在H2SO4溶液中于碳钢表的吸附符合Langmuir吸附等温式,属自发进行的物理和化学吸附。
(3)[双(4-甲氧基苯基)]二硫代磷酸二乙铵在H2SO4溶液中表现为一种抑制阳极反应为主的混合型缓蚀剂。
[1] Mourya P,Singh P,Tewari A K,et al.Relationship between structure and inhibition behavior of quinolinium salts for mild steel corrosion:Experimental and theoretical approach[J].Corros.Sci.,2015,95:71-87.
[2] Chauhan L R,Gunasekauran G.Corrosion inhibition of mild steel by plant extract in dilute HCl medium[J].Corros.Sci.,2007,49:1143-1161.
[3] Zheng X.W,Zhang S T,Li W P,et al.Investigation of 1-butyl-3-methyl-1H-benzimida-zolium iodide as inhibitor for mild steel in sulfuric acid solution[J].Corros.Sci.,2014,80:383-392.
[4] Shymala M,Kasthuri P K.The inhibitory action of the extracts of adathoda vasica,eclipta alba,and centella asiatica on the corrosion of mild steel in hydrochloric acid medium:A comparative study[J].Int.J.Corros.,2012(10):1-13.
[5] Daoud D,Douadi T,Issaadi S,et al.Adsorption and corrosion inhibition of new synthesized thiophene Schiff base on mild steel X52 in HCl and H2SO4solutions[J].Corros.Sci.,2014,79:50-58.
[6] Mallaiya K,Subramaniam R,Srikandan S S,et al.Electrochemical characterization of the protective film formed by the unsymmetrical Schiff's base on the mild steel surface in acid media[J].Electrochim.Acta,2011,56:3857-3863.
[7] Ansari K R,Quraishi M A,Singh A.Isatin derivatives as a non-toxic corrosion inhibitor for mild steel in 20%H2SO4[J].Corros.Sci.,2015,95:62-70.
[8] 谢斌,赖川,邹立科,等.一种新型酸洗缓蚀剂及其在制备金属酸洗剂中的应用:201010166782.8,2010[P].2014-04-25.
[9] 谢斌,赖川,邹立科,等.O,O'-二(苯基)二硫代磷酸-N,N-二乙铵的合成及缓蚀性能评价[J].材料保护,2011,44(12):63-66.
[10] 谢斌,赖川,邹立科,等.硫酸介质中EDBDP对Q235钢的缓蚀性能研究[J].腐蚀与防护,2011,32(3):166-169.
[11] 谢斌,赖川,邹立科,等.O,O'-二(环己基)二硫代磷酸-N,N-二乙铵对Q235钢在硫酸溶液中的缓蚀性能研究[J].中国腐蚀与防护学报,2011,31(3):225-230.
[12] Solmaz R.Investigation of corrosion inhibition mecha-nism and stability of Vitamin B1 on mild steel in 0.5 M HCl solution[J].Corros.Sci.,2014,81:75-84.
[13] Shivakumar S S,Mohana K N.Ziziphusmauritiana leaves extracts as corrosion inhibitor for mild steel in H2SO4and HCl solutions[J].Eur.J.Chem.,2012(3):426-432.
[14] Hegazy M A,Abdallah M,Awad M K,et al.Three novel di-quaternary ammonium salts as corrosion inhibitors for API X65 steel pipeline in acidic solution,Part I:Experimental results[J].Corros.Sci.,2014,81:54-64.
