高产褐藻胶裂解酶菌株的筛选及发酵条件优化
2015-04-24连燕萍王培松吴晨烁陈宁辛
严 芬,连燕萍,杨 光,王培松,吴晨烁,陈宁辛
(福州大学生物科学与工程学院,福建福州350116)
高产褐藻胶裂解酶菌株的筛选及发酵条件优化
严 芬,连燕萍,杨 光,王培松,吴晨烁,陈宁辛
(福州大学生物科学与工程学院,福建福州350116)
采用透明圈初筛方法得到一株产褐藻胶裂解酶菌株B1,通过形态观察和16S rDNA序列分析鉴定该菌株为假交替单胞菌属(Pseudoalteromonas sp.)。通过单因素实验对菌株B1产酶条件进行优化,最佳培养基组成为:褐藻酸钠1%,氯化铵0.2%,NaCl 3%,KH2PO40.02%,MgSO40.01%,CaCl2·2H2O 0.1%,初始pH5.5。最佳的培养条件:装液量75 mL,培养温度30℃,摇床转速180 r/min,培养22 h。在该条件下,褐藻胶裂解酶最高酶活力提高到71.94 U/mL,提高了72.11%。
褐藻胶裂解酶,假交替单胞菌,筛选,鉴定,培养条件
褐藻胶是来源于褐藻植物细胞壁的水溶性酸性多糖,具有良好的增稠乳化稳定功能,其降解产物褐藻胶低聚糖具有特殊的化学特性和生物活性,在保健食品、新药开发等方面也具有巨大的应用价值,例如促进双岐杆菌的生长、预防龋齿、作为藻酸双脂和海立特等海洋药物的原料基础等[1-2]。目前褐藻胶的降解方法主要有酸降解、碱降解、酶法降解等[3],其中酶法降解由于具有催化效率高、专一性强等优势代替化学降解已经成为一种必然。褐藻胶裂解酶作为一种降解褐藻胶的酶,利用β-消除反应切开褐藻胶分子中C4,C5之间的β-1,4-糖苷键,使其产生双键并形成不饱和糖醛酸[4]。根据其对底物聚甘露糖醛酸(PM)和聚古洛糖酸酸(PG)的作用情况不同,褐藻胶裂解酶可分为三类:专一性裂解M片段的裂解酶、专一性裂解G片段的裂解酶和对两种底物都能裂解的双功能裂解酶[5]。因此对褐藻胶裂解酶的研究对于推动褐藻低聚糖的进一步开发有着深远的意义和应用前景。褐藻胶裂解酶自身也具有重要的药用价值,对绿脓杆菌的生物膜具有降解作用,是治疗由绿脓杆菌感染引起的囊性纤维化病的辅疗药物[6-7]。
褐藻胶裂解酶具有广泛的来源,如海藻类、海洋软体动物、棘皮动物、海洋细菌、陆生真菌以及土壤细菌等[7],微生物来源主要有假交替单胞菌(Pseudoalteromonas)[8]、弧菌(Vibrio)[9]、黄杆菌(Flavobacterium)[10]、芽胞杆菌(Bacillus)[11]、链霉菌(Streptomyces)[12]。但大部分产褐藻胶裂解酶的微生物生长条件较特殊,酶活力低,稳定性差,不易分离[13],本文从鲍鱼内脏筛选得到一株高产褐藻胶裂解酶的假交替单胞菌B1,该菌株具有较好的pH稳定性,鉴于发酵条件对微生物产酶能力的影响,对菌株B1产酶条件进行研究,以期提高其酶活力,为褐藻胶裂解酶工业化生产和应用奠定一定的基础。
1 材料与方法
1.1 材料与仪器
海带及鲍鱼内脏 宁德海域;细菌基因组DNA提取试剂盒 北京百泰克生物技术有限公司;PCR引物 上海生工生物工程技术服务有限公司;褐藻酸钠等药品 西陇化工股份有限公司。
HWS24型电热恒温水浴锅 上海一恒科技有限公司;752N型分光光度计 上海精密科学仪器有限公司;CF16RXⅡ型高速冷冻离心机 日本HITACHI公司;ECLIPSE E100型三目显微镜 日本尼康株式会社。
1.2 培养基
筛选培养基:褐藻酸钠10.0 g,蛋白胨2.0 g,人工海水1.0 L。pH7.0,121℃蒸汽灭菌30 min。
种子培养液:蛋白胨5.0 g,酵母膏1.0 g,磷酸铁0.01 g,人工海水 1.0 L。pH7.2,121℃蒸汽灭菌30 min。
发酵培养液:褐藻酸钠5.0 g,蛋白胨2.0 g,KH2PO41.0 g,人工海水1.0 L。pH7.5,121℃蒸汽灭菌30 min。
1.3 实验方法
1.3.1 产酶菌株的筛选 将腐烂海带、鲍鱼内脏取出均质后稀释涂布到筛选培养基进行分离初筛,28℃、培养3~4 d,筛选出有降解圈或者凹陷明显的菌落,进一步分离纯化,斜面保藏。将斜面培养基活化的菌体接种到种子液中,置于28℃、180 r/min摇瓶培养12 h,以3%(v/v)的接种量接种于50 mL发酵液中,置于28℃、180 r/min条件下摇瓶培养,每12 h取样,于10000 r/min,离心5 min,取上清液,测定褐藻胶裂解酶的酶活力。
1.3.2 酶活力测定 采用DNS法测定酶活力[14],取发酵液上清与0.75%(w/v)褐藻酸钠底物反应,以灭活的酶液与褐藻酸钠底物混合液作为对照组,根据产生还原糖的情况判断酶活力大小。酶活力单位定义为在40℃条件下,每分钟催化底物产生1 μg还原糖(以葡萄糖计)所需的酶量为一个酶活力单位(U/mL)。
1.3.3 菌株鉴定
1.3.3.1 菌株形态鉴定 根据《常见细菌系统鉴定手册》[15]对分离筛选到的菌株B1进行菌落特征和形态特征的鉴定。
1.3.3.2 16S rDNA鉴定 采用试剂盒提取细菌总DNA,利用细菌16S rDNA扩增通用引物27f和1492r进行PCR扩增。PCR反应体系(20 μL):2×Taq PCR mastermix 10 μL、DNA 1 μL、上下游引物各1 μL及ddH2O 7 μL。PCR反应条件为:94℃预变性5 min,94℃变性30 s,57℃退火30 s,72℃延伸90 s,30个循环后72℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳,割胶回收,并用DNA胶回收试剂盒回收DNA片段,获得的片段委托到上海英潍捷基公司测序。测序结果提交到GenBank并在NCBI数据库中进行序列同源性分析,使用ClustalX软件与从GenBank数据库中获得的16S rDNA序列进行多序列比较,Mega5.0[16]软件构建16S rDNA系统发育树,经过自举分析Bootstrap检测置信度,重复1000次,确定该菌的分类地位。
1.3.4 产酶条件研究 通过单因素实验优化培养基碳源、氮源、培养基初始pH、培养温度、装液量、摇床转速、NaCl浓度以及无机盐种类。每个实验做三个平行,重复三次。
1.3.4.1 碳源及其添加量的研究 分别以0.5%(w/v)的蔗糖、淀粉、甘油、褐藻酸钠、甘露糖作为碳源,并加入0.2%(w/v)蛋白胨,0.1%(w/v)KH2PO4配制发酵培养基,pH7.5,以3%(v/v)的接种量接种于50 mL发酵液中,置于28℃、180 r/min条件下摇瓶培养,研究不同碳源对菌株产酶的影响。在确定最佳碳源后,改变其浓度,在相同条件下研究碳源浓度对产酶的影响。
1.3.4.2 氮源及其添加量的研究 在最佳碳源的基础上,分别添加0.5%(w/v)酵母膏、蛋白胨、硫酸铵、氯化铵与牛肉膏作为氮源,并加入0.1%(w/v)KH2PO4配制发酵培养基,其他条件与1.3.4.1相同,研究不同氮源对菌株产酶的影响。在确定最佳氮源后,改变其浓度,在相同条件下研究氮源浓度对产酶的影响。
1.3.4.3 NaCl浓度的研究 确定最佳碳源及氮源基础上,添加1%、2%、3%、4%、5%(w/v)的NaCl,并加入0.1%(w/v)KH2PO4配制培养基,其他条件与1.3.4.1相同,研究NaCl浓度对产酶的影响。
1.3.4.4 无机盐种类的研究 在最佳碳源、氮源及NaCl基础上,添加KH2PO4、MgSO4、FeSO4·7H2O、CaCl2·2H2O,其他条件与1.3.4.1相同,考察无机盐对菌株B1产酶的影响。
1.3.4.5 培养基初始pH的研究 培养基成分及其他培养条件不变,改变培养基初始pH为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5,研究培养基初始pH对菌株B1产酶的影响。
1.3.4.6 装液量的研究 培养基成分及其他培养条件不变,在250 mL三角瓶中分别加入25、50、75、100、125 mL的发酵培养基,研究装液量对菌株B1产酶的影响。
1.3.4.7 摇床转速的研究 培养基成分及其他培养条件不变,只改变转速为120、140、160、180、200 r/min对菌株B1进行发酵培养,研究转速对菌株B1产酶的影响。
1.3.4.8 发酵温度的研究 培养基成分及其他培养条件不变,分别在25、28、30、33、35℃条件下发酵培养菌株B1,确定其最适发酵温度。
1.3.5 数据处理 采用SPSS.20统计软件对实验数据进行统计分析,并检验各因素的差异显著性。
2 结果与讨论
2.1 产酶菌株的筛选
经过筛选培养基初筛获得9株在初筛培养基上出现凹陷或透明圈现象的菌株,分别命名为B1~B9。经过发酵培养后测定其酶活力如图1所示,结果表明菌株B1相对其他菌株具有较高的酶活力,培养28 h后酶活力达到41.8 U/mL,最终以B1为实验菌株做后续实验。
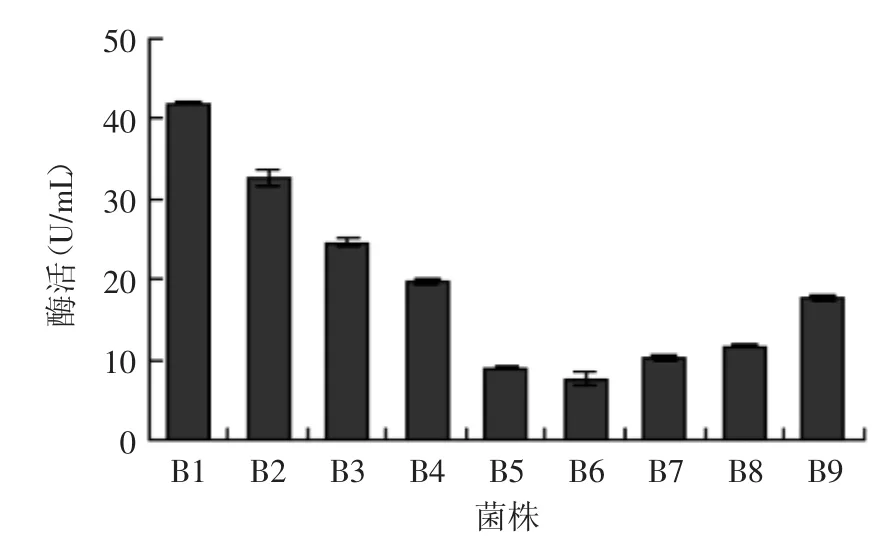
图1 不同菌株的酶活力Fig.1 Alginate lyase activities of different strains
2.2 菌株B1的鉴定
2.2.1 形态鉴定 菌株B1菌落形态以及细胞形态特征如图2所示。由图2(a)可知,菌株B1单菌落较为湿润,呈圆形,中间凸起,表面光滑,乳白色,不透明,边缘光滑,易挑取;由图2(b)可知,菌体细胞呈短棒杆状,未发现芽孢存在。

图2 菌株B1的菌落及细胞形态观察(1000×)Fig.2 Colony and cellular morphology of strain B1(1000×)
2.2.2 16S rDNA序列分析 利用16S rDNA通用引物对菌株B1菌株扩增,得到1499 bp的目的片段。将获得序列提交至GeneBank(登录号:KM277582)并在NCBI网站上利用BLAST程序进行序列同源性比对,结果显示菌株B1与假交替单胞菌(Pseudoalteromonas sp.QY202等)同源性高达99%。构建系统进化树如图3所示,菌株B1与假交替单胞菌属在亲缘关系上最接近,结合菌株形态学特征,鉴定菌株B1为假交替单胞菌(Pseudoalteromonas sp.)。

图3 基于16S rDNA构建菌株B1的系统进化树Fig.3 Phylogenetic tree of strain B1 based on 16S rDNA
2.3 培养基优化
2.3.1 碳源种类及其添加量对菌株产酶的影响 由图4可知,以褐藻酸钠为碳源时,菌株的产酶效果最好,而以甘露聚糖、蔗糖、淀粉为碳源时,菌株产酶量极低,故确定褐藻酸钠为最佳碳源。改变发酵培养基中褐藻酸钠的浓度对菌株进行发酵,结果如图5所示。褐藻酸钠浓度在0.2%~0.6%时,菌株B1产酶能力缓慢增长;当大于0.6%后呈快速增长趋势,并在浓度为1.0%时达到最大,而后呈下降趋势。这主要是由于高浓度的褐藻酸钠增加了培养基的粘度影响溶氧,不利于菌株产酶。因此选择浓度1.0%的褐藻酸钠作为菌株B1的最佳碳源浓度。
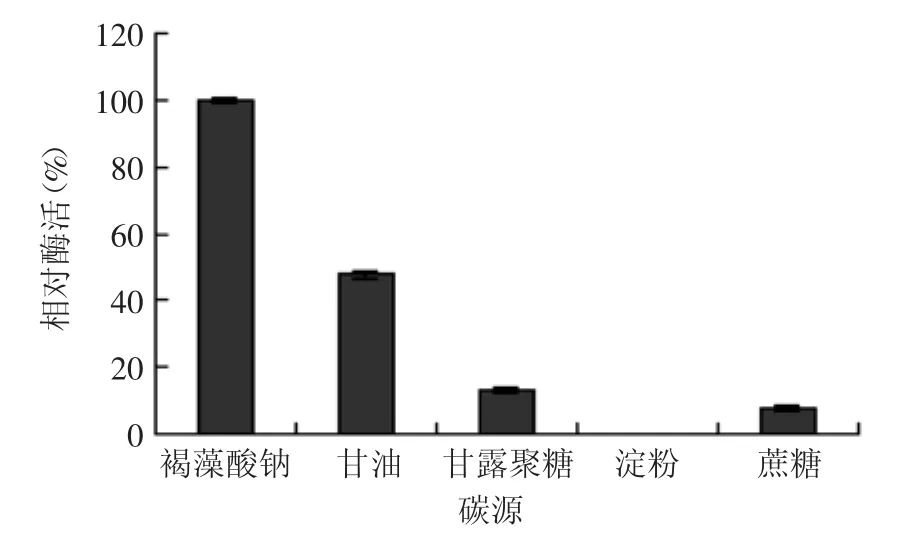
图4 不同碳源对菌株B1产酶的影响Fig.4 Effect of different carbon sources on enzyme production by strains B1
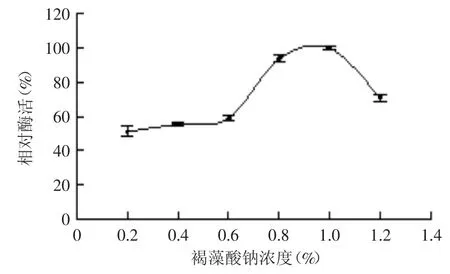
图5 褐藻酸钠浓度对菌株B1产酶的影响Fig.5 Effect of the concemtration of alginate on enzyme production by strain B1
2.3.2 氮源种类及其添加量对菌株产酶的影响 由图6可知,菌株B1可以利用多种氮源进行自身的生长及产酶,但利用程度不同。其中以氯化铵为氮源时,菌株的产酶效果最佳。文献报道,大西洋假交替单胞菌(Pseudoalteromonas atlantica)AR06产酶的最适氮源为硝酸氨[17],而中华黄海杆菌(Gilvimarinus chinensis)QM42产酶的最适氮源为蛋白胨[18],这说明不同菌属产酶所利用的最佳氮源种类差别较大。进一步考察不同浓度的氯化铵对菌株产酶的影响,结果如图7所示。氯化铵浓度为0.2%时,菌株B1产酶效果最佳,因此确定氯化铵的最适浓度为0.2%。
2.3.3 NaCl浓度对菌株产酶的影响 海洋来源的褐藻胶裂解酶产生菌株,需要一定的盐度才能生长代谢和产酶。NaCl浓度对菌株产酶能力的影响结果如图8所示。NaCl浓度小于3%时,菌株产酶能力随着浓度增加而增加;当NaCl浓度为3%时,菌株产酶能力最大;当大于3%时,菌株产酶逐渐趋于平稳,故选取浓度为3%的NaCl作为最佳的盐浓度。HU等报道的Vibrio sp.510-64产酶的最适盐度也是3%[19]。

图6 不同氮源对菌株B1产酶的影响Fig.6 Effect of different nitrogen sources on enzyme production by strain B1
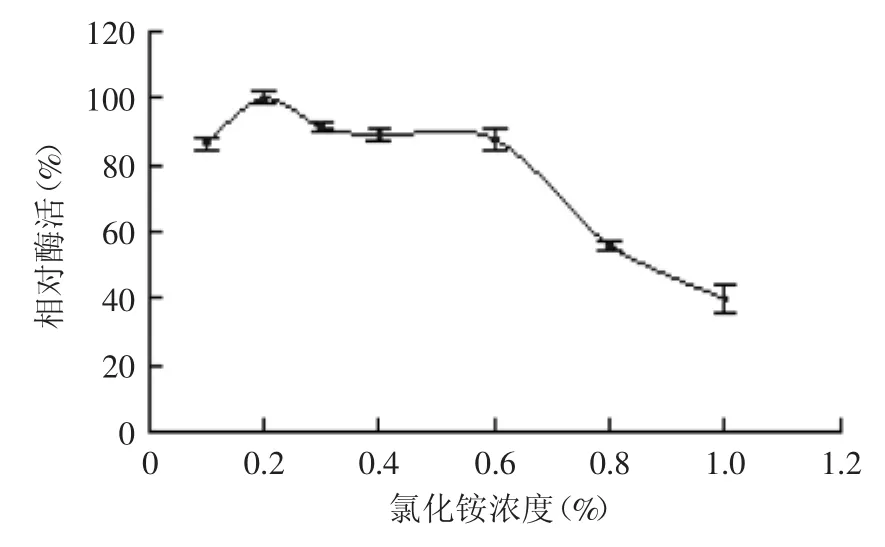
图7 氯化铵浓度对菌株B1产酶的影响Fig.7 Effect of ammonium concentration on enzyme production by strain B1
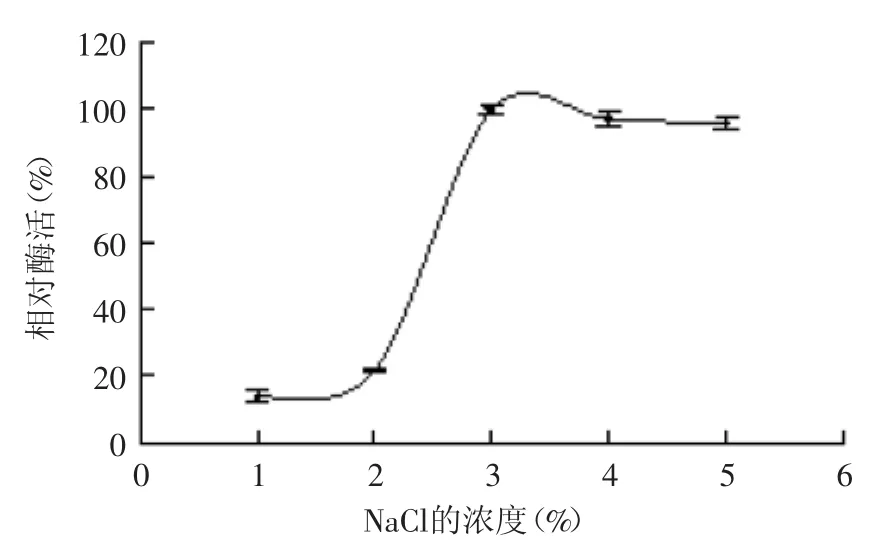
图8 NaCl浓度对菌株B1产酶的影响Fig.8 Effect of NaCl concentration on enzyme production by strain B1
2.3.4 无机盐对菌株产酶的影响 无机盐对菌株B1产酶的影响结果见表1。单一无机盐KH2PO4对菌株产酶的促进作用最为明显,MgSO4和CaCl2·2H2O(0.1%)对菌株产酶也起到了促进作用。进一步对有促进作用的无机盐进行组合,结果显示添加KH2PO4(0.02%)+MgSO4(0.01%)+CaCl2·2H2O(0.1%)的无机盐组合时,菌株产酶能力最大。Ca2+对Pseudoalteromonas LJ1菌株产酶起着一定的促进作用[9],而对Acinetobacter X8产酶则起着抑制作用[8],表明无机盐对不同菌属的产酶能力影响不同。
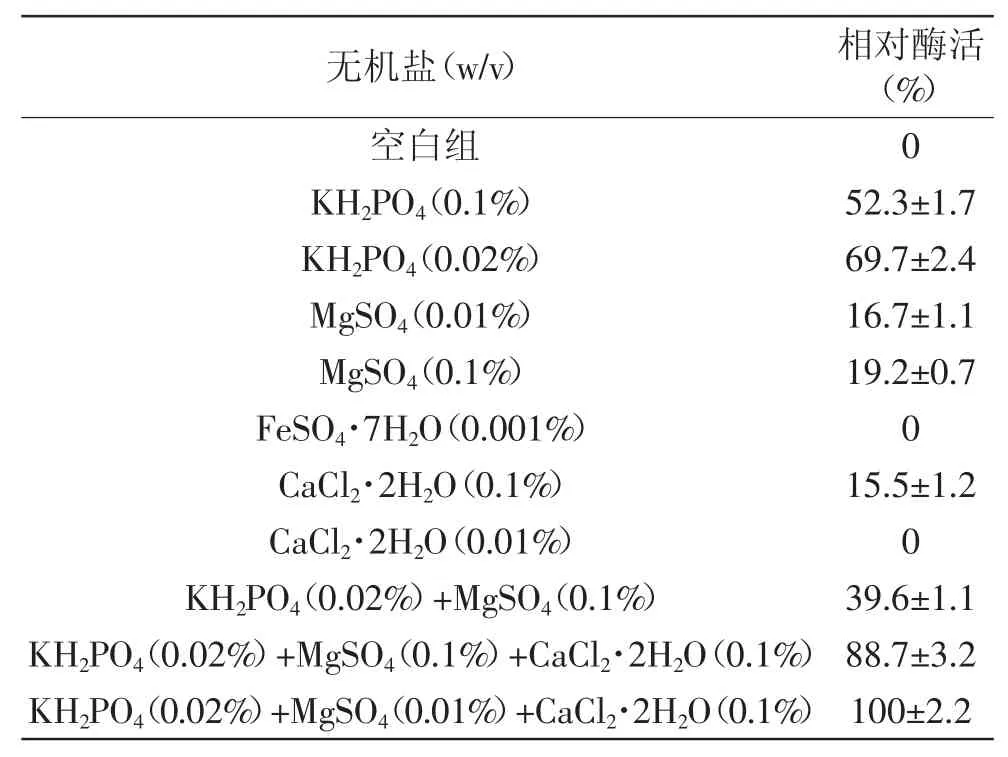
表1 无机盐对菌株B1产褐藻胶裂解酶的影响Table 1 Effect of inorganic salts on alginate lyase activity by strain B1
2.4 发酵条件的优化
2.4.1 培养基初始pH对菌株产酶的影响 培养基的初始pH会影响菌株细胞膜的通透性从而影响其对营养物质的吸收,因此初始pH对菌株的生长及产酶有一定的影响。本文研究培养基初始pH对菌株B1产酶的影响,结果如图9所示。在pH5~5.5范围内,褐藻胶裂解酶酶活力随着pH的上升而增大;当pH达到5.5时,酶活力达到最大;在pH5.5~7.5范围内,酶活力呈缓慢下降趋势;当pH超过7.5后,酶活力迅速下降。由此表明,微酸环境有利菌株B1产酶,这与Vibrio sp. QY103[20]产酶的最适初始pH相同,但大多数菌株产酶最适初始pH都在中性偏碱性环境即pH6~8[13,21-22]之间。
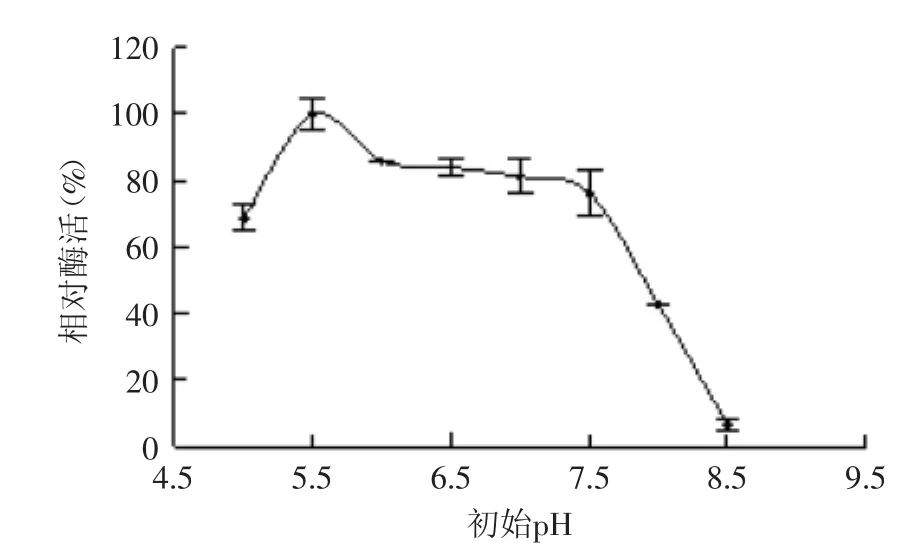
图9 培养基初始pH对菌株B1产酶的影响Fig.9 Effect of initial pH of the medium on enzyme production by strain B1
2.4.2 装液量对菌株产酶的影响 装液量对菌株B1产酶的影响结果如图10所示。装液量从25~75 mL时,褐藻胶裂解酶酶活力随之缓慢上升;装液量为75 mL时,酶活力最高;当装液量继续增加后,酶活力快速下降。这主要是由于过低的装液量在摇瓶过程中水分蒸发过快不利于菌株产酶,而装液量过大易导致溶氧降低也不利于菌株的生长及产酶,因此装液量选取75 mL为最适装液量。
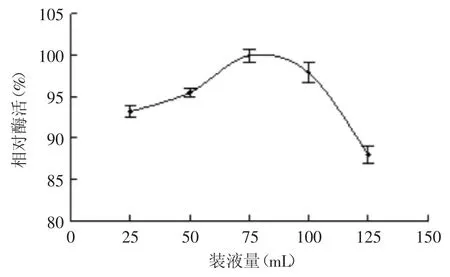
图10 装液量对菌株B1产酶的影响Fig.10 Effect of medium volume on enzyme production by strain B1
2.4.3 摇床转速对菌株产酶的影响 转速对菌株B1产酶影响结果如图11所示。当转速在120~180 r/min之间,B1菌株产酶能力随着转速增大而上升,并在180 r/min时达到最大;当转速超过180 r/min后,菌株产酶能力迅速下降。这主要是由于转速过低会影响菌株的呼吸从而造成代谢异常,而转速过高则会加大摇瓶内的剪切力,造成细胞损伤而使菌体提前自溶,因此选取180 r/min为最适转速。
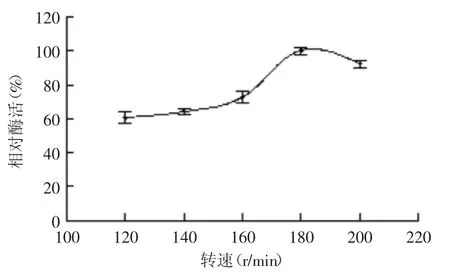
图11 转速对菌株B1产酶的影响Fig.11 Effect of rotating rate on enzyme production by strain B1
2.4.4 发酵温度对菌株产酶的影响 菌株的生长代谢与温度密切相关,实验结果(图12)表明,当温度在25~30℃时,酶活力呈迅速增长趋势;当温度为30℃时,酶活力到达最高值;当温度超过30℃时,酶活力迅速下降。因此选取30℃为最适发酵温度,这与已报道的海洋细菌的生长温度范围(25~30℃)相符合。
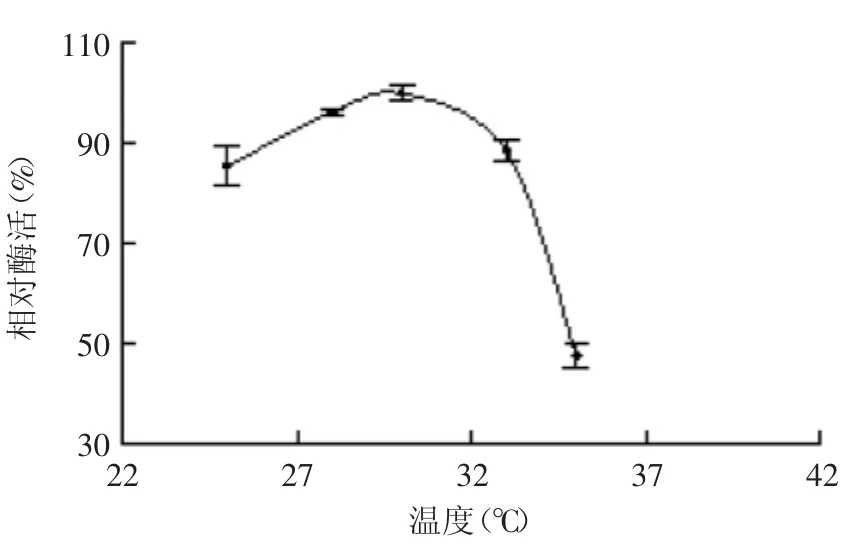
图12 温度对菌株B1产酶的影响Fig.12 Effect of temperature on enzyme production by strain B1
2.5 优化前后产酶曲线
对菌株B1发酵培养基及发酵条件优化前后的产酶曲线进行比较,结果如图13所示。优化后,褐藻胶裂解酶的合成周期大大提前,在发酵22 h时,酶活力达到最大值(71.94 U/mL),24 h后呈缓慢下降趋势。与优化前相比,产酶高峰的时间由28 h缩短到22 h,最高酶活力由41.8 U/mL上升到71.94 U/mL,提高了72.11%。
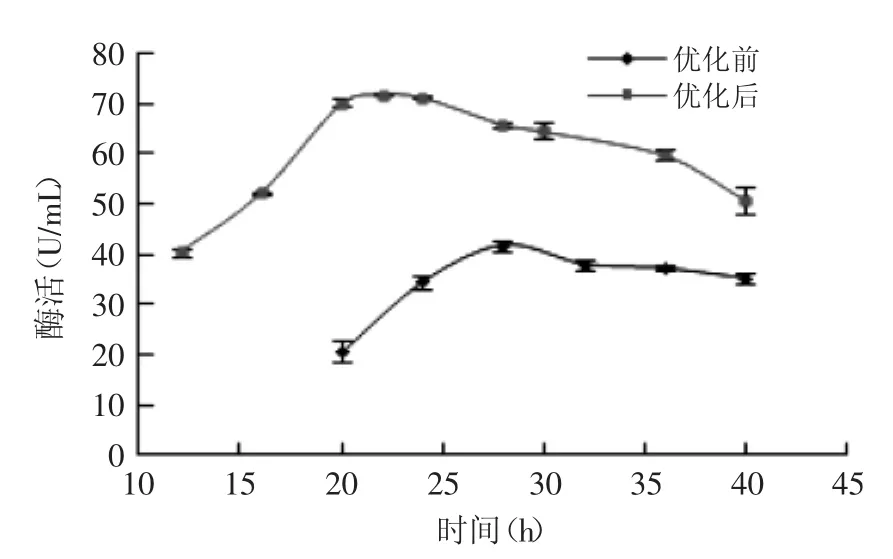
图13 菌株B1的产酶曲线Fig.13 Time course of enzyme formation of strain B1
3 结论
以褐藻酸钠为唯一碳源的选择培养基,从海带、鲍鱼内脏中筛选到9株产褐藻胶裂解酶菌株,发酵复筛得到产酶活力最高的菌株B1。通过形态学观察和16S rDNA序列分析鉴定菌株B1为假交替单胞菌(Pseudoalteromonas)。菌株B1最佳的发酵培养基:1%褐藻酸钠,0.2%氯化铵,3%NaCl,0.02%KH2PO4,0.01%MgSO4,0.1%CaCl2·2H2O,初始pH5.5。最佳的发酵条件:装液量75 mL,培养温度30℃,转速180 r/min。在上述优化条件下发酵,褐藻胶裂解酶活力可达71.94 U/mL,提高了72.11%,发酵周期由28 h缩短至22 h。本文对产褐藻胶裂解酶菌株进行筛选鉴定,并对其发酵条件进行优化,为该酶的工业化生产及应用打下基础。
[1]李丽妍,管华诗,江晓路,等.海藻工具酶——褐藻胶裂解酶研究进展[J].生物工程学报,2011,27(6):838-845.
[2]刘翼翔,吴永沛.褐藻胶裂解酶在制备海洋寡糖中的应用[J].食品工业科技,2007,28(6):220-222.
[3]刘玉佩,汪立平,赵勇,等.解淀粉芽孢杆菌产褐藻胶裂解酶的发酵条件优化[J].湖南农业科学,2010(3):17-20.
[4]傅晓妍,李京宝,韩峰,等.褐藻胶裂解酶产生菌Vibro sp. QY102的发酵条件优化[J].中国海洋大学学报:自然科学版,2007,37(3):432-436.
[5]Gacesa P,Wusteman F S.Plate assay for simultaneous detection of alginate lyases and determination of substrate specificity[J]. Applied and Environmental Microbiology,1990,56(7):2265-2267.
[6]Huang L,Zhou J,Li X,et al.Characterization of a newalginate lyase from newly isolated Flavobacterium sp.S20[J]. Journal of Industrial Microbiology& Biotechnology,2013,40(1):113-122.
[7]Wong T Y,Preston L A,Schiller N L.Alginate lyase:review of major sources and enzyme characteristics,structure-function analysis,biological roles,and applications[J].Annual Reviews in Microbiology,2000,54(1):289-340.
[8]侯保兵,刘书来,张建友,等.褐藻胶裂解酶产生菌的发酵优化研究[J].水产科学,2009(11):667-670.
[9]马悦欣,纪涛,李慧琼,等.假交替单胞菌LJ1菌株产褐藻胶裂解酶的培养条件优化及酶学性质[J].微生物学报,2009,49(8):1086-1094.
[10]Wang Y,Guo E W,Yu W G,et al.Purification and characterization of a new alginate lyase from a marine bacterium Vibrio sp[J].Biotechnology Letters,2013,35(5):703-708.
[11]An Q D,Zhang G L,Wu H T,et al.Alginate‐deriving oligosaccharide production by alginase from newly isolated Flavobacterium sp.LXA and its potentialapplication in protection against pathogens[J].Journal of Applied Microbiology,2009,106(1):161-170.
[12]李悦明,韩建友,徐建春,等.利用芽孢杆菌发酵生产褐藻胶裂解酶的研究[J].中国酿造,2010,29(4):79-81.
[13]Jun-fan C,Ying N I E,Bo S H I,et al.紫红链霉菌Streptomyces violaceoruber IFO 15732产褐藻胶裂解酶的培养条件优化[J].中国食物与营养,2013,19(4):48-51.
[14]张书利,管斌,邱向锋,等.褐藻胶裂解酶产生菌的筛选,鉴定及其产酶条件研究[J].现代食品科技,2006,22(3):24-27.
[15]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:155-161.
[16]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionarydistance,and maximum parsimonymethods[J]. Molecular Biology and Evolution,2011,28(10):2731-2739.
[17]Matsushima R,Watanabe R,Tsuda M,et al.Analysis of Extracellular Alginate Lyase(alyA)Expression and its Regulatory Region in a Marine Bacterial Strain,Pseudoalteromonas atlantica AR06,Using a gfp Gene Reporter System[J].Marine Biotechnology,2013,15(3):349-356.
[18]王霁宁,严孝强,杜宗军.一株高效褐藻胶降解菌的筛选及其发酵条件的优化[J].中国酿造,2012,31(5):7-10.
[19]Hu X,Jiang X,Hwang H.Purification and characterization of an alginate lyase from marine bacterium Vibrio sp.mutant strain 510-64[J].Current microbiology,2006,53(2):135-140.
[20]韩峰.海洋弧菌QY103褐藻胶裂解酶的研究[D].青岛:中国海洋大学,2008.
[21]付晓婷.海洋细菌(AgarivoransalbusYKW-34)产生的褐藻胶裂解酶及琼胶酶的研究[D].青岛:中国海洋大学,2008.
[22]Singh R P,Gupta V,Kumari P,et al.Purification and partial characterization of an extracellular alginate lyase from Aspergillus oryzae isolated from brown seaweed[J].Journal of Applied Phycology,2011,23(4):755-762.
Screening of alginate lyase-producing strains and optimization of fermentation conditions
YAN Fen,LIAN Yan-ping,YANG Guang,WANG Pei-song,WU Chen-shuo,CHEN Ning-xin
(College of Biological Science and Engineering,Fuzhou University,Fuzhou 350116,China)
A bacterial alginate lyase-producing strain B1 was screened with transparent circle method,It was identified as Pseudoalteromonas sp.according to its morphological observation and 16S rDNA sequence analysis to identified strain B1.And by single-factor method to optimize its enzyme production conditions,the optimal medium component were,sodium alginate 1%,NH4Cl 0.2%,NaCl 3%,KH2PO40.02%,MgSO40.01%,CaCl2·2H2O 0.1%,initial pH5.5,the optimal culture conditions were as follows:75 mL medium in 250 mL Erlenmeyer flask,Cultured at 30℃,shaking speed of 180 r/min,for 22 h.Under the optimal culture conditions,the highest enzyme activity of alginate lyase was up to 71.94 U/mL,improving 72.11%.
alginate lyase;Pseudoalteromonas;screen;identify;culture conditions
TS201.3
A
1002-0306(2015)22-0287-06
10.13386/j.issn1002-0306.2015.22.051
2015-03-04
严芬(1980-),女,博士,讲师,研究方向:食品微生物,E-mail:yanfen@fzu.edu.cn。
海洋公益性行业科研专项资助项目(201305015)。
