梅花鹿鹿角盘多肽双酶水解工艺及优化研究
2015-04-24皮钰珍王雨施何建斌岳喜庆
皮钰珍,王雨施,何建斌,岳喜庆
(1.沈阳农业大学食品学院,辽宁沈阳110866;2.沈阳农业大学畜牧兽医学院,辽宁沈阳110866)
梅花鹿鹿角盘多肽双酶水解工艺及优化研究
皮钰珍1,王雨施1,何建斌2,岳喜庆1
(1.沈阳农业大学食品学院,辽宁沈阳110866;2.沈阳农业大学畜牧兽医学院,辽宁沈阳110866)
鹿角盘是一味中药,具有温补肝肾、益脾胃、强筋骨、活血化瘀、治疗乳痈初起等功效。研究以鹿角盘粉为原料,用水解度和多肽得率作为衡量最佳提取工艺的指标,筛选出最佳双酶组合,水解制得鹿角盘多肽,在单因素实验的基础上,应用Box-Benhnken的中心组合实验设计和响应面(RSM)分析法,确定了最佳酶解工艺为:温度49℃、pH8.0、加酶量11000 U/g、酶活比(木瓜蛋白酶∶胰蛋白酶)为2∶1、底物质量浓度为6 g/100 mL、水解时间270 min。在此条件下,水解度达到15.91%。
鹿角盘,鹿角盘多肽,双酶水解,水解度
鹿角盘是一味传统中药,始载于《神农本草经》,为雄性鹿科动物马鹿或梅花鹿经锯茸后,于翌年春季脱落的骨化残角,是界于鹿茸骨化和未骨化之间十分坚硬的盘状物质[1-2]。鹿角盘中蛋白质含量丰富,粗蛋白含量为32.8%[3],其他主要成分有多糖、多肽以及钙、镁、锌、铜一些无机元素[4-6]等。根据临床应用证明:鹿角盘具有温补肝肾、镇痛散癖、活血消肿、治阴症疮疡等功效[7-8],有着广泛的药理活性和医疗保健功能,在我国民间用鹿角盘治疗乳腺增生效果尤为显著[9]。
王丽虹等[7]采用分子筛方法制备鹿角脱盘水溶性成分,具有抗大鼠乳腺增生的作用;王志兵等[10]采用超微粉碎、浸提、盐析、酶解、透析等方法提纯鹿角脱盘蛋白多肽对小鼠单核巨噬细胞吞噬功能有显著影响。目前制备鹿角盘肽的方法主要包括分子筛层析、有机提取配合柱层析分离、盐析、热变性处理及凝胶过滤和酶解[11-16]。近年来,采用单酶水解制备鹿角盘肽的研究日益增多,原因是酶法水解反应条件温和、步骤简洁、高利用率的优点[17],但仅采用单酶水解度较低,改采用双酶水解,利用不同酶的专一性,则可以扩大反应酶的作用范围,提高酶解效率[18]。
蛋白质作为人体必不可少的营养素,在人体的生长代谢过程中很难被直接消化吸收,将蛋白质水解成小肽和游离氨基酸,获得具有较强生物活性的蛋白质水解物,可提高在人体中的消化吸收利用率[19-20]。本研究利用双酶水解法制备鹿角盘粉中的生物活性肽,应用响应面法对酶解工艺进行优化,确定酶解最佳工艺条件,为鹿角盘多肽的制备以及其他骨化类组织的综合利用提供实验依据。
1 材料与方法
1.1 材料与仪器
鹿角盘粉 由辽宁西丰养鹿场提供(80目);碱性蛋白酶Alcalase 2.4L(9.14×104U/g)、胰蛋白酶(2.5×105U/g)、木瓜蛋白酶(4.0×105U/g)、复合风味蛋白酶(3.0×104U/g)、复合蛋白酶(1.2×105U/g),BCA蛋白定量试剂盒 以上均购买于北京鼎国昌盛生物技术有限责任公司。
S-25型pH精密酸度计 上海理达仪器厂;TMTD-8222电热恒温水浴锅 上海精宏实验设备有限公司;85-2型恒温磁力搅拌器 常州国华电器有限公司;CT14RD冷冻离心机 上海天美科学仪器有限公司;UV-2100型分光光度计 尤尼柯上海仪器有限公司。
1.2 实验方法
1.2.1 鹿角盘粉水解工艺流程 鹿角盘粉→磁力搅拌器混匀处理→调pH→调温度→酶解→灭酶(95℃水浴10 min)→离心(4500 r/min,15 min)→收集上清液→对沉淀物离心2次→合并上清液→鹿角盘多肽酶解液。
称取3 g超微粉碎的鹿角盘粉末,加入50 mL磷酸盐缓冲液,搅拌均匀,使用磁力搅拌器进行混匀处理,调至最适酶解温度,恒温保持,用0.5 mol/L的NaOH或0.5 mol/L的HCl溶液调pH至相应蛋白酶的最适pH,加入相应蛋白酶开始酶解,不断搅拌。同时维持溶液的pH恒定,并记录水解时间和酶解过程中消耗的NaOH或HCl体积,以此来计算水解度。酶解反应结束后,迅速升温至95℃,水浴保持10 min,灭酶活,冷却至室温后,4500 r/min离心15 min,取上清液,用适量蒸馏水洗涤沉淀物再次离心,上述操作重复2次,合并两次上清液,记录上清液总体积[21]。
1.2.2 单因素实验 以水解度(DH)为指标并结合感官评价,对酶解得到多肽液的颜色、气味、味道和溶液性状进行比较,分别选择碱性蛋白酶Alcalase 2.4L、胰蛋白酶、木瓜蛋白酶、复合风味蛋白酶和复合蛋白酶水解鹿角盘粉,筛选出两种最适作用酶。
1.2.2.1 酶活比对水解的影响 取3 g鹿角盘粉末,在总加酶量为10000 U/g、温度为47℃、pH为7.9、底物质量浓度为6 g/100 mL、酶解时间为270 min时,考察酶活比(木瓜蛋白酶∶胰蛋白酶)(1∶3、1∶1、1∶2、2∶1、3∶1)对水解度的影响。
1.2.2.2 酶解时间对水解的影响 取3 g鹿角盘粉末,在总加酶量为10000 U/g、温度为47℃、酶活比为2∶1、pH为7.9、底物质量浓度为6 g/100 mL时,考察酶解时间(0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5 h)对水解度的影响。
1.2.2.3 底物浓度对水解的影响 取3 g鹿角盘粉末,在加酶量为10000 U/g、酶活比为2∶1、温度为47℃、pH为7.9、酶解时间为270 min时,考察底物质量浓度(2、4、6、8、10 g/100 mL)对水解度的影响。
1.2.2.4 加酶量对水解的影响 取3 g鹿角盘粉末,在酶活比为2∶1、底物质量浓度为6 g/100 mL、温度为47℃、pH为7.9、酶解时间为270 min时,考察加酶量(6000、8000、10000、12000、14000 U/g)对水解度的影响。
1.2.2.5 酶解温度对水解的影响 取3 g鹿角盘粉末,在酶活比为2∶1、底物质量浓度为6 g/100 mL、pH为7.9、加酶量10000 U/g、酶解时间为270 min时,考察酶解温度(40、43、47、50、54℃)对水解度的影响。
1.2.2.6 pH对水解的影响 取3 g鹿角盘粉末,在酶活比为2∶1、底物质量浓度为6 g/100 mL、加酶量10000 U/g、酶解温度为47℃、酶解时间为270 min时,考察pH(7.0、7.3、7.7、8.1、8.5)对水解度的影响。
1.2.3 响应面优化实验 在单因素实验的基础上,以酶解温度、pH、加酶量、酶活比为考察因素,以水解度为考察指标,进行四因素三水平的中心组合设计实验,因素水平表见表1。

表1 响应面分析因素及水平Table 1 Factors and levels of response surface experiment
1.2.4 指标测定
1.2.4.1 水解度的计算 pH-state法主要是基于蛋白质水解过程中,总是要伴随质子的释放或吸收,质子化的多少依赖于溶液的pH,通过加入的用于维持体系pH的碱或酸的量直接计算出水解度[22]。

式中:C、V:NaOH或HCl溶液的浓度(mol/L)和体积(mL);Mp为原料中净蛋白质质量(g);htot为1 g原料蛋白质中所含肽键的毫摩尔数(mmol/g),对鹿角盘蛋白质该值取8.2[23-24];α为氨基的平均解离度(α=1+ 10(pK-pH),pK为α氨基的解离常数,计算时取7.0,pH为实验时采用的pH)。
1.2.4.2 多肽含量测定 采用微量BCA法[25]来测定组分中的多肽含量。
多肽得率的计算
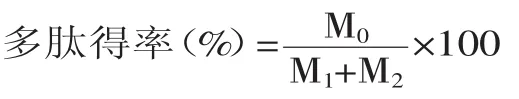
式中:M0为水解液中蛋白质总量;M1为原料蛋白质总量;M2为酶蛋白质的量。
2 结果与分析
2.1 单酶的筛选
由表2可知,复合蛋白酶和碱性蛋白酶Alcalase 2.4L的水解度较大,但水解液呈现黄色并浑浊状态,且腥苦味重、明显,其感官性质差,产物不易被接受利用;由于胰蛋白酶具有较强特异性,对精氨酸和赖氨酸的羧基端酶切位点有明显专一性,因此水解度较低,对多肽得率进行测定,发现木瓜蛋白酶和胰蛋白酶的多肽得率可达到59.12%和57.86%,均高于其他三个酶系的多肽得率,且胰蛋白酶和木瓜蛋白酶水解液澄清度较高,腥味最淡。因此,最终确定,以胰蛋白酶和木瓜蛋白酶作为水解鹿角盘粉的工具酶。

表2 各种蛋白酶对鹿角盘蛋白水解效果比较Table 2 Effect of different proteases on protein hydrolysis
2.2 双酶水解鹿角盘粉的单因素实验
2.2.1 酶活比的确定 结果如图1所示,酶活比(木瓜蛋白酶∶胰蛋白酶)为1∶1的酶系组合水解度最小,酶活比为2∶1的组合水解度最大,可达到15.68%,且观察可知水解液澄清、无腥苦味。因为双酶水解优于单酶水解的关键就在于不同的酶系在酶切位点之间的协同互补作用,所以可在保持水解液最优状态的条件下,提高水解度。由此可知酶活比为2∶1左右时水解效果较好。

图1 酶活比对鹿角盘多肽水解度的影响Fig.1 Effect of different ratios of enzyme activity protein hydrolysis
2.2.2 酶解反应时间的确定 结果如图2所示,随着反应时间延长水解度逐渐增大,较为明显的是在前90 min,水解速度较快,当反应进行到240 min时,水解度变化减小,到300 min时已趋于平稳,原因可能是在最初水解时,底物浓度大,酶浓度相对较高,酶作用的肽键数目较多,所以这一阶段的水解速度较快,水解速率增加也快。随着水解的进行,水解底物中肽键的数目减少,从而使得水解速度减缓。除此之外,水解底物对酶解过程起到抑制作用的物质也逐渐增加,很可能对酶的活性产生不良影响,水解速度更加缓慢。综合考虑底物利用率和生产效率,最终确定水解时间为270 min。

图2 酶解时间对鹿角盘多肽水解度的影响Fig.2 Effect of reaction time on protein hydrolysis peptide
2.2.3 底物浓度的确定 由图3表明,在底物浓度为6 g/100 mL时,水解度达到最大值,在低底物浓度时,酶与底物不能充分结合;随着底物浓度的增加,越来越多的酶分子能够与底物中的肽键相结合,使酶解反应充分进行,一旦底物浓度过大,达到8 g/100 mL时,出现饱和,原料利用率低。综合考虑,双酶水解反应底物浓度定为6 g/100 mL。
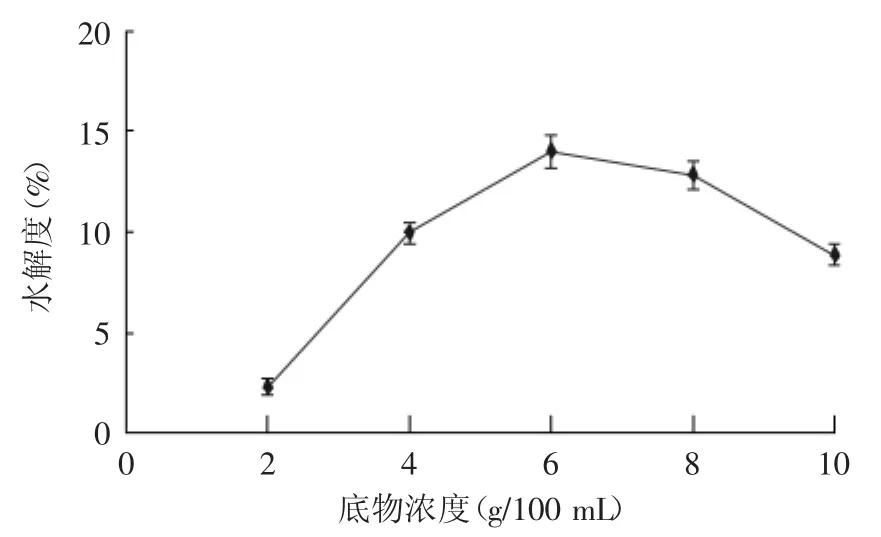
图3 底物浓度对鹿角盘多肽水解度的影响Fig.3 Effect of substrate concentration on protein hydrolysis
2.2.4 加酶量的确定 由图4可知,随着加酶量的增加,水解度逐渐增加,尤其是在8000~10000 U/g区间,水解度增加幅度较大,当加酶量大于10000 U/g时,水解度增幅减少。原因是当加酶量增加到一定程度后,酶分子出现一定剩余,此时底物已经达到饱和,底物与酶不能进行进一步的有效反应,限制了反应的进行。综合考虑,双酶水解反应加酶量为10000 U/g左右。
2.2.5 酶解温度的确定 由图5可知,当温度稳定在47℃左右时,水解度最高,达到15.89%,原因可能是随着温度的上升,分子活跃能力强,分子间有效碰撞频率大,反应速度快,从而增加水解度,当温度再升高时,酶活性下降,因此水解度曲线呈现先增加后减少的趋势。
2.2.6 pH的确定 由图6可知,随着反应液pH的增加,蛋白质水解度逐渐上升,当pH继续增大,水解度出现下降趋势,当pH处于过高或过低都会直接影响酶蛋白分子上氨基酸残基侧链基团的解离状态,从而降低酶的催化活性,由图可看出当pH为8.1时,水解度较高。

图4 加酶量对鹿角盘水解度和多肽得率的影响Fig.4 Effect of enzyme dosage on protein hydrolysis
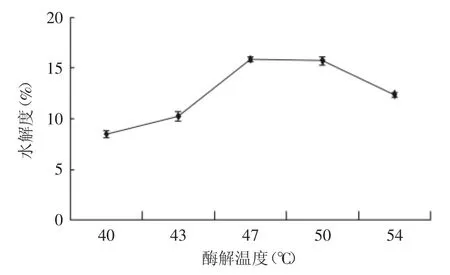
图5 温度对鹿角盘多肽水解度的影响Fig.5 Effect of temperature on protein hydrolysis
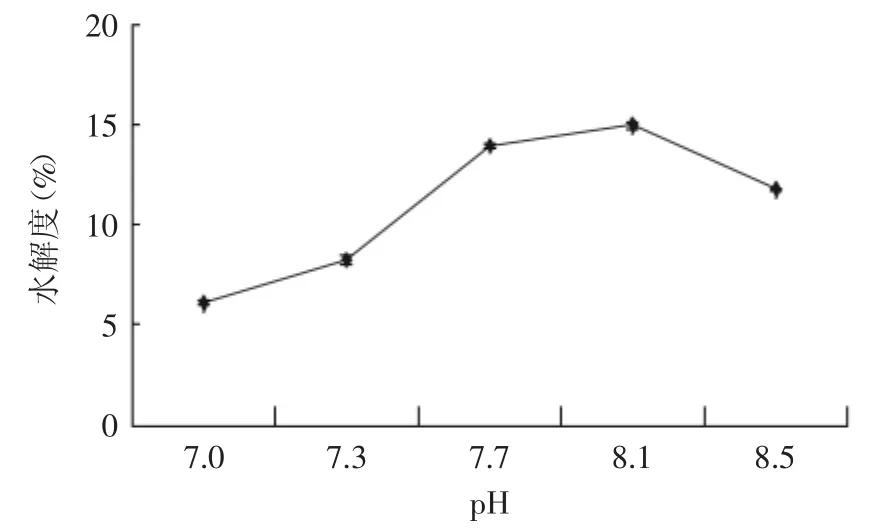
图6 pH对鹿角盘多肽水解度的影响Fig.6 Effect of pH value on protein hydrolysis
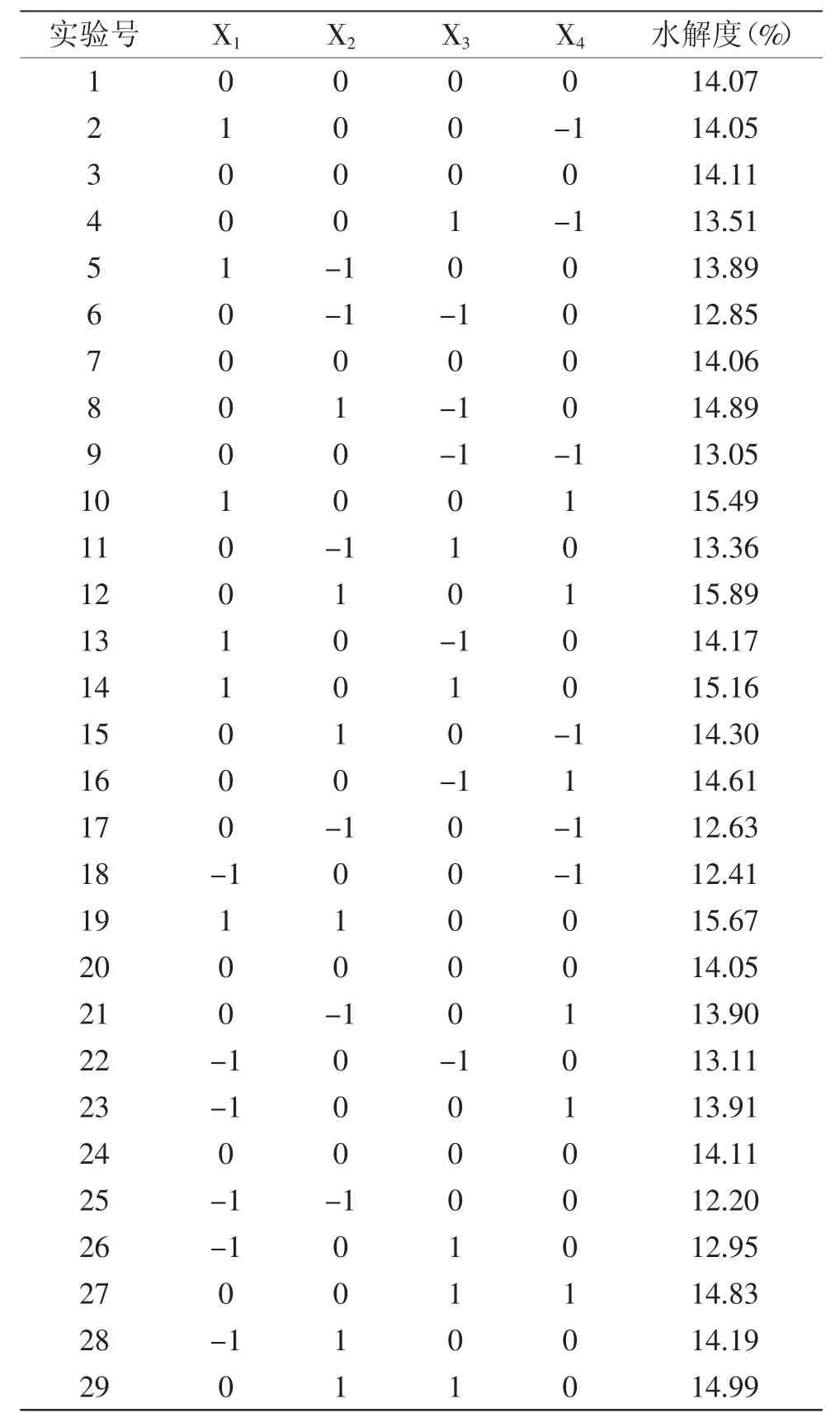
表3 响应面优化实验方案及结果Table 3 Results of response surface experiments
2.3 双酶水解条件的响应面优化结果
以水解过程中酶活比、加酶量、pH和酶解温度为因素,以水解度为响应值,进行四因素三水平共29次实验点的响应面分析实验[26],响应面优化实验方案及结果见表3、方差分析和酶解各因素显著性比较结果见表4。
利用SPSS软件对实验结果进行回归分析,对各因素回归拟合后,得到回归方程为:Y=14.08+0.81X1+0.92X2+0.18X3+0.72X4-0.052X1X2+0.29X1X3-0.015X1X4-0.1X2X3+0.08X2X4-0.06X3X4-0.14X12+0.055X22-0.11X32+0.031X42。
为了检验方程的有效性,对鹿角盘多肽双酶水解建立的模型进行方差分析。由表4可知,该模型显著性达到极显著水平(p<0.01),失拟项不显著(p>0.05),说明该模型有较好的拟合度。回归系数显著性检验显示,一次项X1、X2、X3、X4,交互项X1X2、X1X3、X2X3、X2X4、X3X4,二次项X12、X22、X32、的影响均达到极显著水平(p<0.01),二次项X42的影响达到显著水平(p>0.05)。由各因素的F值能够反映出各因素对实验指标的影响程度,F值越大,表明对实验指标的影响越大,即越重要[27]。根据方差分析表,由p值可知,在整个实验范围对水解度影响的大小依次为:酶解温度>pH>酶活比>加酶量。
回归方程的特征值存在异号,因此在回归方程所对应的抛物线不存在最大值,需进行岭分析,将酶解温度、pH、加酶量和酶活比分别固定,水解度随其余参数变化的趋势如图7~图10所示,响应面图表现有扭曲,说明各两因素之间存在交互作用,交互显著性可见表4,图像曲面没有呈碗状,原因可能是由于研究的目的为让所有考察的单因素都发挥出最佳效果,而单因素之间,对实验指标的影响效果也存在强弱,可能各因素之间的影响能力差距并不大,所以,当混合在一起时,有可能效应叠加或效应减弱。由图7、图9、图10可知,pH和温度对鹿角盘水解度的影响优于加酶量和酶活比,在各交互图的全值变化范围内,在分别固定pH和温度水平时,水解度随着酶活比和加酶量的改变呈现先增加后减小的趋势;由图8可知,酶解温度对水解效果的影响略优于pH[21]。

表4 水解度回归模型方差分析表Table 4 Variance analysis of regression equation

图7 pH和酶活比对水解度的响应面分析Fig.7 RSM analysis of the combined effect of pH and ratio of protease on DH
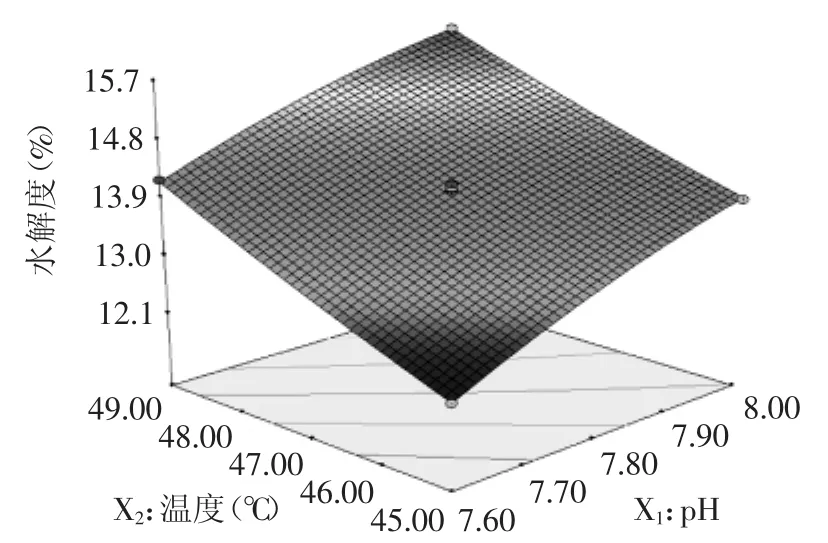
图8 pH和温度对水解度的响应面分析Fig.8 RSM analysis of the combined effect of pH and temperature on DH
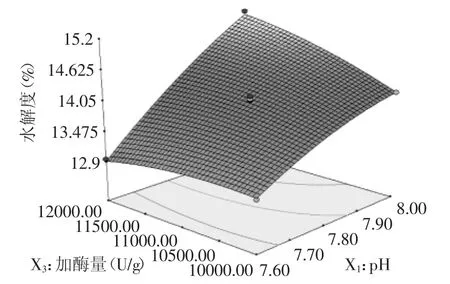
图9 pH和加酶量对水解度的响应面分析Fig.9 RSM analysis of the combined effect of pH and enzyme dosages on DH

图10 温度和酶活比对水解度的响应面分析Fig.10 RSM analysis of the combined effect of temperature and ratio of protease on DH
通过Desigh-Expert 8.0 Trial软件分析可知,双酶水解鹿角盘多肽的最佳酶解工艺为温度49.00℃、pH8.00、加酶量10999.97 U/g、酶活比(木瓜∶胰)为2.02∶1,在此优化条件下,鹿角盘多肽的水解度的模型理论值为15.67%,为实际操作方便,将理论值校正为温度49℃、pH8.0、加酶量11000 U/g、酶活比(木瓜∶胰)为2∶1,此时,验证实验水解度指标可达到15.91%,与理论预测值的相对误差在1.5%左右,因此响应面法所得的酶解条件参数准确可靠,具有实用价值。
3 结论
研究通过单因素实验及响应面优化实验,选择胰蛋白酶和木瓜蛋白酶双酶组合水解,实验结果表明双酶水解效果优于单酶水解,最佳的酶解工艺条件为:酶解时间270 min、温度49℃、pH8.0、底物质量浓度6 g/100 mL、酶活比为2∶1、加酶量11000 U/g时,水解度达到15.91%。按此工艺制备的水解液感官性状良好,呈透明淡黄色,易接受,无腥苦味,易吸收,可作为功能性食品的添加原料。
[1]钱璟,吉静娴,黄凤杰,等.鹿角脱盘活性物质的研究与开发利用[J].药物生物技术,2009,16(3):283-286.
[2]史小青,刘金哲,姚艳飞,等.梅花鹿鹿花盘小鼠抗疲劳作用的研究[J].吉林农业大学学报,2011,33(4):408-410.
[3]张旭霞,田玉华,齐琳,等.梅花鹿鹿角脱盘化学成分的研究[J].吉林畜牧兽医2013(8):11-16.
[4]于文影,郜玉钢,郝建勋,等.鹿角盘蛋白酶解工艺优化及其水解物抗氧化活性研究[J].时珍国医国药,2011,22(11):2699-2700.
[5]李淑芬,王峰,王玉方,等.鹿角盘的研究进展[J].黑龙江畜牧兽医,2011(10):34-37.
[6]黄金凤,王维,王莘,等.鹿茸及鹿花盘蛋白提取物的抑菌比较[J].吉林农业,2010(9):43-44.
[7]Wu Feifei,li Huaqiang,Jin liji,et al.Deer antler base as a traditional Chinese medicine:A review of its traditional uses,chemistry and pharmacology[J].Journal of Ethnopharmacology,2013,143:403-415.
[8]黄彬彬,程思瑶,南璐璐,等.鹿花盘生物活性的研究进展[J].吉林医药学院学报,2013,34(2):130-132.
[9]牛放,赵雨,杨菲,等.梅花鹿鹿角托盘提取物的抗炎镇痛作用[J].中国医院药学杂志,2011,31(10):789-791.
[10]王志兵,邱芳萍,李治民,等.鹿角盘活性成分对小鼠吞噬功能及对大鼠乳腺增生激素水平的影响[J].食品科技,2007(11):225-226.
[11]邱芳萍,马波,王志兵,等.鹿角盘蛋白的分离纯化与活性研究[J].长春工业大学学报,2007,28(3):144.
[12]唐仁能,赵雨,孙晓迪,等.梅花鹿鹿茸、鹿托盘及鹿骨水溶性总蛋白比较研究[J].吉林中医药,2008,28(4):295.
[13]Scaglia N,lgal R A.Stearoy-CoA desaturase is involved in the control of proliferation,anchorage-independent growth,and survival in human transformed cells[J].J Biol Chem,2010,280(270):25339-25349.
[14]MINEY,SHAHIDIF.Nutraceutical proteins and peptides in health and disease[M].New York:CRC Press,2006:626-628.
[15]李银清,曲毅,曲晓波,等.梅花鹿鹿角脱盘研究进展[J].安徽农业科学,2009,37(28):132-133
[16]王志兵,邱芳萍,解耸林,等.鹿角盘蛋白多肽的制备与活性研究[J].中国食品学报,2008,8(3):28-32.
[17]CAO S,HU Z,PANG B.Optimization of postharvest ultrasonic treatment of strawberry fruit[J].Postharvest Biology and technology,2010,55(32):150-153.
[18]邓成萍,薛文通,孙晓琳,等.双酶水解制备大豆多肽的研究[J].粮油食品科技,2006,14(1):23-24.
[19]庞广昌,陈庆森.蛋白质的消化吸收及功能评述[J].食品科学,2013,34(9):375-391.
[20]牛海力,孔保华,刘骞,等.蛋白质水解物与食品中不同组分之间交互作用的研究进展[J].食品工业科技,2014,35(23):377-381.
[21]付春燕,周丹珺,陆焰,等.响应面法优化鲐鱼头酶解条件[J].食品科学,2010,31(22):54-58.
[22]徐英超,刘春红.蛋白质水解度测定方法综述[J].食品研究与开发,2007,28(07):173-175.
[23]CHEMAT F,HUMA Z,KHAN M K.Applications of ultrasound in food technology:Processing,preservation and extraction[J].Ultrasonics Sonochemistry,2011,18(10):813-835.
[24]Anne Pihlanto-Leppa la.Bioactive peptide derived from bovinewhey proteins opioid and ace-inhibitory peptides[J]. Trends in Food Science and Technology,2009(11):347.
[25]张云楚,纪宇.双辛可宁酸法测定胎盘多肽注射液中低浓度多肽的含量[J].中国生化药物杂志,2010,31(6):402-404.
[26]刘艳秋,陈光,孙旸.Protamex复合蛋白酶水解大豆分离蛋白的研究[J].食品科学,2005,26(6):155-158.
[27]韦慧娟,陈树兴,李丽丽,等.乳清蛋白酶解物促干酪乳杆菌生长作用的研究[J].食品科学,2013,34(21):188-192.
Bienzymatic hydrolysis process of sika deer antler base
PI Yu-zhen1,WANG Yu-shi1,HE Jian-bin2,YUE Xi-qing1
(1.College of Food,Shenyang Agriculture University,Shenyang 110866,China;2.College of Animal Husbandry and Veterinary Medicine,Shenyang Agriculture University,Shenyang 110866,China)
Antler base as a traditional Chinese medicine,is believed to nourish liver,tonify,kidney,invigorate spleen and stomach,strengthen bones and muscles,promote blood flow and treat mastitis early.In this paper,antlers base powder as raw material,the degree of hydrolysis was as a measure of the optimal indicators of the extraction process.And the best combination of dual enzymatic hydrolysis of peptides was selected and obtained.Based on one-factor-at-a-time method,the response surface(RSM)analysis method based on Box-Behnken design was applied.The result of determining the optimal level of enzyme hydrolysis process is:temperature of 49℃,pH of 8.0,270 min with enzyme dosage of 11000 U/g,enzyme activity ratio of(papain∶trypsin)2∶1 and a substrate concentration of 6 g/100 mL.Under this condition,the hydrolysis degree could be reached 15.91%,respectively.
antlers base;antlers base peptide;bienzymatic hydrolysis;hydrolysis degree
TS201.2
A
1002-0306(2015)22-0203-06
10.13386/j.issn1002-0306.2015.22.034
2015-03-31
皮钰珍(1974-),女,博士,副教授,研究方向:动物性食品加工,E-mail:1204872597@qq.com。
辽宁省科学技术计划项目(201331004-2);辽宁省优秀人才培育项目(2015020771)。
