纳米腐植酸基复合树脂的制备及其对Ni2+和Cd2+的吸附
2015-04-24侯翠红雒廷亮张保林刘国际
程 亮,徐 丽,侯翠红,雒廷亮,张保林,刘国际
(郑州大学 化工与能源学院,河南 郑州 450001)
纳米腐植酸基复合树脂的制备及其对Ni2+和Cd2+的吸附
程 亮,徐 丽,侯翠红,雒廷亮,张保林,刘国际
(郑州大学 化工与能源学院,河南 郑州 450001)
采用水溶液聚合法,以丙烯酸、丙烯酰胺及改性蒙脱土为原料,纳米腐植酸为基体,N,N’-亚甲基双丙烯酰胺为交联剂,过二硫酸钾为引发剂,制备了丙烯酸-蒙脱土-丙烯酰胺/纳米腐植酸复合树脂(简称复合树脂)。考察了溶液pH、吸附时间、吸附温度、初始离子浓度等因素对复合树脂分别吸附Ni2+和Cd2+的影响。实验结果表明:在吸附温度35 ℃、吸附时间90 min、溶液pH为7、初始Ni2+和Cd2+的浓度分别为0.02 mol/L、复合树脂加入量16.7 g/L的条件下,Ni2+和Cd2+的吸附量分别为383.02 mg/g和359.27 mg/g;复合树脂吸附Ni2+和Cd2+的吸附等温线均满足Langmuir等温吸附方程;吸附过程均符合准二级动力学方程;复合树脂重复使用6次,其对Ni2+和Cd2+的吸附量分别降低了17.1%和9.3%。
纳米腐植酸;复合树脂;水溶液聚合法;静态吸附;吸附等温线;吸附动力学模型
在印染、电镀、石油、煤燃烧及矿山冶炼等行业中,镍和镉是两种重要的化工原料。在工业生产中会产生大量重金属污染。这些污染物若直接排放到自然环境中,会造成大气、土壤及水资源的严重污染[1]。目前,重金属的处理方法主要包括离子交换法、生物法、电解法和吸附法。其中,吸附法因流程简便、成本低廉而被广泛应用[2]。纳米腐植酸是随着纳米技术的发展而产生的一种新型材料,纳米腐植酸分子中包含羧基、羟基和醌基等活性基团,对重金属离子具有螯合和离子交换作用[3-6]。Zheng等[7-10]分别以D152树脂、几丁质、D001阳离子交换树脂和D151树脂为吸附剂,对Cd2+和Ni2+进行吸附-脱附研究,Cd2+和Ni2+的饱和吸附量分别为378,165.9,185.8,206.57 mg/g。迄今为止,以纳米腐植酸为载体的吸附剂的制备及其对Ni2+和Cd2+的吸附未见文献报道。
本工作以丙烯酸、丙烯酰胺及改性蒙脱土为原材料,纳米腐植酸为基体,N,N’-亚甲基双丙烯酰胺为交联剂,过二硫酸钾为引发剂,用水溶液聚合法制备了丙烯酸-蒙脱土-丙烯酰胺/纳米腐植酸复合树脂材料(简称复合树脂)。考察了溶液pH、吸附时间、吸附温度、初始离子浓度等因素对复合树脂吸附Ni2+和Cd2+的影响。为复合树脂处理含Ni2+和Cd2+的大规模工业废水提供了基础数据和理论指导。
1 实验部分
1.1 试剂和仪器
纳米腐植酸:参照文献[3]报道的方法自制,粒径60~90 nm;改性蒙脱土:自制;丙烯酸、丙烯酰胺、N,N’-亚甲基双丙烯酰胺、过二硫酸钾、硫酸镍、硫酸镉:分析纯。
SHA-BA型水浴恒温震荡仪:常州博远分析仪器公司;752型紫外-可见分光光度计:上海棱光技术公司;PHS-3C型pH计:上海精密科学仪器公司。
1.2 复合树脂的制备
称取一定量的丙烯酰胺和丙烯酸,置于250 mL三口烧瓶,加入一定量自制的纳米腐植酸与0.5 g改性蒙脱土,在搅拌转速为1 500 r/min、恒温水浴下反应1.5 h。加入一定量交联剂N,N’-亚甲基双丙烯酰胺,继续搅拌一段时间后加入一定量引发剂过二硫酸钾反应3.0 h,于100 ℃下真空干燥,粉碎后即得产物。
1.3 吸附实验
采用硫酸镍和硫酸镉分别配制Ni2+溶液和Cd2+溶液。
准确称取0.50 g复合树脂置于锥形瓶中,分别加入一定浓度的Ni2+或Cd2+溶液30 mL,用橡皮塞旋紧后放入恒温振荡箱振荡一定时间后取出,离心30 min后取上清液进行分析。
1.4 复合树脂的再生
将吸附平衡后的溶液离心分离,去除上清液,取下层固体加入HCl溶液,在室温下振荡3 h,离心分离后,用蒸馏水反复洗涤至中性,烘干。经脱附再生后的复合树脂可继续用于吸附实验。
1.5 分析方法
采用紫外-可见分光光度计分别在波长232 nm和228 nm处测定Ni2+溶液和Cd2+溶液的吸光度,计算Ni2+和Cd2+的浓度。
2 结果与讨论
2.1 溶液pH对Ni2+和Cd2+的吸附量的影响
在吸附温度为35 ℃、吸附时间为90 min、初始Ni2+和Cd2+的浓度分别为0.02 mol/L、复合树脂加入量为16.7 g/L的条件下,溶液pH对Ni2+和Cd2+的吸附量的影响见图1。由图1可见:随溶液pH的升高,Ni2+和Cd2+的吸附量逐渐增加,这是由于pH较低(pH<5.0)时,溶液中H+较多,会与Ni2+和Cd2+发生竞争吸附,且酸性环境会抑制复合树脂分子中—CONH2和—COOH等功能基团的解离,导致吸附剂对Ni2+和Cd2+的吸附量较低,升高pH,H+的竞争吸附作用逐渐减弱,—COOH的解离度逐渐增大,负离子间的互斥使复合树脂高度溶胀,形成的大量羧酸根离子通过静电吸引等作用吸附Ni2+和Cd2+;当溶液pH大于5以后,Ni2+和Cd2+的吸附量增加缓慢。综合考虑经济因素及吸附效果,选择最佳溶液pH为7。
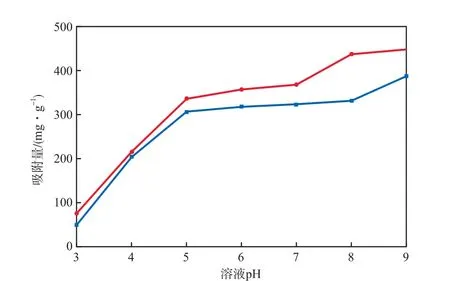
图1 溶液pH对Ni2+和Cd2+的吸附量的影响
2.2 吸附时间对Ni2+和Cd2+的吸附量的影响
在吸附温度为35 ℃、溶液pH为7、初始Ni2+和Cd2+的浓度分别为0.02 mol/L、复合树脂加入量为16.7 g/L的条件下,吸附时间对Ni2+和Cd2+的吸附量的影响见图2。由图2可见:随吸附时间的延长,Ni2+和Cd2+的吸附量逐渐增加;当吸附时间为90 min时,吸附量基本保持不变。随吸附时间的延长,复合树脂分子上含有的大量亲水基团作为空缺吸附活性位与Ni2+和Cd2+进行配位吸附;同时,复合树脂的三维网状结构在溶液中溶胀,增加了凝胶内部与表面的浓度梯度,使得传质推动力增加,溶液中的Ni2+和Cd2+迅速向凝胶内扩散,导致吸附速率增加。因此,选择最佳吸附时间为90 min。
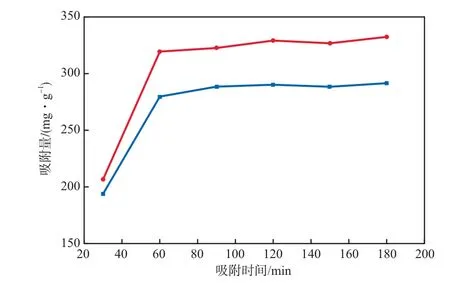
图2 吸附时间对Ni2+和Cd2+的吸附量的影响
2.3 初始浓度对Ni2+和Cd2+的吸附量的影响
在吸附温度为35 ℃、吸附时间为90 min、溶液pH为7、复合树脂加入量为16.7 g/L的条件下,初始Ni2+和Cd2+的浓度对其吸附量的影响见图3。
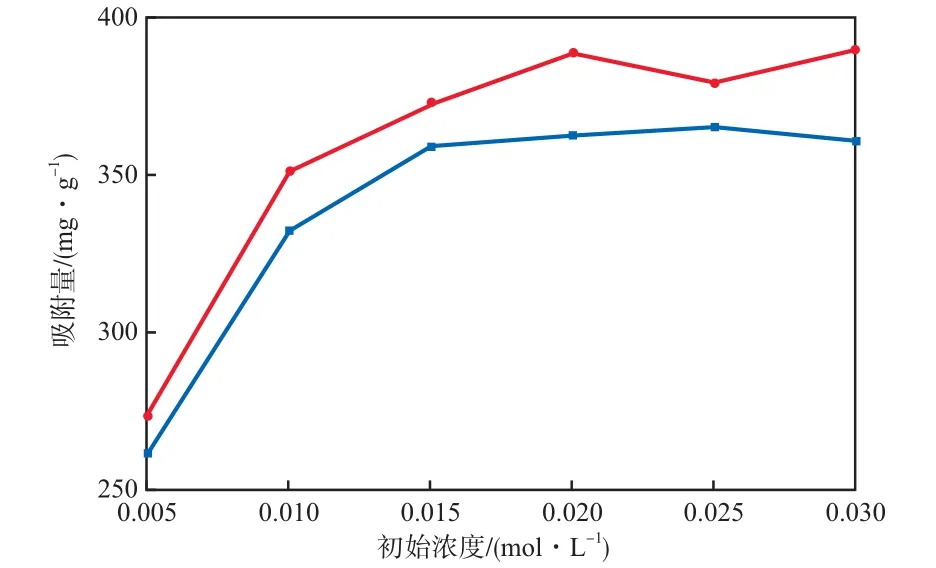
图3 初始Ni2+和Cd2+的浓度对其吸附量的影响
由图3可见:随初始Ni2+和Cd2+的浓度的增加,Ni2+和Cd2+的吸附量逐渐增加,Ni2+和Cd2+的浓度的增加会增大吸附剂与溶液中离子的接触几率,使吸附剂表面的吸附位点充分利用,且在高浓度溶液中吸附剂内部与表面的浓度梯度较大,传质推动力也较大,从而吸附速率较快;但对于一定质量的吸附剂,活性吸附位点总量有限,即吸附容量有限,当吸附剂上的活性吸附位点被全部占据后,吸附达到平衡,继续增加初始Ni2+和Cd2+的浓度不会使吸附量增加;当初始Ni2+和Cd2+的浓度为0.02 mol/L时,复合树脂对Ni2+和Cd2+的吸附量分别为383.02 mg/g和359.27 mg/g。
2.4 吸附温度对Ni2+和Cd2+的吸附量的影响
在初始Ni2+和Cd2+的浓度分别为0.02 mol/L、吸附时间为90 min、溶液pH为7、复合树脂加入量为16.7 g/L的条件下,吸附温度对Ni2+和Cd2+的吸附量的影响见图4。由图4可见:随吸附温度的升高,Ni2+和Cd2+的吸附量先明显增加,这可能是由于升高温度有利于复合树脂三维网状结构的溶胀,使Ni2+和Cd2+更容易扩散至吸附剂内部;当温度升高至40 ℃后,吸附量有所降低,这是由于一般脱附为吸热过程,低温有利于吸附,而高温有利于脱附,温度升高至一定值时可能发生脱附,导致吸附量降低。综合考虑经济因素及吸附效果,选择最佳吸附温度为35 ℃。
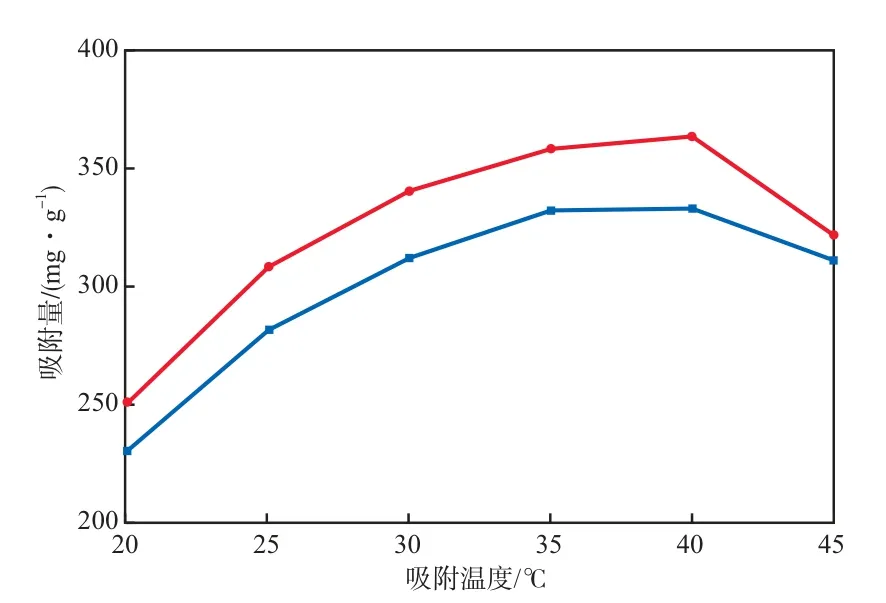
图4 吸附温度对Ni2+和Cd2+的吸附量的影响
2.5 吸附等温线
在吸附温度为35 ℃、吸附时间为90 min、溶液pH为7、复合树脂加入量为16.7 g/L的条件下,分别采用Langmuir、Freundlich和Temkin等温吸附方程(见式(1)~ (3))[11-12]对实验数据进行拟合,Ni2+和Cd2+的等温吸附方程拟合结果分别见表1和表2。

式中:qe为平衡吸附量,mg/g;qsat为饱和吸附量,mg/g;ce为吸附平衡时离子的浓度,mol/L;b为Langmuir吸附常数;n和kf为Freundlich吸附常数;A和B为Temkin吸附常数。
由表1和表2可见:与Temkin等温吸附方程和Freundlich等温吸附方程相比,Langmuir等温吸附方程能更好地描述复合树脂对Ni2+和Cd2+的吸附行为,表明吸附过程为单分子层吸附,且复合树脂表面各处的吸附能力相同,Ni2+和Cd2+可被均匀地吸附到复合树脂的表面;Ni2+和Cd2+的Langmuir等温吸附方程的相关系数分别为0.996 7和0.992 8;由Langmuir等温吸附方程计算出Ni2+和Cd2+的饱和吸附量分别为458.72 mg/g和431.03 mg/g。

表1 Ni2+的等温吸附方程拟合结果

表2 Cd2+的等温吸附方程拟合结果
2.6 吸附动力学
吸附动力学主要研究溶质在吸附剂上的扩散机理、吸附速率的影响因素以及吸附过程中的控制步骤。在吸附温度为35 ℃、溶液pH为7、初始Ni2+和Cd2+的浓度分别为0.02 mol/L、复合树脂加入量为16.7 g/L的条件下,分别采用准一级动力学方程(见式(4))、准二级动力学方程(见式(5))、双常数动力学方程(见式(6))、Elovich动力学方程(见式(7))和内扩散动力学方程(见式(8))[13-15]对实验数据进行拟合, Ni2+和Cd2+的吸附动力学方程拟合结果分别见表3和表4。
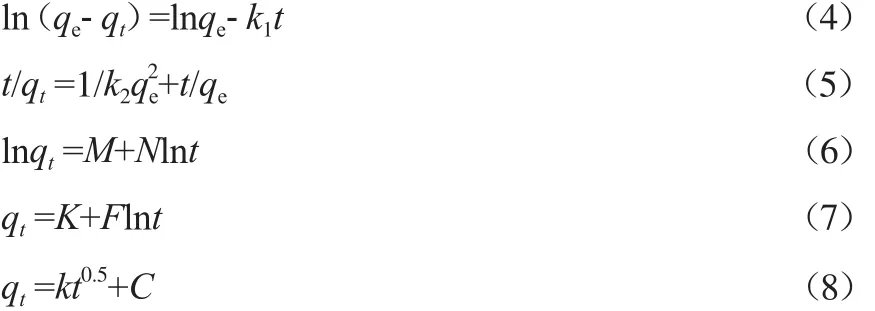
式中:t为吸附时间,min;qt为t时刻的吸附量,mg/g;k1为准一级动力学方程的吸附速率常数,min-1;k2为准二级动力学方程的吸附速率常数,g/(mg·min);M和N为双常数动力学方程的吸附速率常数;K和F为Elovich动力学方程的吸附速率常数;k和C为内扩散动力学方程的吸附速率常数。
由表3和表4可见:与其他4种模型相比,准二级动力学方程能更好地描述复合树脂对Ni2+和Cd2+的吸附行为,Ni2+和Cd2+的准二级吸附动力学方程的相关系数分别为0.995 1和0.991 7,说明复合树脂吸附Ni2+和Cd2+的主要控制步骤均为液膜扩散;由准二级动力学方程计算出Ni2+和Cd2+的平衡吸附量分别为400.00 mg/g和384.61 mg/g,吸附速率常数均为0.000 1 g/(mg·min)。

表3 Ni2+的吸附动力学方程拟合结果
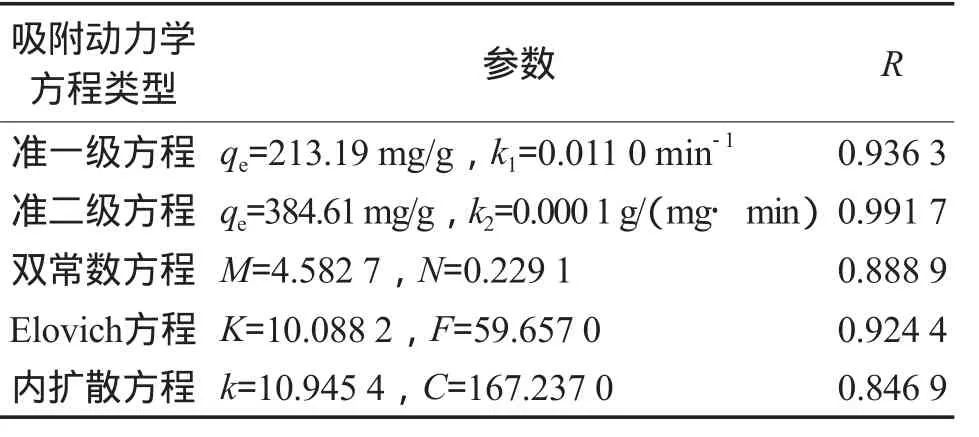
表4 Cd的吸附动力学方程拟合结果
准一级吸附动力学方程的拟合结果与实验数据差别较大,这可能是由于该模型对边界条件的计算具有局限性。双常数吸附动力学方程与Elovich吸附动力学方程均为经验公式,适用于吸附过程复杂、活化能大的反应过程。内扩散吸附动力学方程的相关系数较低,表明内扩散不是该吸附过程的控制步骤。
2.7 复合树脂的重复使用效果
复合树脂的重复使用效果见图5。
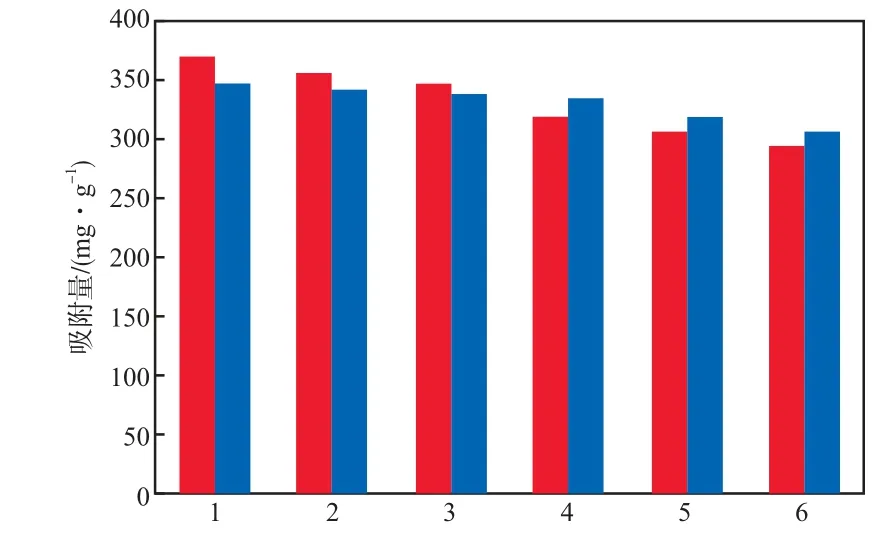
图5 复合树脂的重复使用效果
由图5可见,复合树脂经6次重复使用,其对Ni2+的吸附量由383.02 mg/g降至303.52 mg/g,Cd2+的吸附量由359.27 mg/g降至318.07 mg/g,分别仅降低了17.1%和9.3%。这表明复合树脂具有较好的解吸再生和重复使用性能,在处理镍镉废水领域具有较大潜能。
3 结论
a)以丙烯酸、丙烯酰胺及改性蒙脱土为原料,纳米腐植酸为基体,N,N’-亚甲基双丙烯酰胺为交联剂,过二硫酸钾为引发剂,用水溶液聚合法制备了纳米腐植酸基复合树脂。在吸附温度为35 ℃、吸附时间为90 min、溶液pH为7、初始Ni2+和Cd2+的浓度分别为0.02 mol/L、复合树脂加入量为16.7 g/L的条件下, Ni2+和Cd2+的吸附量分别为383.02 mg/g和359.27 mg/g。
b) 复合树脂吸附Ni2+和Cd2+的吸附等温线均满足Langmuir等温吸附方程,吸附过程均为单分子层吸附,且复合树脂表面各处的吸附能力相同;复合树脂对Ni2+和Cd2+的吸附过程均符合准二级吸附动力学方程,吸附的主要控制步骤均为液膜扩散。
c) 经过6次的重复使用,复合树脂对Ni2+和Cd2+的吸附量分别降低了17.1%和9.3%,解吸再生和重复使用性能较好。
[1] Humood A N. Assessment and Management of Heavy Metal Pollution in the Marine Environment of the Arabian Gulf:A Review[J]. Mar Pollut Bull,2013,34(72):6 - 13.
[2] Wang Xueshi. Assessment of Heavy Metal Pollution in Xuzhou Urban Top-Soils by Magnetic Susceptibility Measurements[J]. Ecotoxicol Environ Saf,2013,56(92):76 - 83.
[3] 程亮,张保林,侯翠红,等. 高剪切条件下纳米腐植酸的制备与表征[J]. 化工学报,2012,63(8):2648 - 2654.
[4] 程亮,张保林,徐丽,等. 纳米腐植酸热分解动力学[J]. 化工学报,2014,65(9):3470 - 3478.
[5] 程亮,侯翠红,刘国际,等. 纳米腐植酸对镉离子的吸附热力学及动力学[J]. 高校化学工程学报,2015,29(1):72 - 77.
[6] 程亮,徐丽,刘伟,等. 超声作用联合纳米腐植酸处理苯酚废水[J]. 化学工程,2014,42(9):6 - 12.
[7] Zheng Yuqiang,Xiong Chunhuan,Yao Caiping,et al. Adsorption Performance and Mechanism for Removal of Cd(Ⅱ) from Aqueous Solutions by D001 Cation-Exchange Resin[J]. Water Sci Technol,2014,69(4):833 - 839.
[8] Xiong Chunhua. Adsorption of Cadmium (Ⅱ) by Chitin[J]. J Chem Soc Pak,2010,32(4):429 - 435.
[9] Xiong Chunhua,Yao Caiping. Ion Exchange Recovery of Nickel(Ⅱ) on Macroporous Weak Acid Resin(D151 Resin)[J]. Indian J Chem Technol,2011,18(1):13 - 20.
[10] Xiong Chunhua,Pi Leilei,Chen Xinyi,et al. Adsorption Behavior of Hg2+in Aqueous Solutions on a Novel Chelating Cross-Linked Chitosan Microsphere[J]. Carbohydr Polym,2013,98(1):1222 - 1228.
[11] Muniyappan R G,Natrayasamy V,Sankaran M. Adsorption Mechanism of Hexavalent Chromium Removal Using Amberlite IRA 743 Resin[J]. Ion Exch Lett,2010,78(3):25 - 35.
[12] Pang Siu kwong,Yung Kam Chuen. Chelating Resin for Removal of Nickel Impurities from Gold Electroplating Solutions[J]. Ind Eng Chem Res,2013,52(6):2418 - 2424.
[13] Lagergen S. About the Theory of So-Called Adsorption of Soluble Substance[J]. Chem Eng J,1998,24(4):31 - 39.
[14] Kanan N,Sundaram M M. Kinetics and Mechanism of Removal of Methylene Bule by Adsorption on Various Carbons—A Comparative Study[J]. Dyes Pigm,2001,51(7):25 - 40.
[15] Ho Y S,McKay G. Sorption of Dye from Aqueous Solution by Peat[J]. Chem Eng J,1998,70(12):115 -124.
(编辑 王 馨)
Preparation of Nanoscale Humic Acid Based Composite Resin and Adsorption of Ni2+and Cd2+
Cheng Liang,Xu Li,Hou Cuihong,Luo Tingliang,Zhang Baolin,Liu Guoji
(School of Chemical Engineering and Energy,Zhengzhou University,Zhengzhou Henan 450001,China )
The acrylic acid-montmorillonite-acrylamide/nano humic acid composite resin was prepared by aqueous solution polymerization method,using acrylic acid,acrylamide and modified Montmorillonite as raw material,nano humic acid as matrix,N,N’-methylenebis(2-propenamide) as crosslinking agent and potassium persulfate as initiator. The factors affecting the adsorption of Ni2+and Cd2+were studied. The experimental results showed that:Under conditions of adsorption temperature 35 ℃,adsorption time 90 min,solution pH 7,initial Ni2+concentration 0.02 mol/L,initial Cd2+concentration 0.02 mol/L and composite resin dosage 16.7 g/L,the adsorption quantity of Ni2+and Cd2+are 383.02 mg/g and 359.27 mg/g,respectively;The adsorption isotherm of Ni2+and Cd2+follows Langmuir isothermal equation;Both of the adsorption processes f t pseudo-second order kinetic model;After reused for 6 times,the adsorption capacity of the composite resin to Ni2+and Cd2+decreases 17.1% and 9.3%,respectively.
nanoscale humic acid;composite resin;aqueous solution polymerization method;static adsorption;adsorption isotherm;adsorption kinetic model
TQ536.9
A
1006-1878(2015)06-0640-05
2015 - 06 - 28;
2015 - 08 - 12。
程亮(1986—),男,河南省林州市人,博士生,电话 13837168577,电邮 chengliang627@163.com。联系人:刘国际,电话 0371 - 67781713,电邮 guojiliu@zzu.edu.cn。
河南省科技厅基础与前沿项目(2011A530008);郑州大学优秀博士学位论文培育基金项目(20131131)。
