老年脑卒中后抑郁与血管事件的相关性分析
2015-04-24陈文权高社荣
梁 晨,陈文权,高社荣
脑卒中后抑郁 (PSD)是常见的脑血管并发症之一,是由脑卒中导致的继发性的以情绪低落、兴趣下降、绝望、睡眠障碍、焦虑及躯体化症状为主要临床表现的焦虑抑郁症。有研究报道,PSD发病率为20%~80%,且与多种因素有关[1]。本研究旨在探讨PSD相关因素及其与随访期血管事件的关系,为脑卒中患者临床治疗和改善预后提供依据。
1 资料与方法
1.1 临床资料 选取2011年7月—2014年4月兵团七师医院神经内科收治的326例老年脑卒中患者为研究对象,其中男222例,女104例;年龄61~91岁,平均(69.7±6.4)岁;脑出血68例,脑梗死258例。患者均符合中华医学会第4次全国脑血管病学术会议修订的脑卒中诊断标准,并经颅脑CT或MRI检查证实。排除标准:(1)严重的痴呆、失语、意识障碍及因视力、听力障碍无法配合检查者;(2)合并严重心、肺、肝、肾功能不全等疾病者;(3)因认知功能障碍 (入院第3~7天简易精神状态检查量表评分≤27分)无法进行调查者。
1.2 研究方法
1.2.1 临床资料收集 入院后询问患者一般情况,包括既往吸烟、饮酒史,有无高血压、糖尿病、冠心病病史。24 h内行实验室检查,记录血脂、同型半胱氨酸(Hcy)、C反应蛋白 (CRP)水平。
1.2.2 神经心理学评估 入院24 h内采用美国国立卫生研究院卒中量表 (NIHSS)评定神经功能缺损程度。对出现PSD症状 (参考中国精神疾病诊断标准第3版)的患者于入院第3、7、14天以汉密尔顿抑郁量表(HAMD)24项版进行测评,若其中一次评分≥8分,则于2周后复评,复评得分≥8分者诊断为PSD,并据此将患者分为PSD组 (83例)和非PSD组 (243例)。
1.2.3 血管事件 对患者进行随访,观察血管事件的发生情况,包括脑出血、脑梗死、短暂性脑缺血发作(TIA)、心肌梗死及其他血管事件 (如肺栓塞等),并记录由上述血管事件引发的死亡。随访时间自患者纳入研究至2014年7月。
1.3 统计学方法 采用SPSS 17.0统计软件包进行处理,计数资料以相对数表示,组间比较采用χ2检验;符合正态分布的计量资料以±s)表示,组间比较采用t检验,不符合正态分布的计量资料以中位数 (四分位数间距)〔M(QR)〕表示,采用非参数Wilcoxon秩和检验;采用Logistic回归分析血管事件的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 PSD组高血压、糖尿病、冠心病患病率高于非PSD组 (P<0.05),PSD组NIHSS评分高于非PSD组,差异有统计学意义 (P<0.001)。两组性别、年龄、吸烟史、饮酒史、总胆固醇 (TC)、三酰甘油 (TG)、高密度脂蛋白胆固醇 (HDL-C)、低密度脂蛋白胆固醇 (LDL-C)、Hcy、CRP和脑卒中类型比较,差异无统计学意义 (P>0.05,见表1)。
2.2 血管事件发生情况 随访结束时,PSD组发生血管事件14例,其中脑出血2例,脑梗死6例,TIA 4例,心肌梗死1例,死亡1例;非PSD组发生血管事件20例,其中脑出血1例,脑梗死9例,TIA 5例,心肌梗死2例,肺栓塞1例,死亡2例。PSD组血管事件发生率为16.9%,高于非PSD组的8.2%,差异有统计学意义 (χ2=4.374,P <0.05)。
2.3 多因素Logistic回归分析 以是否发生血管事件为因变量,以性别、年龄、高血压、糖尿病、冠心病、血脂、NIHSS评分和PSD为自变量 (见表2)行多因素Logistic回归分析。结果显示,糖尿病、血脂和PSD进入回归方程,是血管事件发生的危险因素 (P<0.05,见表3)。
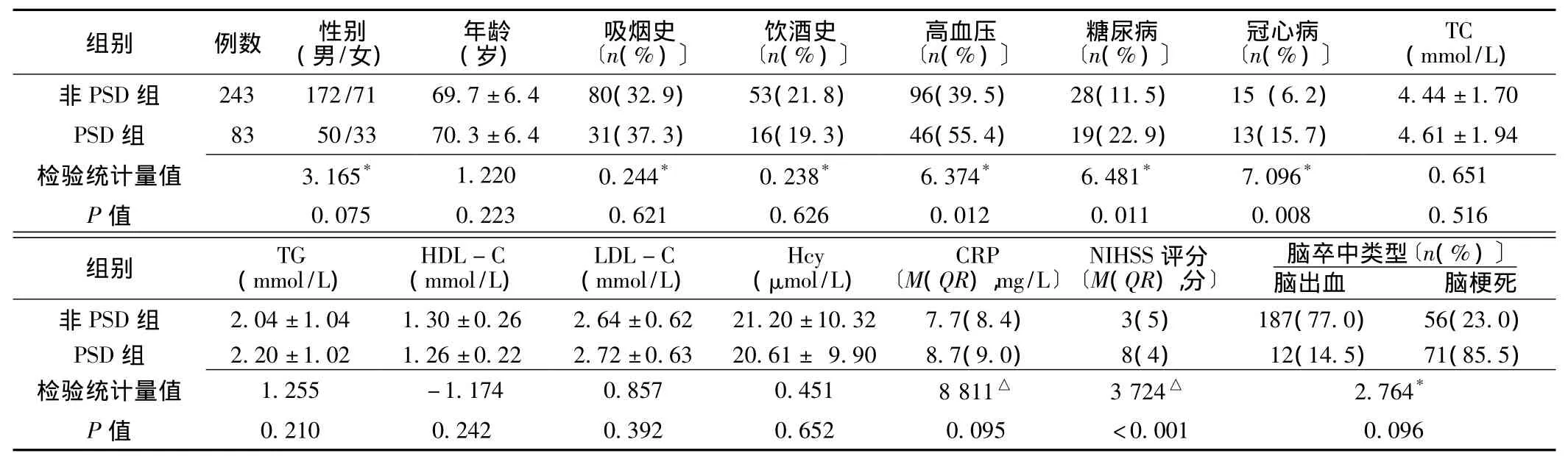
表1 两组一般资料比较Table1 Comparison of general data between the two groups

表2 血管事件发生影响因素的多因素Logistic回归分析变量赋值表Table 2 Variable assignment ofmultivariate Logistic regression analysis on influencing factors for vascular events

表3 血管事件发生影响因素的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis on influencing factors for vascular events
3 讨论
单小英等[2]研究显示,老年脑血管病患者更易发生PSD。本研究326例老年脑卒中患者1个月内PSD的发生率为25.5%(83/326)。因本院老年脑卒中患者多为农场退休职工,经济水平相近,文化水平以初中以下者居多,且生活相对稳定,家庭支持度差别不大,故患者间上述因素的变异较小,而脑卒中及其合并症、实验室检查指标等对PSD的发生有较大影响。老年人退休后社会认同感下降,生活目标降低,最关注身体健康及生活质量,一旦出现脑血管疾病,更易产生对家庭的拖累感及对死亡的恐惧感,严重者出现性格改变及行为异常,如得不到家庭及社会的理解,更易发生焦虑抑郁。本研究旨在发现老年PSD发生的相关因素,并通过对患者随访,以期发现发生血管事件的危险因素。
本研究显示PSD组高血压、糖尿病、冠心病患病率高于非PSD组。长期高血压可引起脑动脉硬化,易早期出现脑小血管病变,一旦发生急性脑卒中更易引发情感调节功能障碍从而并发PSD[3]。糖尿病也可使PSD发病风险增高,Alexopoulos等[4]于1997年首次提出血管性抑郁症的概念,认为血管病变影响大脑神经调节,导致器质性情感障碍,而糖尿病是最易引起脑部血管病变的疾病。冠心病患者心脏功能与脑部供血紧密相连,心脏疾病可加重颅内缺血,导致身体不适,加重焦虑抑郁的发生。Herrmann等[5]报道神经功能缺损程度与PSD相关,本研究提示PSD组NIHSS评分较高,说明患者神经功能缺损越重,日常生活能力越差,对患者产生较大心理影响。
涂文军等[6]报道,PSD程度不同,血清Hcy水平不同,并随病情加重而升高。单培佳等[7]报道,脑卒中后的炎性因素参与了PSD的发生,急性脑卒中后炎性细胞因子过度表达,激活下丘脑-垂体-肾上腺轴,引起体内某些激素水平增高,导致炎性过程增强和吲哚胺2,3双加氧酶 (IDO)的广泛激活,5-羟色胺 (5-HT)大量消耗,引起相应情绪和行为的改变。曹春艳等[8]认为脑卒中患者血清CRP升高与PSD的发生有密切关系,CRP是反映炎性反应的指标,并可作为预测脑卒中患者严重程度的一项重要指标。本研究发现,两组Hcy与CRP水平无明显差异,与上述研究结果不一致,可能与两组例数差距较大、均衡性较差有关。
国外学者曾就PSD对老年脑血管病预后的影响进行10年随访调查,发现PSD患者较非PSD患者死亡率高3.4倍,其不良预后的发生率也较高[9]。本研究显示PSD组患者血管事件的发生率高于非PSD组,表明并发PSD者发生血管事件的风险较非PSD者高。多因素Logistic回归分析显示,PSD是随访期发生血管事件的独立危险因素,并发PSD者血管事件发生风险是非PSD者的4.592倍。PSD者情绪不稳定,影响血压、血糖的稳定性,加重血管损害,引起不良预后的发生。同时,糖尿病、血脂也是血管事件发生的独立危险因素。糖尿病易引起全身血管病变,而血脂异常可加重动脉硬化、脂质斑块沉积及血液黏稠度增高,使血管事件发生的风险加大。因此发生脑卒中后应将血糖、血脂控制在理想水平,对于合并PSD者应进行心理干预及药物治疗,以期防止不良预后的发生。
综上所述,老年脑卒中患者合并高血压、糖尿病、冠心病或神经功能缺损严重易并发PSD,糖尿病、血脂、PSD是随访期血管事件发生的独立危险因素。由于随访时间有限,颅内外血管狭窄程度、冠状动脉病变等也可影响研究的结果,在今后研究中可延长随访时间并纳入其他可能的影响因素。
[1] Robinson RG,Spalletta G.Poststroke depression:a review [J].Can JPsychinatry,2010,55(6):341-349.
[2] Shan XY,Shi QY,Sun HF,et al.Clinical research of the relationship between post-stroke depression and the region of brain injury[J].Journal of Apoplexy and Nervous Diseases,2012,29(1):53-55.(in Chinese)单小英,石秋艳,孙惠芳,等.卒中后抑郁与脑损伤部位相关性的临床研究[J].中风与神经疾病杂志,2012,29(1):53 -55.
[3] Nemeroff CB,Owens MJ.The role of serotonin in the pathophysiology of depression:as important as ever[J].Clin Chem,2009,55(8):1578-1579.
[4] Alexopoulos GS,Meyers BS,Young RC,et al.Clinically defined vascular depression [J].Am J psychiatry,1997,154(4):562-565.
[5] Herrmann N,Black SE,Lavence J,et al.The sunnybrook stroke study a prospective study of depressive symptoms and functioned outcome[J].Stroke,1998,29(3):618-624.
[6] Tu WJ,Shi XD,Zhang WJ,et al.A study on homocysteine of patients with post-stroke depression[J].Journal of Apoplexy and Nervous Diseases,2011,28(9):840 -841.(in Chinese)涂文军,史晓东,张文娟,等.脑卒中后抑郁患者血清同型半胱氨酸水平研究[J].中风与神经疾病杂志,2011,28(9):840-841.
[7] Shan PJ,Zhou YQ,Bi XY,et al.Risk factors and mechanisms of post-stroke depression[J].International Journal of Cerebrovascular Diseases,2012,20(12):939 -942.(in Chinese)单培佳,周颖奇,毕晓英,等.卒中后抑郁的危险因素和机制[J].国际脑血管病杂志,2012,20(12):939-942.
[8] Cao CY,Huang CY.Relationship between serum level of C-reactive protein and post-stroke depression[J].Medical Journal of Wuhan Uunversity,2011,32(3):411 -413.(in Chinese)曹春艳,黄朝云.脑卒中后抑郁与血清超敏C-反应蛋白的关系[J].武汉大学学报:医学版,2011,32(3):411-413.
[9] Terroni L,Amarro E,Iosifescu DV,et al.Stroke lesion in cortical neural circuits and post-stroke incidence ofmajor depressive episode:a 4-month prospective study[J].World JBiol Psychiatry,2011,12(7):539-548.
