5-羟色胺在双层纳米金修饰电极上的电化学行为及测定研究
2015-04-23牛凌梅连靠奇马莉康维钧
牛凌梅,连靠奇,马莉,康维钧
(河北医科大学公共卫生学院,石家庄 050017)
5-羟色胺(5-hydroxytryptamine,5-HT)亦称血清素(Serotoin),是色氨酸代谢产物。色氨酸在组织中经过色氨酸羟化酶和5-羟色氨酸脱羧酶的作用生成5-羟色胺,又经单胺氧化酶作用生成5-羟色醛;进一步氧化成5-羟吲哚乙酸[1]。5-羟色胺是人体内重要的神经递质,其参与睡眠、摄食、体温、学习、记忆等多种生理过程。中枢神经系统5-HT含量异常与重性抑郁障碍和自杀行为有着极其重要的联系,同时也可以影响血脑屏障通透性的改变[2]。因此,建立一种快速、灵敏检测5-HT的方法尤为重要。
目前,测定5-HT含量的方法有很多,例如:免疫法[3,4]、荧光法[5]、高效液相色谱法[6-8]、电化学方法[9,10]等。在纳米金的组装过程中,常用巯基修饰的DNA来承载纳米金,本文则利用番红花红聚合膜和含有连续腺嘌呤模块的DNA来固定双层纳米金(GNPs),用此复合膜修饰的玻碳电极来测定5-羟色胺,建立了定量测定5-羟色胺的新方法。
1 材料与方法
1.1 试剂
番红花红(SFR)购于上海化学试剂有限公司;5-HT(Fluka公司)储备液:0.01mol/L;氯金酸购于国药化学试剂有限公司;不同碱基序列的DNA购于上海生工生物工程公司(0.1 mol/L),碱基序列如下。实验中使用二次水,其它试剂均为分析纯。所有实验均在室温下进行(约为25℃)
ss-DNA (1): 5'-AAA TAC GCC ACC AGC TCC-3'
互补 ss-DNA (2): 5'-AAA GGA GCT GGT GGC GTA-3'
ss-DNA (3): SH-5'-TAC GCC ACC AGC TCC-3'
互补 ss-DNA (4): SH -5' -GGA GCT GGT GGC GTA-3'
1.2 仪器
CHI440C(上海辰华仪器有限公司);电极采用三电极系统:铂丝为对电极,Ag/AgCl电极为参比电极,工作电极为裸玻碳电极(GCE)或纳米金修饰的玻碳电极。所有电位均相对于 Ag/AgCl参比电极而言。
1.3 纳米金修饰电极的制备
将裸玻碳电极置于Al2O3粉末的悬浆之中进行打磨至镜面,取出,依次用1:1的HNO3、1:1的丙酮、二次蒸馏水,各超声清洗5分钟,氮气吹干。参照文献[11],将聚番红花红修饰好的电极(GCE/poly(SFR))浸入到纳米金溶液中10 h,取出,用蒸馏水冲洗干净,得到单层纳米金修饰电极(GCE/poly(SFR)/GN)。再将此电极浸入预先杂交好的DNA(由ss-DNA (1)和与其互补的ss-DNA (2) 47℃杂交1小时)溶液中2 h,取出,冲洗干净,即为DNA纳米金修饰电极(GCE/poly(SFR)/GN/DNA)。最后,将此修饰电极再次浸入到纳米金溶液中2 h,取出,即可制得双层三维分布的纳米金修饰传感器(GCE/poly(SFR)/GN/CA DNA/GN)。巯基DNA由ss-DNA (3)和ss-DNA (4) 杂交制备,其余同上。
2 结果与讨论
2.1 GCE/poly(SFR)/GN/CA DNA/GN对5-HT的电催化作用
利用循环伏安法研究了5-HT在裸玻碳及修饰电极上的电化学响应。由图1可看出,在裸玻碳电极(a)表面,5-HT氧化峰电流为3.59×10-6A。而在CA DNA承载的双层纳米金修饰的玻碳电极(b)表面,5-HT峰电流却大大增加(1.832×10-5A)。相对比的,在巯基DNA承载纳米金修饰的玻碳电极表面(c),峰电流为(1.588×10-5A)。这是因为,有报道称连续的腺嘌呤碱基与纳米金的亲和力与金硫键相当,且能够使吸附的DNA更加有序。因此,有序的DNA必将承载更多的纳米金,而纳米金是电子的良导体,能够加速电子的传递,结果必然使得5-HT的氧化变得更加容易,峰电流大大提高。

图1裸玻碳电极(a)、GCE/poly(SFR)/GN/CA DNA/GN(b)和GCE/poly(SFR)/GN/巯基DNA/GN(c)在5-HT溶液中的循环伏安伏安曲线;5-HT浓度:1.0×10–6 mol/L;pH 7.5。Fig. 1CVs at bare GC electrode (a), GCE/poly(SFR)/GN/CA DNA/GN(b)and GCE/poly(SFR)/GN/mercapto DNA/GN(c)in the 5-HT solution; Concentration: 1.0×10–6 mol/L; pH 7.5.
2.2 纳米金修饰膜引起5-HT氧化电流的升高
本实验研究了各层修饰膜对5-HT测定的影响。随着在纳米金溶液中浸泡时间的延长,所吸附的纳米金亦随之增加。结果,由于修饰电极对5-HT的氧化能力逐渐增加而导致了5-HT在此修饰电极上的氧化电流也随之增大。但当时间超过10h后,氧化电流趋于平缓(1.3×10-5A),说明吸附的纳米金已趋于饱和。因此,选用10h作为第一次纳米金的浸泡时间。但由于DNA对5-HT的氧化没有电催化能力,故随着在DNA中浸泡时间的延长,5-HT的氧化峰电流随之降低。在浸泡1.8h后,DNA吸附达到了饱和,因此选用1.8 h作为DNA的浸泡时间。虽然此时DNA修饰的电极有最低的电催化活性,但它却可以吸附最多的纳米金。随着再次浸入纳米金溶液时间的延长,5-HT的氧化峰电流又继续上升,直至浸泡2.0 h后趋于饱和,从而达到5-HT的最大氧化峰电流(1.8×10-5A)。相对于单层纳米金修饰的电极,其电流增长了38 %。各层膜浸泡时间对测定结果的影响如图2所示。
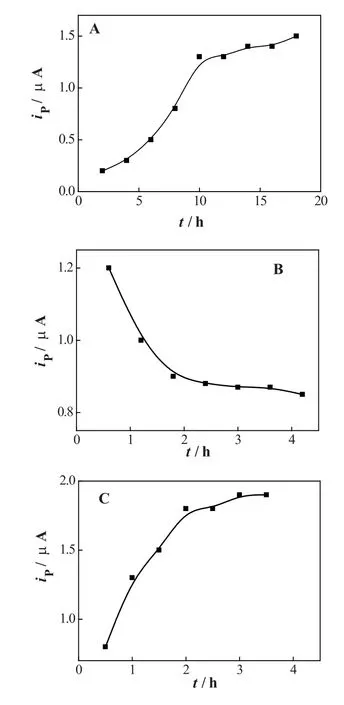
图2各层修饰膜浸泡时间对5-HT测定的影响A:第一层纳米金膜;B:CA DNA修饰膜;C:第二层纳米金膜;5-HT浓度:1.0×10–6 mol/L。Fig. 2Effect of accumulation time of each layer on the determination of 5-HT; a: the fi rst layer of GNPs; b: CA DNA monolayer; c: the second layer of GNPs; 5-HT concentration: 1.0×10–6 mol/L.
2.3 溶液pH值对5-HT测定的影响
在不同pH值的磷酸缓冲溶液中研究了支持电解质对5-HT测定的影响(图3)。结果发现,5-HT的氧化峰随着溶液pH值的增加而逐渐增加,并在pH 7.5处达到最大值,之后逐渐减小。故本实验中选用pH 7.5缓冲溶液作为支持电解质。
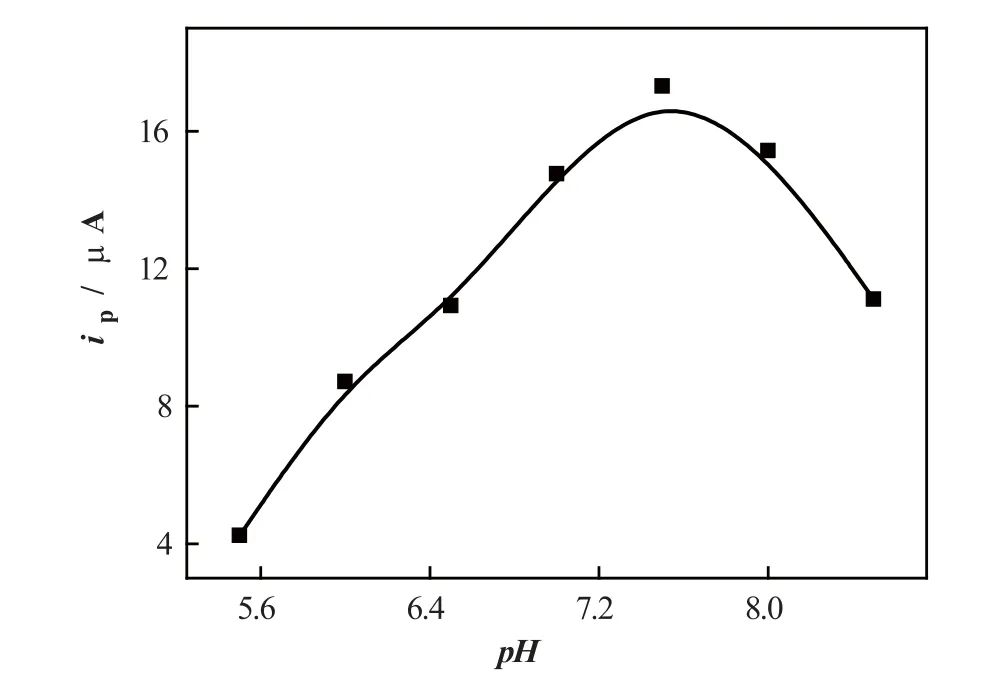
图3不同pH缓冲溶液对于5-HT测定的影响5-HT:1.0×10–6 mol/L。Fig.3Effect of pH on the determination of 5-HT. Concentration of 5-HT: 1.0×10–6 mol/L.
2.4 poly(SFR)/GN/CA DNA/GN修饰电极的稳定性
在1.0×10-6mol/L的5-HT溶液中考察了纳米金修饰电极的稳定性。20次连续测定之后,5-HT峰电流的改变在4 %之内,将此修饰电极置于磷酸缓冲溶液(pH 7.0)中60天后,仍保留90 %的电催化活性。电极活性随时间变化如图4所示。

图4电极活性随时间的变化曲线Fig.4Variation of the electroactivity of electrode with time.
2.5 干扰物测定
研究了各种干扰物对浓度为1.0×10-6 mol/L 5-HT测定的影响。在相对误差5.0 %的限度之内,500倍的Na+、K+、Mg2+、Ca2+、Cl-,50倍的L-赖氨酸、葡萄糖、20倍的谷氨酸、甘氨酸、胱氨酸对于测定不产生干扰,说明此修饰电极有很好的选择性。各种干扰物存在下,5-HT所测的相对误差如表1中所示。

表1各种干扰物对5-羟色胺测定结果的影响Tab. 1Effects of interferents on the determination of 5-HT
2.6 分析应用
利用循环伏安法(CV)研究了5-HT在GCE/poly(SFR)/GN/CA DNA/GN修饰电极上的线性关系(图5)。发现5-HT的氧化峰电流在6.0×10-8mol/L ~ 1.0×10-6mol/L范围内均随着其浓度的增加而线性增加,检出限达到2.0×10-9mol/L。其线性方程为ip= 2.2715 + 16.6543C ( r: 0.9970, C:10-6mol/L,ip:10-6A)。利用此电极对血液样品(采自河北医科大学校医院)中的5-羟色胺进行了测定。将全血离心分离,取上清液,初始含量未知。将此样品平行测定四次,第一次不加标准品,测定结果为0.42μmol/L,此含量作为血清样品中的初始量。其余三次,向样品中分别加入标准品的量为0.10, 0.30,0.50μmol/L进行测定,所测标准品的加标回收率在80%~100%之间。结果如表2中所示。

图55-HT不同浓度的循环伏安曲线;5-HT浓度(10–6 mol/L):(1)0.06 (2) 0.07 (3) 0.08 (4) 0.2 (5) 0.3 (6) 0.4 (7) 0.6 (8) 0.8 (9) 1.0。Fig. 5 CVs of 5-HT at different concentrations. Concentration of 5-HT (10–6 mol/L): (1) 0.06 (2) 0.07 (3) 0.08 (4) 0.2 (5) 0.3 (6) 0.4 (7)0.6 (8) 0.8 (9) 1.0.

表2血液样品中不同浓度5-羟色胺的测定结果Tab. 2Results for the determination of 5-HT in human serum
结论
本文组装了含有连续腺嘌呤碱基模块的DNA(CA DNA)——双层纳米金修饰的玻碳电极,并利用此修饰电极对5-HT的电化学氧化过程进行了研究,发现此修饰电极能起到明显的电催化作用。在此基础上考察了各修饰层膜的修饰时间,支持电解质等对5-HT的测定影响。此修饰电极稳定性好,选择性高,已用于实际样品的测定,收到满意的效果。
[1] 周翔, 辛中国, 孙国光. 血清5-羟色胺的测定及其意义[J]. 白求思医科大学学报, 1984, 10(1): 1-5.
[2] 张远冬, 张有金, 郭延垒, 等. HPLC-UV法测定大鼠脑组织中5- 羟色胺含量[J]. 中国现代药物应用, 2012, 6(21): 14-16.
[3] 黄建国, 陆世华, 王晓春. 酶免试验法测定全血5-羟色胺[J].临夏医学杂志, 2002,24( 9) : 545-546.
[4] 李建刚, 张巧俊, 高敬龙, 等. 脑卒中后抑郁患者5-羟色胺含量的研究[J].中国临床神经科学,2007, 15( 2) : 129-132.
[5] 张秀明, 顾仁俊, 张中兴, 等. 荧光分光光度法测定血清5-羟色胺的实验研究及临床应用[J]. 陕西医学检验, 2009, 9( 1) : 14-16.
[6] 鲁燕侠, 崔佳蔺, 兴谣, 等. RP-HPLC-荧光检测法测定小鼠脑组织中 5 种神经递质的含量[J].解放军药学学报, 2003, 19( 4) : 262.
[7] Mu S, Li Y, Tang A G,et al.Simultaneous determination of tyrosine,tryptophan and 5-hydroxytryptamine in serum of MDD patients by high performance liquid chromatography with fluorescence detection [J]. Clin Chim Acta, 2012, 413(11-12): 973-977.
[8] Zhen Q N, Xu B, Ma L,et al.Simultaneous determination of tryptophan, kynurenine and 5-hydroxytryptamine by HPLC:Application in uremic patients undergoing hemodialysis [J]. Clin Biochem, 2011, 44(2-3): 226-230.
[10] Hu L, Wang Q, Qin Z,et al.Detection of 5-hydroxytryptamine (5-HT) in vitro using a hippocampal neuronal network-based biosensor with extracellular potential analysis of neurons. Biosens Bioelectro,2015, 66: 572-578.
[11] Niu LM, Lian KQ, Kang W J,et al.Characterization of Poly(Safranine T)-Modified Electrode and Application for Simultaneous Determination of Epinephrine and Uric Acid Coexisting with Ascorbic Acid[J]. J Braz Chem Soc, 2011, 22(2):204-210.
