新型苦参碱衍生物的合成*
2015-04-23梁鹏云周艳玲周永红蒋敏捷王立升
梁鹏云,刘 旭,张 敏,周艳玲,周永红,蒋敏捷,王立升
(广西大学化学化工学院,广西南宁 530004)
苦参碱(1)是中药苦参的主要活性成分之一,其生理活性主要包括清热解毒、消肿利咽、抗肿瘤和抗心律失常等。然而1较低的生物利用度和对中枢神经系统有毒副作用等缺点限制了其临床应用[1-3]。
取代哌嗪类化合物,如N-芳基哌嗪和N,N'-二芳基哌嗪等,虽具有较好的抗癌活性[4-5],但也具有一定毒副作用。
1属于四环喹嗪啶类化合物,其分子骨架可视作两个喹嗪啶环稠合体,可修饰部位少,通常需先将1水解为苦参酸,产生两个可修饰部位[6-7],再根据基团拼合原理进行结构扩展。
基于此,本文以1为原料,经内酰胺水解,酯化和氯代3步反应合成了关键中间体——16-N-(氯乙酰基)-苦参酸酯(5);5分别与N-苯基哌嗪衍生物(6a~6c,6e和6f)反应合成了8个新型的苦参碱衍生物(7a~7h),其结构经1H NMR,IR和ESI-MS表征。
1 实验部分
1.1 仪器与试剂
X-4型熔点仪(温度未校正);Bruke 600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);FIIR-8400S型傅立叶变换红外光谱仪(KBr压片);Agilent-6330 IonTrap型质谱仪。
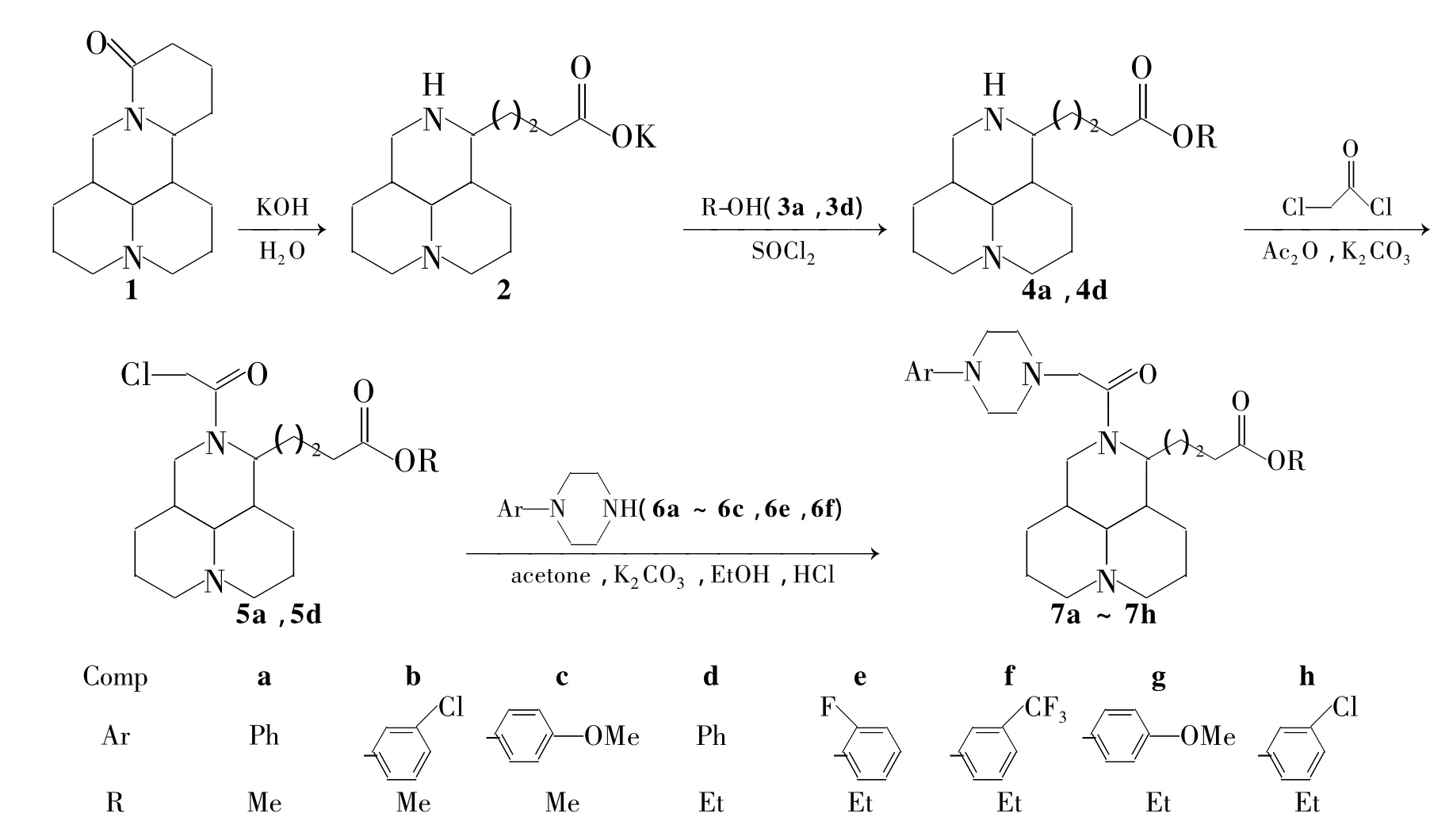
Scheme 1
1,纯度98%;其余所用试剂均为分析纯。
1.2 合成
(1)苦参酸钾(2)的合成
在圆底烧瓶中依次加入 1 10.0 g(40.3 mmol),氢氧化钾 42.0 g(0.75 mol)和水120 mL,搅拌下回流(120℃)反应12 h。冷却至室温,抽滤,滤饼干燥得白色固体2,产率86%。2无需纯化,直接用于下一步反应。
(2)4a和4b的合成(以4a为例)
冰浴冷却,在圆底烧瓶中加入甲醇60 mL,搅拌下缓慢滴加二氯亚砜6 mL,滴毕,反应0.5 h;缓慢滴加10%2的甲醇(40 mL)溶液,滴毕,反应0.5 h;回流(60℃)反应3 h。旋蒸除溶,残余物依次加入氯仿50 mL和碳酸氢钠4.0 g,于室温搅拌0.5 h。过滤,滤液旋除有机溶剂得白色固体4a,产率 82%;1H NMR δ:1.37 ~1.46(m,3H),1.48 ~ 1.68(m,7H),1.73 ~ 1.80(m,1H),2.83 ~2.03(m,3H),2.14(s,1H),2.29 ~2.44(m,3H),2.73 ~3.79(m,2H),3.03 ~3.06(dd,J=4.2 Hz,12.0 Hz,1H),3.41(t,J=12.6 Hz,1H),3.56 ~ 3.62(m,1H),3.64(s,3H);IR ν:3 474,2 942,1 728,1 440,1 397 cm-1;ESI-MS m/z:279[M -H]。
以乙醇替代甲醇,用类似的方法合成白色固体4b。
(3)5a和5d的合成(以5a为例)
在反应瓶中依次加入 4a 3.56 g(10.0 mmol),碳酸钾3.10 g(30.1 mmol),水 300 mL 和乙酸乙酯60 mL,搅拌使其溶解;于室温缓慢滴加氯乙酰氯2.24 g(20.0 mmol),滴毕,反应3 h。静置分层,有机层旋干溶剂得黄色油状液体5a(直接用于下一步反应)。
以4d替代4a,用类似的方法合成白色固体5d。
(4)7a~7e的合成(以7a为例)
在反应瓶中加入5a 1.78 g(5.0 mmol),N-苯基哌嗪(6a)0.81 g(5.0 mmol)和丙酮 60 mL,搅拌使其溶解;搅拌下加入碳酸钾1.0 g(10.0 mmol),于60℃反应8 h。抽滤,滤液浓缩后经硅胶柱层析[洗脱剂:V(乙酸乙酯)∶V(甲醇)=9∶1]纯化得黄色油状物,加入约5 mL盐酸-乙醇饱和溶液,旋干溶剂得淡黄色粉末7a。
分别以6b和6c替代6a,用类似的方法合成淡黄色粉末7b和7c;以5d替代5a,6d~6h替代6a,用类似的方法合成了淡黄色粉末7d~7h。
7a:产率 68%,m.p.190℃ ~193℃;1H NMR δ:1.34 ~ 1.81(m,12H),1.98 ~ 2.14(m,1H),2.28(t,J=6.6 Hz,2H),2.35 ~2.47(m,1H),2.70 ~2.92(m,2H),3.03 ~3.78(m,16H),3.99 ~4.13(m,1H),4.16 ~4.25(m,1H),4.34 ~4.45(m,1H),6.97 ~7.12(m,3H),7.30(t,J=6.5 Hz,1H);IR ν:3 415,2 956,2 854,1 723,1 657,1 456,1 384,1 261,1 020,748,681 cm-1;ESI-MS m/z:493{[M+H]+}。
7b:产率 71%,m.p.189℃ ~191℃;1H NMR δ:1.34 ~ 1.86(m,12H),2.00 ~ 2.13(m,1H),2.32(t,J=6.6 Hz,2H),2.36 ~2.48(m,1H),2.71 ~2.93(m,2H),3.04 ~3.77(m,16H),4.02(q,J=7.2 Hz,2H),4.02 ~4.12(m,1H),4.14 ~ 4.23(m,1H),4.31 ~4.43(m,1H),6.91(t,J=7.2 Hz,2H),6.94 ~7.05(m,1H),7.21(t,J=8.1 Hz,1H);IR ν:3 424,2 939,2 858,1 719,1 657,1 461,1 387,1 269,1 021,757,691 cm-1;ESI-MS m/z:517{[M+H]+}。
7c:产率 63%,m.p.188℃ ~191℃;1H NMR δ:1.37 ~ 1.83(m,12H),2.01 ~ 2.13(m,1H),2.29(t,J=6.6 Hz,2H),2.37 ~2.49(m,1H),2.72 ~2.92(m,2H),3.07 ~3.28(m,3H),3.32 ~3.39(m,1H),3.45 ~3.64(m,12H),3.70(s,3H),4.04 ~4.13(m,1H),4.18 ~ 4.28(m,1H),4.35 ~ 4.46(m,1H),6.93(d,J=9.3 Hz,2H),7.15(d,J=9.0 Hz,2H);IR ν:3 427,2 912,2 836,1 723,1 629,1 465,1 282,1 233,1 025,851 cm-1;ESI-MS m/z:513{[M+H]+}。
7d:产率 56%,m.p.190℃ ~192℃;1H NMR δ:1.08(t,J=7.2 Hz,3H),1.33 ~1.84(m,12H),1.96 ~2.12(m,1H),2.26(t,J=6.6 Hz,2H),2.32 ~2.47(m,1H),2.69 ~2.92(m,2H),3.02 ~ 3.23(m,3H),3.27 ~3.71(m,10H),3.90(q,J=7.2 Hz,2H),4.03~4.06(m,1H),4.14 ~ 4.26(m,1H),4.34~4.46(m,1H),6.96 ~ 7.02(m,1H),7.07(d,J=8.7 Hz,1H),7.30(t,J=7.2 Hz,1H);IR ν:3 412,2 955,2 860,1 722,1 662,1 472,1 274,1 042,740,688 cm-1;ESI-MS m/z:497{[M+H]+}。
7e:产率 56%,m.p.189℃ ~192℃;1H NMR δ:1.11(t,J=7.2 Hz,3H),1.36 ~1.84(m,12H),1.99 ~2.13(m,1H),2.28(t,J=6.6 Hz,2H),2.37 ~2.48(m,1H),2.73 ~2.92(m,2H),3.05 ~3.75(m,13H),4.01(q,J=7.2 Hz,2H),4.07 ~4.13(m,1H),4.17 ~4.28(m,1H),4.35 ~ 4.44(m,1H),7.01 ~7.45(m,4H);IR ν:3 404,2 930,2 843,1 722,1 654,1 464,1 274,1 093,748 cm-1;ESI-MS m/z:515{[M+H]+}。
7f:产率 66%,m.p.184℃ ~188℃;1H NMR δ:1.12(t,J=7.2 Hz,3H),1.42 ~1.86(m,12H),2.01 ~2.15(m,1H),2.29(t,J=6.6 Hz,2H),2.38 ~2.48(m,1H),2.78 ~2.87(m,2H),3.09 ~3.83(m,13H),4.03(q,J=7.2 Hz,2H),4.08 ~4.12(m,1H),4.19 ~4.24(m,1H),4.37 ~ 4.42(m,1H),7.20 ~7.28(m,3H),7.42(t,J=8.1 Hz,1H);IR ν:3 417,2 947,2 863,2 738,1 719,1 656,1 494,1 460,1 389,1 247,1 025,748,692 cm-1;ESI-MS m/z:565{[M+H]+}。
7g:产率 63%,m.p.187℃ ~191℃;1H NMR δ:1.11(t,J=7.2 Hz,3H),1.37 ~1.87(m,12H),2.01 ~2.13(m,1H),2.27(t,J=6.6 Hz,2H),2.37 ~2.49(m,1H),2.76 ~2.91(m,2H),3.09 ~ 3.26(m,3H),3.33 ~3.39(m,1H),3.55 ~ 3.68(m,9H),3.71(s,3H),4.01(q,J=7.2 Hz,2H),4.07 ~4.12(m,1H),4.22 ~4.32(m,1H),4.42 ~4.98(m,1H),6.95(d,J=9.3 Hz,2H),7.20(d,J=9.0 Hz,2H);IR ν:3 428,2 923,2 845,1 728,1 643,1 434,1 249,1 282,1 015,860 cm-1;ESI-MS m/z:527{[M+H]+}。
7h:产率 58%,m.p.189℃ ~192℃;1H NMR δ:1.12(t,J=7.2 Hz,3H),1.39 ~1.86(m,12H),2.00 ~2.12(m,1H),2.29(t,J=6.6 Hz,2H),2.37 ~2.48(m,1H),2.77 ~2.89(m,2H),3.08 ~3.62(m,13H),4.02(q,J=7.2 Hz,2H),4.07 ~4.11(m,1H),4.17 ~4.22(m,1H),4.37 ~ 4.42(m,1H),6.89 ~6.95(m,2H),7.03(t,J=1.8Hz,1H),7.22(t,J=8.1 Hz,1H);IR ν:3 423,2 936,2 857,1 731,1 654,1 489,1 456,1 399,1 261,1 026,744,686 cm-1;ESI-MS m/z:531{[M+H]+}。
2 结果与讨论
(1)2的合成
在文献[8]方法基础上,采用浓氢氧化钾溶液调节水解反应所需碱性,反应12 h。TCL检测结果显示,反应完全。以浓氢氧化钾作碱的优点有:(1)反应结束,2在冷却后可以直接析出;(2)2易于保存,不易吸潮结块。
(2)4的合成
最初尝试以硫酸作催化剂,但4产率极低。其原因可能是由于2结构中存在一个仲胺氮原子和一个叔胺氮原子,在反应中容易形成硫酸盐;此外,2在强酸性条件下也很容易再次脱水环合生成1。经多次实验,本文采用二氯亚砜作催化剂,合成4产率和纯度较高。
(3)5的合成
5是本路线的关键中间体。利用氯乙酰氯两端氯原子活性差异,与4仲胺原子反应制得5。最初合成5时,分别用二氯甲烷和四氢呋喃为溶剂,碳酸钾或三乙胺作碱,效果均不理想。实验结果表明,在本文条件[n(碳酸钾)∶n(氯乙酰氯)=3∶2]下合成5,产率较高。增大碳酸钾溶液浓度,4水解后进一步环合为1;增大氯乙酰氯加量,会产生过剩盐酸,使5环上两个氮原子形成盐酸盐并溶解在水中,后期处理时需先调节pH,再用乙酸乙酯多次萃取,使操作更繁琐。
3 结论
以苦参碱(1)为原料,合成了8个新型的1的衍生物。本文报道的方法,一方面,将1的内酰胺键通过开环和修饰成为环外酰胺键,期望在体内能产生协同的抗肿瘤作用,增强药物活性;另一方面,通过哌嗪结构片段可以改善药物的水溶性,提高其生物利用度。此外,该合成路线还具有条件温和,后处理简便和收率高等优点。
[1]付海根,唐胜,李迎红,等.新型12-N-取代苦参酸衍生物的合成及其抗结核活性[J].合成化学,2014,22(6):739 -743.
[2]王立升,杨龙力,刘旭,等.苦参碱磺胺类拼合物的合成[J].合成化学,2015,23(2):140 -143.
[3]艾静,高焕焕,何树庄,等.苦参碱青蒿素和粉防己碱对豚鼠心室肌细胞胞浆钙的影响[J].中国药理学报,2001,22(6):512 -515.
[4]蒋达洪,黄敏.含哌嗪基噻吩并[3,2-d]嘧啶类抗癌试剂的设计与合成[J].中化学试剂,2012,34(9):797-799.
[5]李和平,郭灿城,阮建明,等.哌嗪取代卟啉的合成、表征及其抗癌活性[J].有机化学,2004,24(7):783-787.
[6]Li X,Zhao W L,Jiang J D,et al.Synthesis,structure-activity relationship and biological evaluationof anticancer activity for novel N-substituted sophoridinic acid derivatives[J].Bioorganic & Medicinal Chemistry Letters,2011,21:5251 -5254.
[7]Du N N,Li X,Wang Y P.Synthesis,structure-activity relationship and biological evaluation of novel N-substituted matrinic acid derivatives as host heat-stress cognate 70(Hsc70)down-regulators[J].Bioorganic &Medicinal Chemistry Letters,2011,21:4732 -4735.
[8]尤叶君.苦参碱衍生物的合成及其抗肿瘤活性研究[D].南宁:广西大学化学化工学院,2010.
