龙胆苦苷的HPLC 分析方法与超声波辅助萃取工艺研究
2015-04-23程振玉宋海燕杨英杰姜冠泽于世华薛俊礼
程振玉,宋海燕,杨英杰*,姜冠泽,于世华,薛俊礼
(1.吉林化工学院 化学与制药工程学院,吉林 吉林 132022;2.吉林农业科技学院 实验中心,吉林 吉林 132101)
0 引言
龙胆草(Gentiana scabra Bge.),又名龙胆、草龙胆、地胆草,基源为龙胆科龙胆属植物龙胆(Gentiana scabra Bge.)、条叶龙胆(Gentiana manshurica Kitag.)、三花龙胆(Gentiana triflora Pall.)和滇龙胆(Gentiana rigescens Franch.)的干燥根和茎[1].龙胆草主要分布于吉林、辽宁、黑龙江、内蒙古、广东、广西、新疆、安徽等地[1-2].龙胆苦苷是龙胆草最有效的成分[3],在治疗肝损伤、肺损伤、心肌损伤等方面有显著的药理作用,且具有健胃、抗肿瘤、抗氧化、镇痛等重要作用[4].
李超等[3]、赵瑞芝等[5]均采用传统技术热回流法从龙胆草中提取了龙胆苦苷,但提取工艺明显存在提取时间长,且提取温度高等不足之处.在龙胆苦苷含量测定方面,目前大多数报道均采用高效液相色谱法(HPLC),但其主要集中在中药制剂领域中的应用,而在中药材龙胆草的应用方面相对较少,尤其在分析和评价不同产地的龙胆草质量方面略显不足.高瑞斌等[6]建立了高效毛细管电泳测定川西獐芽菜中龙胆苦苷的方法;刘智等[7]、谢瑞萍[8]、路长荣等[9]和段吉平等[10]均采用HPLC 法,分别测定了肝舒胶囊、复方龙胆片、胃痛宁等药中龙胆苦苷的含量;常艳琴等[11]采用HPLC 法,分析了龙胆草中龙胆苦苷的含量.HPLC 法分析速度快,灵敏度高,操作简单,分析含量准确、可靠,已经广泛应用于天然药物活性成分的分析[12-14].超声波提取技术具有节省溶剂、提取时间短、操作简单且提取效率高等优点[15-16].因此,笔者首先建立了HPLC分析中药材中龙胆苦苷的方法,然后用正交试验对超声波辅助萃取龙胆苦苷的工艺条件进行了优化,且对不同产地龙胆草中龙胆苦苷的含量进行了分析.
1 材料与方法
1.1 试验材料
龙胆草共产自6 个地区,由吉林化工学院隋新副教授基于植物形态学的方法进行鉴定.
对照品龙胆苦苷(生产批号:MUST-14052205):四川成都曼斯特生物科技有限公司;甲醇、乙腈均为色谱纯;甲酸、无水乙醇均为国产分析纯;实验用水为超纯水.
1.2 仪器与设备
P230 型高效液相色谱仪(配备UV-230 紫外检测器):大连依利特公司;FA1004 型电子天平:上海舜宇恒科仪器有限公司;SY-800 超声波清洗器:上海宁商超生仪器有限公司;RT-08 型多功能粉粹机:荣聪精密科技有限公司;RE-52A 型旋转蒸发仪:上海亚荣生化仪器厂;SHZ-D 型循环水式真空泵:河南省巩义市英峪仪器一厂.
1.3 试验方法
1.3.1 色谱条件
Hypersil ODS C18柱(4.6 mm×250 mm×5 μm),进样量20 μL,流量1.0 mL/min,检测波长270 nm,柱温25 ℃;流动相A 为乙腈,B 为0.4%的甲酸溶液;梯度洗脱程序:0~ 10 min,A 从5%上升到28%;10~16 min,A 从28%上升到30 %;16~16.1 min,A 从30%增加到100%,保持14 min;30~ 30.1 min,A 从100%降低到5%,保持15 min.
1.3.2 标准曲线的建立
取置于干燥器中48 h 以上的龙胆苦苷对照品,准确称量11.40 mg,加适量甲醇溶解、摇匀,定容到25 mL 容量瓶中,得到456.0 μg/mL 的龙胆苦苷对照品储备液.取一定量对照品储备液,采用连续稀释的方法,得到质量浓度依次为456.0、342.0、228.0、114.0、57.0、28.5、9.12 μg/mL 的7 个水平的溶液.按照“1.3.1”的色谱条件进行分析.以龙胆苦苷峰面积Y 为纵坐标,质量浓度X(μg/mL)为横坐标,绘制标准曲线,
1.3.3 龙胆苦苷的提取与含量分析
将干燥的龙胆草粉碎,过筛(120 目)后,精确称量1.0 g,放置于150 mL 平底烧瓶中,加入一定量的提取剂,然后将其浸没于盛有水的超声波清洗器中,以特定功率于一定温度下提取一段时间.提取结束后,抽滤,收集滤液;烧瓶及药渣用少量80%乙醇洗涤数次后继续抽滤,合并滤液,转移到100 mL 容量瓶中,最后添加少量提取剂定容,摇匀.用移液管精确量取5 mL,加80%乙醇定容到25 mL,取少量试液过0.45 μm 微孔滤膜,供HPLC检测,按下列公式计算龙胆苦苷含量.

1.3.4 超声波辅助萃取龙胆苦苷的正交优化L9(34)试验设计[17]
在考察单因素试验的基础上,采用L9(34)表,设计正交试验对提取温度、提取时间、超声波功率和料液比4 个因素进行优化,因素与水平见表1.
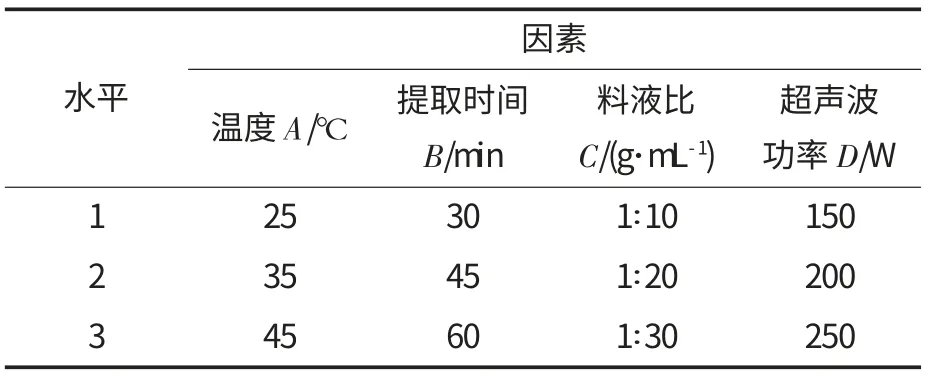
表1 因素与水平Table 1 Factors and levels of L9(34) orthogonal design
2 结果与分析
2.1 色谱条件的选择
取“1.3.2”的对照品储备液适量,采用紫外光谱扫描,结果显示270 nm 左右处有最大吸收波长.因此,本试验以270 nm 作为检测波长.
试验分别考察了甲醇-水(V/V=10∶90)、乙腈-水(V/V=10∶90)、甲醇-乙腈-水(V/V/V=5∶5∶90)以及乙腈-0.4%甲酸溶液4 种流动相体系下,龙胆苦苷的对照品及其供试品的色谱分离情况.结果表明:采用甲醇-水做流动相体系,龙胆苦苷出峰时间晚,且峰展开很宽;在乙腈-水、甲醇-乙腈-水两种流动相体系下,分析时间均明显缩短,但可能由于苷类化合物的本身水解产生干扰物质等原因,龙胆苦苷峰形上半部尖锐对称,下半部分却展开较宽,甚至呈现前伸峰的趋势;采用乙腈-0.4%甲酸水溶液做流动相体系,水解得到了抑制,分析时间缩短,且峰形尖锐,对称度好,龙胆苦苷得到了良好的洗脱和分离,对照品溶液和供试品溶液色谱图分别见图1A 和图1B.为了满足目标成分良好的分离度和洗脱效果,并且减少拖尾和包峰等现象,研究选择乙腈-0.4%甲酸溶液为流动相体系.
2.2 超声波辅助提取龙胆苦苷工艺条件的优化
试验首先考察了提取溶剂(20%、40%、60%、80%、100%乙醇和甲醇)对超声波辅助萃取龙胆苦苷提取率的影响.结果表明:乙醇体积分数低于80%时,随着体积分数的提高,龙胆苦苷提取率逐渐上升,但体积分数高于80%时,进一步增加乙醇体积分数,其提取率不再有明显变化;采用甲醇作溶剂,提取率略高于乙醇.综合考虑工业生产的安全性和经济效益,试验选择80%乙醇作最佳提取剂.超声波功率、提取温度、超声时间和料液比的正交试验结果见表2.

图1 高效液相色谱图Fig.1 HPLC chromatogram
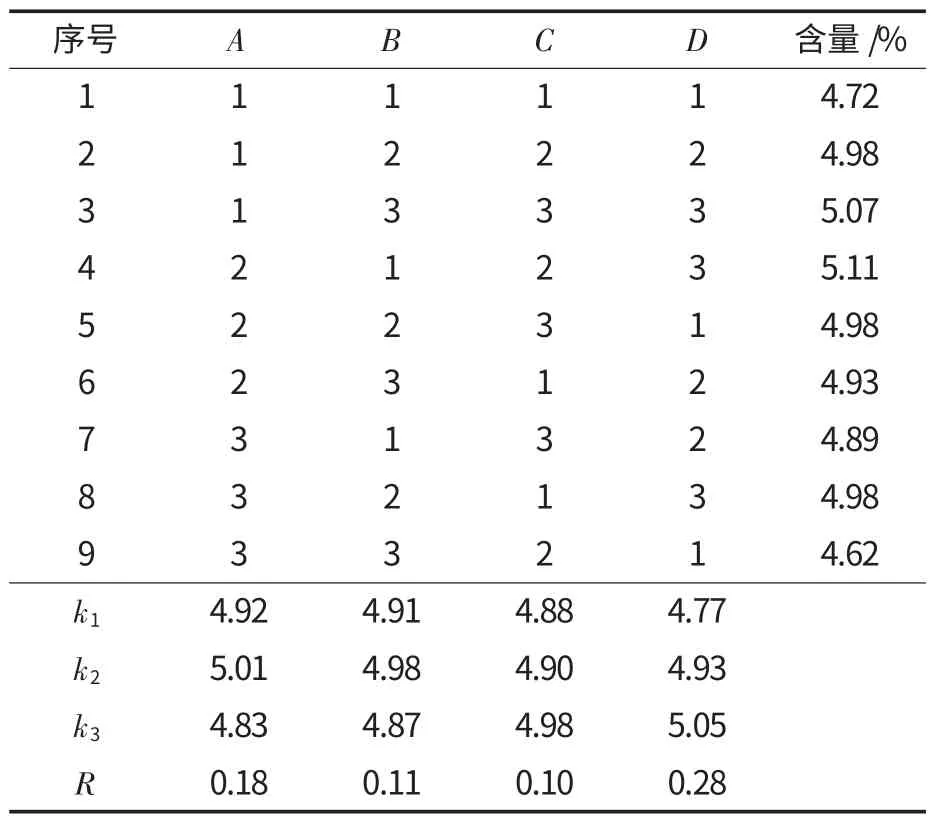
表2 超声波辅助萃取龙胆苦苷正交试验L9(34)结果Table 2 Results of orthogonal experiments L9(34) of ultrasound-assisted extraction
由表2 可知,在超声波辅助萃取龙胆苦苷的工艺中,所考察因素的影响主次顺序为:D>A>B>C,即超声波功率>提取温度>提取时间>料液比;因素间的最佳组合为A2B2C3D3;因此试验确定提取条件为:提取温度35 ℃,提取时间45 min,料液比1∶30,超声波功率250 W,最佳提取剂为80%的乙醇,在此条件下,龙胆草中龙胆苦苷的提取率为5.11%.
2.3 标准曲线的绘制和检出限、定量限
以龙胆苦苷峰面积Y 为纵坐标,质量浓度X(μg/mL)为横坐标,绘制标准曲线,回归方程为:Y=15.451 X +117.62,相关系数R2=0.999 9,表明在9.12~456.0 μg/mL 范围内龙胆苦苷含量与峰面积呈良好的线性关系.对质量浓度最低的溶液逐级进行稀释,以信噪比(S/N)约为3 计检出限(LOD),S/N 约为10 计定量限(LOQ),其结果分别为0.033 6 μg/mL、0.106 6 μg/mL,表明该法灵敏度高,可用于龙胆苦苷的准确分析.
2.4 精密度试验
吸取同一对照品溶液,重复进样5 次,记录峰面积,根据回归方程计算含量,龙胆苦苷测定值的相对标准偏差(RSD)为3.35%,说明仪器的精密度良好.
2.5 重现性考察
称取干燥龙胆草(120 目)6 份,每份1.0 g,在试验所优化的最佳工艺条件下进行提取,按照“1.3.1”的色谱条件,用HPLC 分析含量,龙胆苦苷测定的RSD 为1.58%.表明该方法重现性良好.
2.6 稳定性分析
精密称取干燥龙胆草(120 目)1.0 g,在试验所优化的最佳工艺条件下进行提取,提取液室温放置5 d,分别在0 h、3 h、6 h、12 h、24 h、48 h、72 h、96 h、120 h 测定,龙胆苦苷测定值的RSD 为3.35%.表明在该试验条件下,供试品溶液5 d 内基本稳定.
2.7 加样回收率试验
取一定量龙胆苦苷对照品储备液,按照试验设计稀释成一定浓度的高、中、低3 个水平的溶液.精确称量已知龙胆苦苷含量的龙胆草(120 目)6份,每份0.5 g,分别加入一定量的上述对照品溶液,按照试验所确定最佳工艺条件制备样品溶液,用HPLC 法分析含量,结果见表3.
2.8 样品含量测定
取不同产地的干燥龙胆草样品(120 目)1.0 g,按照优化的超声波辅助提取条件和“1.3.1”所述色谱条件,对龙胆苦苷提取并进行含量分析,结果见表4.
3 结论
本研究首先对高效液相色谱法的分析条件进行了讨论,建立了定量分析龙胆苦苷含量的HPLC法,然后基于该法,用正交试验对超声波辅助萃取龙胆苦苷的工艺条件进行了优化,定量优化了正交试验设计法-超声波辅助法萃取龙胆苦苷的工艺条件.超声波最佳提取工艺条件为:提取温度35℃,提取时间45 min,料液比1∶30,超声波功率250 W,乙醇体积分数80%;该技术具有提取时间短、温度低等优点,明显优于传统提取方法.本文建立的HPLC 法,以乙腈-0.4%甲酸溶液作流动相,分析时间短,龙胆苦苷得到了良好的洗脱和分离,且峰形尖锐,对称度高,与干扰物质完全分离.试验表明HPLC 法精密度高,重现性好,分析结果准确可靠,为评价龙胆草活性成分龙胆苦苷提供了一种可靠的分析方法;同时,本研究对不同产地的龙胆苦苷同时进行提取,做了对比研究,为进一步研究龙胆草的药理活性和质量控制提供了基础化学数据支撑.
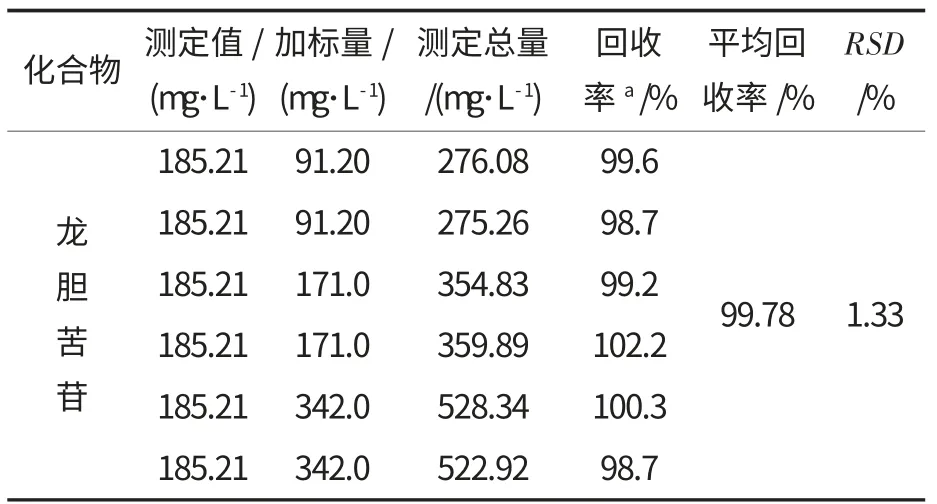
表3 回收率试验结果(n=6)Table 3 Results of recoveries tests(n=6)
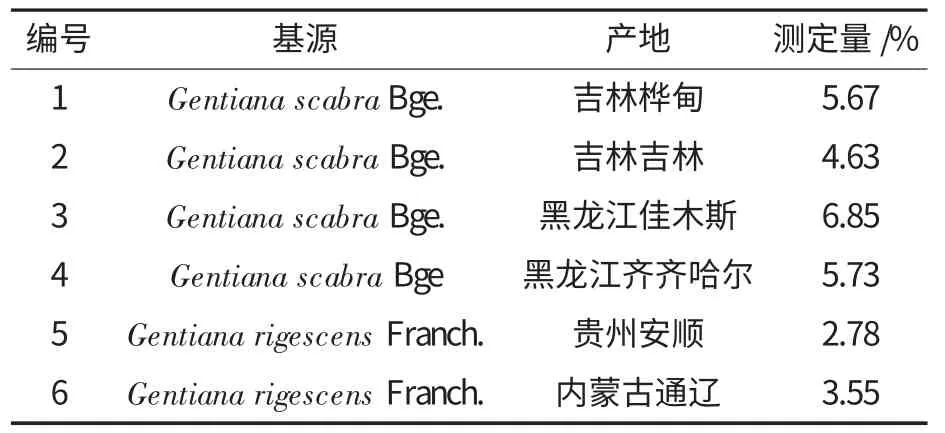
表4 样品含量分析结果Table 4 Analytical results of samples
[1]侴桂新,王峥涛,董婷霞,等.龙胆药材中龙胆苦苷的含量测定[J].上海中医药杂志,2005,39(11):53-55.
[2]吉惠杰,杨英杰,杨艳俊,等.龙胆苦苷分离方法研究[J].黑龙江农业科学,2014,133(12):133-134.
[3]李超,韩泳平.响应面优化龙胆草中龙胆苦苷提取工艺的研究[J].西南民族大学学报:自然科学版,2013,39(2):204-208.
[4]郭清峰,王玮,韩文清.龙胆苦苷的药理作用进展[J].广东化工,2014,41(17):121.
[5]赵瑞芝,梁伟杰,丘小惠.龙胆药材中龙胆苦苷的提取工艺研究[J].中国药房,2005,16(12):956-957.
[6]高瑞斌,董树清,杨艳,等.高效毛细管电泳同时测定川西獐芽菜中龙胆苦苷和獐芽菜苦苷[J].辽宁中医杂志,2014,41(5):994-997.
[7]刘智,余绮,黄武军,等.肝舒胶囊中龙胆苦苷含量测定的研究[J].江西中医学院学报,2002,14(1):44-45.
[8]谢瑞萍.HPLC 法测定复方龙胆片中龙胆苦苷的含量[J].云南中医中药杂志,2011,32(7):74-75.
[9]路长荣,王卫峰.HPLC 法测定胃痛宁片中龙胆苦苷的含量[J].陕西中医,2008,29(7):891-892.
[10]段吉平,冯丽,张立涛.高效液相色谱法测定当药中龙胆苦苷含量的方法[J].中国药业,2013,22(4):39-40.
[11]常艳琴,王德.HPLC 法测定龙胆草中龙胆苦苷含量[J].黑龙江医药,2011,24(4):533-534.
[12]程振玉,杨英杰,刘治刚,等.高效液相色谱法测定北五味子中5 种木脂素含量[J].理化检验(化学分册),2014,50(5):575-578.
[13]贾蔓箐,唐辉,李翠华,等.棉油皂脚中植物甾醇的提取工艺研究[J].食品研究与开发,2015,36(6):45-48.
[14]杨立芳,刘洪存,姜明国,等.响应曲面法优选毛果鱼藤中香豆素类成分提取工艺的研究[J].药物分析杂志,2015,35(3):506-511.
[15]张悦怡,刘勇慧,赵岩,等.响应面优化超声波辅助乙醇提取五味子木脂素工艺研究[J].食品安全质量检测学报,2014,5(6):1855-1861.
[16]Cheng Z Y,Yang Y J,Liu Y,et al.Twosteps extraction of essential oil,polysacchar -ides and biphenyl cyclooctene lignans from Schisandra chinensis Baill fruits[J].Journal of Pharmaceutical and Biomedical Anaysis,2014,96:162-169.
[17]王秀娟,马艳梅,商雪娇,等.五味子多糖不同提取工艺的研究[J].食品工业科技,2013,34(12):289-291.
