豌豆白粉病抗性相关指标的研究
2015-04-22张丽娟杨晓明陆建英
张丽娟,杨晓明,陆建英,王 昶
(甘肃省农业科学院作物研究所, 甘肃 兰州 730070)
豌豆白粉病是影响豌豆生产的主要病害之一,豌豆白粉病的发生与品种的抗性有直接的关系。我国关于豌豆白粉病的研究主要集中在对抗病种质资源的鉴定评价和综合防治技术方面[1~5]。植物病原真菌侵入植物体后可引起寄主植物体内发生复杂的生理生化变化,许多学者都在研究真菌的致病机制和寄主植物的抗病机理[6],而有关豌豆白粉病抗性与各生理指标间的关系尚缺乏研究。
甘肃省农业科学院作物研究所选育的豌豆品种X9002是我国目前培育出来的高抗、且抗性稳定的抗白粉病豌豆品种[7]。我们根据苗期抗性鉴定结果,以不同生长习性的抗、感病品种1702、定褐、S3008为对照,研究豌豆白粉病菌侵染前不同抗性品种间相关防御系统的变化规律,以期为抗病育种提供理论依据。
1 试验材料与方法
1.1 试验材料
选用抗病品种X9002、中抗品种1702、中感品种定褐及高感品种S3008为试材,培养土用甘肃省农业科学院试验地耕层与蛭石、腐殖质按1∶1∶2混合,装于规格为30 cm×30 cm的花盆内,每品种种6盆,置于智能化温室中进行培养。
1.2 试验方法
1.2.1 叶绿素含量测定 采用分光光度计法[8]。称取剪碎的新鲜豌豆叶片0.2 g于研钵中,加80%丙酮25mL研磨,定容至25mL, 80%丙酮作对照,于652 nm处测定样品液吸光值,按下列公式计算叶绿素含量,重复3次。
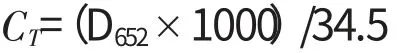
叶绿素含量=CT×提取液体积×稀释倍数/样品鲜重×1000
1.2.2 可溶性糖含量测定 称取剪碎的新鲜豌豆叶片0.5 g,放入大试管中,加入15mL蒸馏水,沸水浴煮沸20min,取出冷却,过滤入50mL容量瓶中,蒸馏水冲洗残渣数次定容至刻度。取待测样品提取液1.0mL加葸酮试剂5mL,将各管快速摇动混匀后,在沸水浴中煮10min,取出冷却,在620 nm波长下,用空白调零测定光密度,同时绘制标准曲线[9]。
1.2.3 粗酶液的制备 称取0.2 g新鲜豌豆叶片,放入预冷的研钵中,加入2.0mL 0.05mol/L磷酸缓冲液(pH 7.0)和0.1 g聚乙烯吡咯烷酮(PVP)及少量石英砂,于冰浴中研磨成匀浆,转移至离管中,然后再加入3.0mL上述缓冲液冲洗研钵合并入离心管。13 000 r/min,4℃离心20min,上清液即为酶的粗提液。
1.2.4 SOD活性的测定 取上清液0.03mL,加1.8 mL反应液[含14.5 mM甲硫氨酸,2.25 mM NBT,60μM 核黄素,30μM EDTA-Na2;用50 mM PBS(7.8)],4 000 lux照光20min,黑布避光终止反应,黑暗下终止反应,立即在560 nm波长处测定吸光值,以缓冲液代替酶液作为空白。抑制NBT光化学反应50%为一个酶活性单位[10]。
1.2.5 CAT活性测定 取上清液0.1mL、磷酸缓冲液(pH 7.0)1.5mL、蒸馏水1mL,设置2个重复1个对照。25℃预热后逐管加入0.2mol/L的H2O2,在240 nm下测定吸光度,每隔1min读取一次,共测3min[11]。
1.2.6 POD活性测定 0.1 mL酶液,加入含有2%H2O2的0.05mol/L磷酸缓冲液和0.05mol/L愈创木酚,用加热煮沸5min的酶液为对照,立即于37℃水浴中保温15min,然后迅速转入冰浴加入2.0mL 20%三氯乙酸终止反应,470 nm波长下测定吸光度,以每分钟内吸光度变化0.01为1个过氧化物酶活性单位(U)[12]。
1.2.7 PPO活性测定 0.1mL酶液加入5mL试管中与1.7mL含0.02mol/L邻苯二酚的磷酸缓冲溶液(pH 6.8)混合。在30℃水浴保温30min,于398 nm下测光密度值,以提取缓冲液为空白对照。以每秒在398 nm处吸光度变化0.01为1个酶活性单位U。
1.2.8 PAL活性测定 取上清液0.1mL,加底物0.02M苯丙氨酸硼酸缓冲液(pH 8.8)1.7mL,30℃保温30min,硼酸缓冲液为对照,以每秒在290 nm处吸光度变化0.01为1个酶活性单位[13]。
2 结果与分析
2.1 不同抗性品种可溶性糖含量差异
由表1可见,随着豌豆品种抗性降低,可溶性糖含量大致呈升高趋势, 抗性品种X9002和1702的可溶性糖含量均低于7%,感病品种定褐和S3008的可溶性糖含量均高于7%,抗病品种与感病品种间差异极显著(P<0.01),但高抗品种X9002与中抗品种差异不显著(P>0.05)。高感品种S3008可溶性糖含量并非最高,较中感品种1702低,为7.19%,不同抗性品种间可溶性糖含量差异不显著。
2.2 不同抗性品种叶绿素含量差异
叶绿素含量作为直接反映植物光合特性的重要生理参数,已成为多种植物的抗逆生理指标。叶绿素含量高,叶片光合作用强,产生的能量和积累的有机物质就越多,植物抗病性也就越强。由表1可以看出,不同品种的叶绿素含量随着白粉病抗性降低而降低,抗性品种叶绿素含量均高于3mg/g,明显高于感病品种。高抗品种X9002叶绿素含量最高,达到4.13mg/g;感病品种叶绿素含量均低于3mg/g,高感品种S3008叶绿素含量最低,为2.63mg/g。经统计分析高抗品种与中抗、中感及高感品种均存在极显著差异(P<0.01),说明叶绿素含量与豌豆白粉病抗性正相关,可反映豌豆品种白粉病抗性的增强。
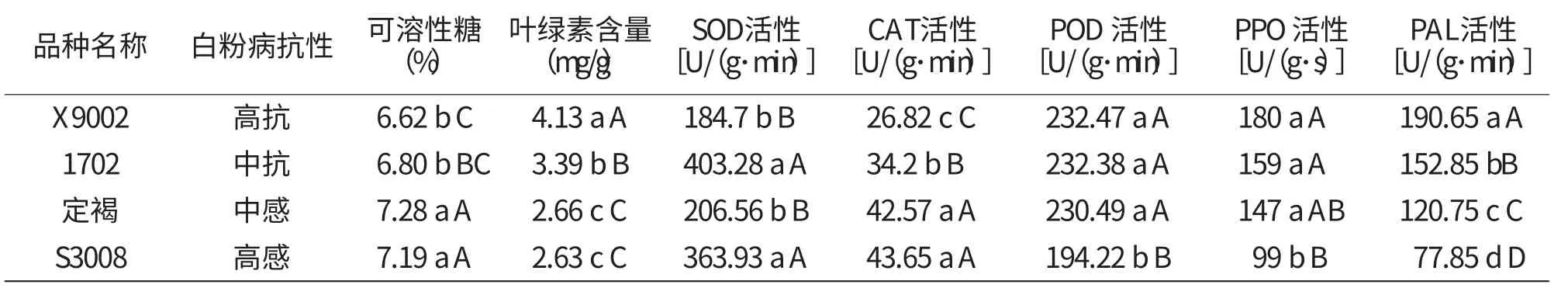
表1 不同抗性品种的生理指标与抗病性的关系
2.3 不同抗性品种SOD 活性差异
由表1可以看出,SOD活性与豌豆白粉病抗性之间的变化规律不明显。其中中抗品种1702的SOD活性最高,为403.28 U/(g·min),与高抗和中感品种存在极显著差异(P<0.01)。而高抗与中感品种间无显著性差异(P>0.05),且高抗品种X9002的SOD活性最低,为184.7 U/(g·min)。抗病品种与感病品种间的SOD活性不呈规律性变化,因此SOD活性的高低不能反映豌豆白粉病抗性的强弱。
2.4 不同抗性品种CAT 活性差异
由表1可以看出,不同抗性品种的CAT活性随着白粉病抗性的减弱而增强,抗病品种CAT活性明显低于感病品种;高抗品种X9002的CAT活性最低,为26.82U/(g·min),与中抗品种及感病品种的CAT活性存在极显著差异(P<0.01);高感品种S3008的CAT活性最高,达到43.65U/(g·min)。表明CAT活性与豌豆白粉病抗病性之间存在一定的关系,可用CAT活性高低反应豌豆白粉病抗性的强弱。
2.5 不同抗性品种POD 活性差异
由表1可以看出,不同抗性豌豆品种之间POD活性差异不显著,高感品种S3008的POD活性最低,为190.08 U/(g·min),高抗、中抗与中感品种POD活性均高于200U/(g·min),且三者之间没有显著差异(P>0.05)。即在豌豆不同抗性品种中,POD活性不随白粉病抗性强弱呈规律性变化,POD活性的高低不能反映豌豆白粉病抗性的强弱。
2.6 不同抗性品种PPO 活性差异
从表1中看出,不同抗性品种的PPO活性随着抗病性的减弱而降低。高抗品种X9002中PPO活性最高,为180 U/(g·s);高感品种S3008活性最低,99U/(g·s),抗病品种与感病品种间差异极显著(P<0.01)。可见PPO活性与豌豆白粉病抗病性有一定的关系,可用PPO活性的高低反映豌豆白粉病抗性的强弱。
2.7 不同抗性品种PAL 活性差异
表1显示不同豌豆品种PAL活性随着白粉病抗性的减弱而降低。高抗品种X9002的PAL活性最高,为190.65 U/(g·min),与中抗、中感及高感品种表现极显著差异(P<0.01);高感品种S3008的PAL活性最低,为77.85U/(g·min),不同抗性品种间PAL活性表现极显著差异(P<0.01),可用PAL活性反应豌豆白粉病抗性水平。
3 小结与讨论
1) 选取4种抗性不同的豌豆品种,测定品种间叶绿素和可溶性糖含量以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性变化。结果表明,叶绿素含量、POD、PPO活性和PAL活性随对豌豆白粉病抗性的减弱而降低,CAT活性随豌豆白粉病抗性减弱而升高,SOD活性与豌豆白粉病抗性没有明显变化规律。方差分析结果显示,不同抗感病品种间叶绿素含量、PPO活性、PAL活性和CAT活性差异极显著(P<0.01),因此可以用叶绿素含量、PPO活性、PAL活性和CAT活性来反映豌豆白粉病抗性强弱。
2) 防御酶系统在植物抵御病害中起着非常重要的作用。酚类化合物在植物抗病中起着重要的作用,PPO能够促进酚类物质氧化成为醌或者形成木质素,大量木质素在受侵染部位合成并积累,抑制病原菌的繁殖,醌类化合物通过钝化病原菌的呼吸酶,阻碍病原菌繁殖扩散。PPO活性越大,植株对病原菌抑制力越强,即抗病性越强。PAL也是酚代谢的主要酶之一,能催化苯丙氨酸脱氨基后产生肉桂酸,最终转化为木质素。PAL活性愈大,酚类合成代谢愈强。本研究发现,豌豆高抗品种X9002的PPO活性和PAL活性明显高于感病品种,由于其酚类物质氧化程度高,抵御病害能力强,这与在草莓和白菜上的研究中有相似结论[14~15]。CAT也是植物体内重要的酶促防御系统之一,能清除活性氧的膜保护酶类,它能把活性氧转变为低活性物质,从而保护细胞膜系统。
3) 本研究所筛选的几个生理指标是否能作为衡量豌豆白粉病抗性的标准,准确反应不同品种的抗病性,还需进一步接种白粉病菌,在尽可能多的豌豆品种中进行验证,以期找到在诱导植株发病前即可通过采集少量叶片测定豌豆抗病性的可靠指标。
[1] 陈群航,郑益嫩. 福建省豌豆白粉病调查与防治[J].福建农业科技,1998,(5):13-14.
[2] 彭化贤,姚 革. 我国豌豆地方品种抗白粉病性的研究[J]. 植物病理学报,1993,(1):64.
[3] 林成辉,唐乐尘. 不同豌豆品种对白粉病的抗性特点与防治对策[J]. 中国蔬菜,2002(6):38-39.
[4] 王志刚. 豌豆源类型筛选抗病性鉴定与利用评价[J].内蒙古农业科技,2003(1):12-13
[5] 陈振洛. 甜豌豆白粉病的发生与防治[J]. 福建农业.2004(2):20-21.
[6] 王阿旺,傅俊范,周如军,等. 草莓白粉病菌对寄主防御酶活性的影响[J]. 江苏农业科学,2009(2):111-113.
[7] 杨晓明. 豌豆白粉病研究进展[J]. 甘肃农业科技,2012(8):35-37.
[8] 赵世杰,刘华山,董新纯. 植物生理学实验指导[M].北京:中国农业科技出版社,1998:68-72.
[9] 邹 琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2007:111-112.
[10] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:267-268.
[11] 王保成,孙万仓,范惠玲,等. 芸芥自交亲和系与自交不亲和系SOD、POD 和CAT 酶活性[J]. 中国油料作物学报,2006,28(2):162-165.
[12] 李合生,李 琳,焦新之. 现代植物生理学实验指南[M]. 北京:科学出版社,1999:164-165.
[13] 邢会琴,李敏权,徐秉良,等. 过氧化物酶和苯丙氨酸解氨酶与苜蓿白粉病抗性的关系[J]. 草业科学,2007,15(4):376-377.
[14] 张 梅,刘 瑶,丛慧芳,等. 草莓抗白粉病生理生化指标研究[J]. 中国农学通报,2011,27(28):249-253.
[15] 刘 琳,侯喜林,王利英,等. 不结球白菜感染芜菁花叶病毒后4 种防御酶活性变化及其抗病相关性[J]. 南京农业大学学报,2009,32(3):14-18.
