气相色谱—燃烧—同位素比率质谱法测定葡萄酒中5种挥发性组分的碳同位素比值及其在产地溯源中的应用
2015-04-20吴浩等
吴浩等

摘 要 建立了一种利用气相色谱燃烧同位素质谱(Gas chromatographycombustionIsotope ratio mass spectrometers, GCCIRMS)测定葡萄酒中5种挥发性组分(即乙醇、丙三醇、乙酸、乳酸乙酯、2甲基丁醇)碳稳定同位素比值新方法。优化了GCCIRMS测定条件,进样量小于0.5 μL,样品分析时间小于14 min。对以上5种挥发性成分标准品的测定精密度为0.08‰~0.25‰,葡萄酒样品的测定精密度为0.09‰~0.36‰,与元素分析同位素比率质谱仪(Element analyzerisotope ratio mass spectrometers, EAIRMS)比较,其测定偏差低于0.5‰。利用该技术分析了产自法国、澳大利亚、美国和中国共54支葡萄酒中5种挥发性组分的碳稳定同位素值并进行产地溯源分析,判别分析(Discriminant analysis, DA)结果表明, 仅利用以上5种挥发性组分的碳同位素比值就能有效区分以上4个产地的葡萄酒,说明葡萄酒挥发性成分稳定碳同位素可应用于葡萄酒的产地溯源。
关键词 产地溯源; 同位素; 香气成分; 葡萄酒; 气相色谱燃烧同位素比率质谱仪
1 引 言
近些年来,随着中国葡萄酒市场的逐步扩大,葡萄酒真伪的鉴别越来越受到学术界和监测部门的重视[1]。欧洲作为葡萄酒主要生产国,对葡萄酒的产地、葡萄品种等一系列信息做了相关规定。针对葡萄酒的制假问题,欧盟开发了葡萄酒数据库银行(Wine DBbank), 用于葡萄酒的真实属性进行鉴定[2],但我国在葡萄酒鉴定方面的研究还非常的薄弱。
葡萄酒产地是评判其品质的重要指标,但目前还没有有效方法能对葡萄酒产地进行鉴别与溯源。过去几十年里,国际上已经发展了很多可用于葡萄酒产地溯源的方法,例如矿质元素指纹法[3~5]、香气指纹法[6~8],以及稳定同位素比值法[9~11]等,其中稳定同位素比值能很好地指示地域和气候特性,目前已经成为产地溯源的重要方法。欧盟早在1992年就开发了元素分析稳定同位素质谱(Element analyzerisotope ratio mass spectrometers,EAIRMS)法测定葡萄酒中乙醇的δ13C值[2],用于区分不同产地的葡萄酒,并将该方法作为测定葡萄酒乙醇的标准方法。但该方法需要利用复杂的蒸馏技术将葡萄酒中的乙醇蒸馏出来再测定,并且蒸馏过程中必须避免产生同位素分馏。复杂的前处理过程限制了该方法的广泛应用。目前,已有液相色谱稳定同位素质谱(Liquid chromatography isotope ratio mass spectrometers, LCIRMS)测定葡萄酒中的乙醇、丙三醇的方法,但由于液相色谱法必须用水作为载流,因此大大降低了有机组分的分离效率,目前仅能分离乙醇和丙三醇[12]。利用气相色谱燃烧稳定同位素比率质谱法(Gas chromatographycombustionisotope ratio mass spectrometers, GCCIRMS)不仅省去了复杂的前处理过程,也不会引入外来杂质,保证可挥发性组分的测定速度和准确性,并且能对葡萄酒中微量挥发性组分碳同位素比值进行测定。不同产地葡萄酒可能由于其独特的酿造方式和葡萄品种的差异极可能导致微量挥发性成分稳定同位素组成的变化,因此香气成分的稳定同位素比值可作为产地溯源的指标。另外,有些产区之间葡萄酒由于其地理气候条件极其相似,传统的矿质元素和氢氧稳定同位素难以进行产地的区分。因此,多种挥发性成分的碳同位素指纹图谱有可能成为一个新的葡萄酒产地溯源的指标。本研究采用GCCIRMS测定葡萄酒中多种挥发性组分,即乙醇(Ethanol)、丙三醇(Glycerol)、乳酸乙酯(Ethyl lactate)、2甲基丁醇(2Methyl butanol)、乙酸(Acetic acid)的碳稳定同位素比值方法,并探讨此方法在葡萄酒产地溯源中的应用。
2 实验部分
2.1 仪器与试剂
GCCIRMS: DELTA V Advantage同位素质谱仪(美国Thermo Fisher公司),配备Trace GC气相色谱仪与GCIsolink接口。EAIRMS:与GCCIRMS共用主机,配备 FlashEA1112元素分析仪。超纯水由Millpore公司制造的MilliQ系统制备。He气(高纯99.999%,载气)、CO2标准参考气(Air Products,USA)。HPINNOwax气相色谱柱(30 m×0.25 mm×0.25 μm,安捷伦(美国)公司)。
乙醇同位素标准物质为BCR656 (欧洲标准物质中心),δ13CVPDB= 26.91‰±0.07‰,纯度96%;乳酸乙酯(纯度99.5%,天津光复精细化工研究所);2甲基丁醇(纯度98%,美国Sigma公司);乙酸、丙三醇(纯度大于98%,天津科密欧化学试剂有限公司)。除乙醇外,其它挥发性成分标准品均没有相应的同位素标准值。因此,本研究以BCR656作为稳定同位素值的质量控制标准。
2.2 样品准备
标准品配制:所有标准品均用超纯水稀释10倍,待测。
葡萄酒样品来自出入境检验检疫送检样品和指定经销商采集。所选葡萄酒包括法国(10支)、美国(13支)、澳大利亚(19支)以及中国(12支)4个产地共54个样品。为了突出产地区别,进口葡萄酒品种(赤霞珠、西拉等)、年份(2008~2012)、生产厂商均随机选择。国产葡萄酒选取市场上常见的长城、张裕、香格里拉以及王朝等品牌葡萄酒,代表了中国主要葡萄酒产地,主要葡萄品种为赤霞珠。葡萄酒开瓶后摇匀,一次性注射器(5 mL)吸取葡萄酒样,用0.22 μm水系滤膜过滤至1.5 mL样品瓶中,待测。
2.3 仪器条件
由于不同组分挥发性成分在葡萄酒中的含量差异较大,因此为了达到较好的分离效率和准确度,本方法拟采用不同的分离条件进行测定。
2.3.1 GC条件 乙醇:进样量0.1 μL,进样口温度250 ℃,载气为高纯He,流速1.5 mL/min,分流比200∶1。程序升温条件:初温40 ℃,保留1 min,50 ℃/min升温至220 ℃,保留3 min。
丙三醇:进样量0.2 μL,进样口温度270 ℃,载气为高纯He,流速1.5 mL/min,分流比20∶1。程序升温条件:初温80 ℃,保留1 min,15 ℃/min升温至240 ℃,保留2 min。
其它组分: 进样量0.5 μL,进样口温度250 ℃,载气高纯He,流速1.5 mL/min,分流比10∶1。程序升温条件:初温80 ℃,保留1 min,15 ℃/min升温至240 ℃,保留6 min。
2.3.2 GC Isolink条件 燃烧管温度1000 ℃,切入质谱时间200 s。
2.3.3 EA条件 氧化炉960 ℃,柱温60 ℃,O2流速200 mL/min,充氧时间3 s,载气流速200 mL/min。
2.3.4 质谱条件
离子源电压2.97 kV,真空度1.6×10 6 Pa; 轰击电压120.8 eV。
2.4 精度和准确性测定
对标准品进行重复测定,取10次测定值的标准偏差(Standard deviation, SD)作为GCCIRMS的测定精度。除乙醇外,其它挥发性组分标准品没有相应的同位素标准值,因此本研究以EAIRMS测定值作为参考,确定GCCIRMS方法测定准确性范围。随机选取3支葡萄酒,分别测定上述5种挥发性成分,重复测定5次,计算标准偏差,考察方法测定实际样品的稳定性和再现性。
2.5 数据处理
Thermo electron isodat version 3.0软件用于同位素值的计算和数据获取。方差分析(Oneway ANOVA)和判别分析(Discrimination analysis,DA)采用SPSS19.0(美国,IBM)进行分析。绘图软件采用Origin 8.5(美国Originlab公司)进行数据图绘制。
3 结果与讨论
3.1 测定条件优化
稳定同位素质谱仪具有极高的灵敏度,极易受到外界条件和仪器本身状态的影响,因此确保仪器的稳定是进行样品分析的前提。实验室保持26 ℃左右恒温,温度变化不超过1 ℃/h,湿度60%左右,并提前对色谱柱进行必要的老化,燃烧管加热到指定温度后至少稳定4 h。运行参考气测试,直至10组参考气值的标准差小于0.06‰才能进行样品测试。
由于IRMS测定同位素值主要是样品与参考CO2气体的质谱信号进行比较,因此测定值受到样品与参考气信号强度比值的影响。为了评估样品浓度对测定结果的影响,将乙醇标准(BCR 656)按2%, 4%, 6%, 8%, 10%, 12%, 20%, 30%和50%进行稀释,调节分流比和进样量, 形成500~25000 mV信号强度梯度,并测定该标准溶液的δ13C值,重复测定5次。如图1所示,当参考气信号设置为3000 mV,样品信号强度处于3000~10000 mV附近时能得到稳定的同位素值。由于信号强度越大,氧化管的消耗也越大,综合考虑分析的准确性和经济性,设定样品信号在3000~4000 mV之间最佳。
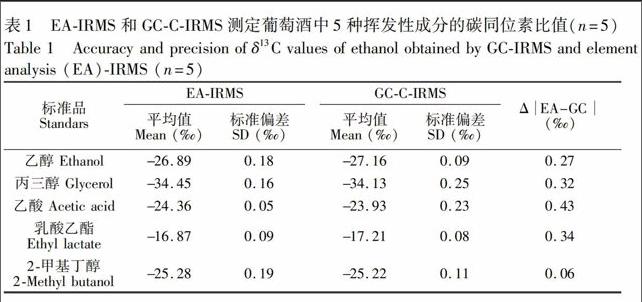
由于同位素质谱仪灵敏度极高,纯乙醇和丙三醇不能直接进样测定,需要进行稀释。本实验采用的HPInnowax色谱柱为耐水极性柱,对醇类和酯类等极性成分具有良好的分离效果,能够承受较高的水分,因此挥发性成分的标准品均采用超纯水稀释。所选择的5种挥发性成分标准品在相应测定条件下将标准品稀释10倍后测定其δ13C值,根据国际通行的质控标准[13,14],测定结果的标准偏差(SD)应小于0.3‰。如表1所示,EAIRMS和GCCIRMS精度均能达到要求。由于EA测定碳同位素时需要进行包样操作,挥发性成分在包样过程可能会导致碳的同位素分馏,而且不同标准品(非同位素标准品)的纯度和杂质含量也会导致EAIRMS与GCCIRMS的测定值存在差异,但差异均小于0.5‰。
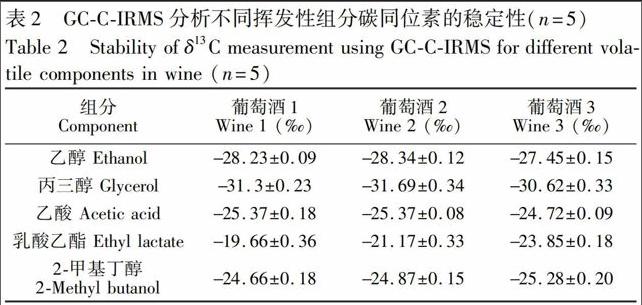
3.3 稳定性
葡萄酒基质相对复杂,一些微量未知组分可能干扰色谱分离,进而影响测定精度。因此,为了测试本方法对实际样品分析的稳定性,取任意3只葡萄酒分别进行5次重复分析,计算其SD值。结果表明(见表2),乙醇、乙酸和2甲基丁醇的SD值优于0.2‰,在仪器分析误差(0.3‰)范围内;乳酸乙酯、丙三醇的SD值优于0.4‰,小于GCCIRMS
[TS(][HT5”SS] 图4 不同国家葡萄酒中5中挥发性成分的δ13C值差异
Fig.4 Comparison of δ13C values of five volatile components in wine among different countries[HT5][TS)]
对葡萄酒样品的分析误差0.6‰[15],因此, 本方法对葡萄酒挥发性组分的碳同位素分析满足稳定性要求。
3.4 产地溯源分析
为了检测挥发性组分碳稳定同位素比值分析在葡萄酒产地溯源中的有效性,选取了产自澳大利亚(Australia)、美国(USA)、法国(France)和中国(China)葡萄酒,利用本方法分别测定葡萄酒中5种主要的挥发性组分的碳同位素值。Oneway ANOVA分析结果表明,不同国家葡萄酒的不同挥发性成分碳同位素存在差异(图4),说明葡萄酒的挥发性碳同位素成分具有产地差别,能用于产地溯源分析。
葡萄酒中的挥发性组分均来自于葡萄果酱和糖酵解过程[16]。不同产地的酿酒葡萄由于种类和生长环境的不同引起葡萄酒中有机组分的碳同位素差异[17]。以往的研究均关注于葡萄酒中的乙醇和丙三醇的碳同位素的分析[11,14,17],主要由于乙醇和丙三醇为主要的糖酵解产物,能代表产地葡萄的碳同位素。然而,由于不同产地的酿造风格差异可能引起其它微量挥发性组分的差异,因此理论上可以利用多种挥发性组分的碳同位素指纹对葡萄酒的产地进行溯源。美国、澳大利亚和中国同属于新世界葡萄酒产区,其葡萄酒酿造方法与法国等欧洲旧世界葡萄酒产区具有较大差别,为了迎合消费者口味,新世界葡萄酒酿造方法也形成了独特的风格[18]。利用5种挥发性组分的碳同位素比值结合判别分析对4个国家的葡萄酒进行分类(图5)。结果表明,各国葡萄酒能明显分开,说明葡萄酒挥发性成分同位素能用于葡萄酒的产地溯源分析。
4 结 论
GCCIRMS能快速测定葡萄酒中挥发性组分的碳稳定同位素比值,测试结果可靠,准确率和精度均满足测定需求。对法国、美国、澳大利亚和中国4个国家葡萄酒的判别分析表明,本方法能对4个产区葡萄酒进行有效区分,预期将能应用于葡萄酒造假行为鉴别。
References
1 GAO PeiJun, CHENG JinSong, WANG ChengMing. SinoOverseas Grapevine & Wine, 2012, (5): 58-62
高培钧, 程劲松, 王承明. 中外葡萄与葡萄酒, 2012, (5): 58-62
2 Communities the Commission of the European. Determining Community Methods for the Analysis of Wines. Commission Regulation (EEC) No 2676/90 of 17 September 1990
3 lvarez M, Moreno I M, Jos , Camen A M, Gustavo Gonzlez A. Microchem. J., 2007, 87(1): 72-76
4 Rodrigues S M, Otero M, Alves A A, Coimbra J, Coimbra M A, Pereira E, Duarte A C. J. Food. Compos. Anal., 2011, 24(4): 548-562
5 LUO Mei, LIU GuoJie, LI DeMei, HUANG WeiDong, ZHAN JiCheng. Chinese J. Anal. Lab., 2009, 28(12): 35-38
罗 梅, 刘国杰, 李德美, 黄卫东, 战吉宬. 分析试验室, 2009, 28(12): 35-38
6 Pillonel L, Ampuero S, Tabacchi R, Bosset J. Eur. Food. Res. Technol., 2003, 216(2): 179-183
7 MA Lei, TANG Ke, HAN YeHui, LI JiMing, XU Yan. Sci. Technol. Food Industry, 2012, 33(19): 128-13
马 磊, 唐 柯, 韩业慧, 李记明, 徐 岩. 食品工业科技, 2012, 33(19): 128-133
8 QIN LiNa, NI YuanYing, LIANG FangHua, WANG Fang, LI JingMing. Liquormaking Science & Technology, 2008, 164(2): 40-44
秦丽娜, 倪元颖, 梁方华, 王 方, 李景明. 酿酒科技, 2008, 164(2): 40-44
9 Franke B M, Koslitz S, Micaux F, Piantini U, Maury V, Pfammatter E, Wunderli S, Gremaud G, Bosset J O, Hadorn R. Eur. Food. Res. Technol., 2008, 226(4): 761-769
10 Fronza G, Fuganti C, Grasselli P, Reiero F, Guillou C, Breas O, Sada E, Rossmann A, Hermann A. J. Agr. Food Chem., 1998, 46(2): 477-480
11 GimenezMiralles J E, Salazar D M, Solana I. J. Agr. Food Chem., 1999, 47(7): 2645-2652
12 Krummen M, Hilkert A W, Juchelka D, Duhr A, Schluter H J, Pesch R. Rapid Commun. Mass Spectro., 2004, 18(19): 2260-2266
13 Detemination by Isotope Ratio Mass Spectometry13C/12C of Wine Enthanol or that Obtained Through the Fermentation of Musts, Concentrated Musts or Grape Sugar. International Office of Vine and Wine. Resolution Oeno 17/2001
14 Cabaero A I, Recio J L, Rupérez M. Rapid Commun. Mass Spectro., 2008, 22(20): 3111-3118
15 International Organization of Vine and Wine (OIV). Resolution OENO 3432010
16 WANG ShuSheng, LI WangYuan. Wine Chemistry. Beijing: Science Press, 2005: 26-27
王树声, 李王袁. 葡萄酒化学. 北京: 科学出版社, 2005: 26-27
17 Guyon F, Gaillard L, Salagoity M H, Medina B. Anal. Bioanal. Chem., 2011, 401(5): 1551-1558
18 Johnson H, Robinson J. The World Atlas of Wine. London: Mitchell Beazley 2007: 15
Abstract A method was developed for analyzing the stable carbon isotope ratio of five volatile components (Ethanol, Glycerol, Acetic acid, Ethyl lactate, 2methylbutanol) in wine using gas chromatographycombustionisotope ratio mass spectrometer (GCCIRMS). The sample injection volume was less than 0.5 μL, and the analytical time of each run was less than 14 min. The precision of this method was 0.08‰-0.25‰ for analyzing standards, while 0.09‰-0.36‰ for wine samples. Compared to element analysisisotope ratio mass spectrometry (EAIRMS) results, the deviations were lower than 0.5‰. Fiftyfour wine samples from France, Australia, America and China were considered. The δ13C of five volatile components were measured using GCCIRMS. Discriminant analysis (DA) was employed for analyzing the geographical origin traceability of selected wine. The result indicated that δ13C of volatile components could be used to distinguish the origin of wines. The method was shown to be effective in improving detection of the origin traceability of wine.
Keywords Geographical origin traceability; Isotope; Volatile component; Wine; Gas chromatography combustionisotope ratio mass spectrometry
(Received 30 August 2014; accepted 13 December 2014)
