Er:YAG激光联合根管冲洗剂对根尖外多细菌生物膜的杀菌作用研究
2015-04-20程小刚
杨 扬,程小刚,仇 珺,肖 敏,田 宇,余 擎
(军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院牙体牙髓病科,陕西西安710032)
Er:YAG激光联合根管冲洗剂对根尖外多细菌生物膜的杀菌作用研究
杨 扬,程小刚,仇 珺,肖 敏,田 宇,余 擎
(军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院牙体牙髓病科,陕西西安710032)
目的:观察Er:YAG激光与根管冲洗剂联合应用对根尖外多细菌生物膜的杀菌作用。方法:体外牛牙骨质片上构建根尖外多细菌(衣氏放线菌、血链球菌和粪肠球菌)生物膜并随机分为6组。分别按以下方法进行处理,A组:52.5 g/L次氯酸钠(NaClO)液+Er:YAG激光;B组:5 g/L NaClO液+Er:YAG激光;C组:20 g/L洗必泰(CHX)液+Er:YAG激光;D组:酸性水(SAEW)+Er:YAG激光;E组:生理盐水(阴性对照组);F组:52.5 g/L NaClO液(阳性对照组)。每组又分为3个亚组,分别处理30 s、1 min、3 min(n=6)。SEM观察处理后多细菌生物膜形态,实时荧光定量PCR检测各组间细菌数量变化。结果:各实验组的细菌数量在各时间点均显著低于阴性对照组(P<0.05)。其中A组杀菌效果最强,在30 s和3 min时与F组相比无统计学差异(P>0.05),1 min时杀菌效果优于F组(P<0.05)。B、D组在1、3 min时与F组相比无统计学差异(P>0.05),30 s杀菌效果较F组略差(P<0.05)。C组的杀菌效果在各时间点均弱于F组(P<0.05)。结论:Er:YAG激光与几种根管冲洗剂联合应用能杀灭根尖外微生物。
Er:YAG激光;多细菌微生物膜;根管冲洗剂;次氯酸钠;洗必泰;强酸性水
根管治疗是治疗根尖周炎的主要方法,然而仍有些牙齿即使经过完善的根管治疗仍然会反复发作,即所谓的顽固性根尖周炎。有研究认为造成顽固性根尖周炎的主要原因在于根尖外牙骨质表面形成了生物膜[1],临床上通常行根尖区手术去除这种根尖外生物膜。传统根尖手术的成功率能达到60%左右,随着手术方法的改进和牙科显微镜等设备的应用更将手术治愈率提高到90%[2]。但是这种手术切除根尖的方法必然会造成牙根缩短,对于有牙周病、牙齿固位力差及身体耐受力差的患者并不适合。
Er:YAG激光自应用于牙体组织开始[3],就因其热损伤小、能精确切割、减少出血、有抗菌能力等优点而被广泛使用。研究发现,Er:YAG激光对于根管内包括粪肠球菌在内的细菌都具有很好的杀灭作用[4-6]。尤其是当其与根管冲洗液联合应用时,激光激发冲洗液产生空气泡沫和脉冲压力波,进一步发挥激光和冲洗液的杀菌效果,能有效去除根尖和牙本质小管内的细菌[7-10]。同时Er:YAG还能减少细菌毒素在牙骨质中的扩散,抑制微生物膜的再生[11]。然而国内外对于Er:YAG激光联合根管冲洗剂在根尖外的应用研究还很少。因此,本实验拟在体外建立多细菌微生物膜,以Er:YAG激光联合多种根管冲洗液进行处理,观察细菌形态和数量的改变,为Er:YAG激光应用于根尖外生物膜发挥杀菌作用提供实验依据。
1 材料和方法
1.1 主要材料、试剂和仪器
粪肠球菌(ATCC 29212,美国);衣氏放线菌(ATCC 12103,美国);血链球菌(ATCC 10556,美国);BHI培养基(青岛海博生物技术有限公司);次氯酸钠(天津天力化学试剂有限公司);生理盐水(Kishida Chemical Co,日本);强酸电解质水(Super OxseedLabo;Amano Co,日本);洗必泰葡萄糖酸盐粉剂(第四军医大学口腔医院药剂科);24孔板(Corning,美国);厌氧工作站(Don whitley H85,英国);慢速切锯(BUEHLER,美国);Er:YAG激光仪(Fontona Lasers,斯洛文尼亚);紫外分光光度计(JENWAY Genova Nano,英国);水平电泳槽、制胶器、PAC-300型电泳仪(Bio-Rad Technology Co,美国);凝胶成像分析系统(Bio-Rad Co,美国);梯度PCR仪(Biomateral Incorporate,德国);扫描电镜(Hitachi S-4800,日本);实时荧光定量PCR仪(ABI 7500s,美国)。
1.2 体外根尖多细菌生物膜模型的构建
1.2.1 细菌悬液的制备
分别取标准菌株粪肠球菌、血链球菌和衣氏放线菌,常温复苏后接种于BHI固体培养基中,37℃厌氧工作站(920 mL/L N2、800 mL/L CO2)内培养。粪肠球菌和血链球菌培养12 h、衣氏放线菌培养24 h后,分别挑取单菌落转入BHI液体培养基中厌氧条件下培养。2 d后可见培养液内形成细菌悬液,然后用BHI培养液调节细菌浓度使其麦氏值为0.5,此时细菌浓度约为1×108CFU/mL。
1.2.2 牛牙骨质片的制备
首先用慢速切锯将牛牙牙根切开,然后将牙根表面的牙骨质切成大小为5 mm×5 mm的牙骨质片;切好的牛牙骨质片放入170 g/L EDTA液中浸泡10 min后转入52.5 g/L次氯酸钠(NaClO)液中浸泡30 min进行消毒,最后121℃高温高压灭菌15 min,置4℃冰箱备用。
1.2.3 多细菌生物膜模型的构建
将上述制备的牛牙骨质片依次放入24孔板中,牙骨质部位朝上并以消毒过的黏蜡将其固定于24孔板上;然后加入调节好浓度的衣氏放线菌菌悬液500μL,37℃厌氧培养2 d,再加入粪肠球菌和血链球菌菌悬液各500μL,摇晃混匀后,厌氧培养3 d,每隔1 d更换1次新鲜的BHI培养液。3 d后观察可见培养液变浑浊,表明牙骨质片表面已经形成膜样结构。
1.3 Er:YAG激光联合根管冲洗剂分组处理后杀菌效果的观察
1.3.1 实验分组和处理
将表面已形成生物膜的牙骨质片样本随机分为4个实验组和两个对照组。4个实验组分别为A组(52.5 g/L NaClO+Er:YAG)、B组(5 g/L NaClO+Er:YAG)、C组[(20 g/L洗必泰(CHX)+Er:YAG]和D组[酸性水(SAEW)+Er:YAG]、E组(生理盐水)和F组(52.5 g/L NaClO)。E、F组分别为阴性和阳性对照组。每组又分为3个亚组,即处理时间分别为30 s、1 min和3 min,每亚组6个样本。处理方法:将形成生物膜的牙骨质片随机放入洁净的24孔板中,以消毒好的黏蜡固定于板底,牙骨质片上的生物膜朝上,并根据分组进行编号。用仪器固定好Er:YAG激光的R02手柄,使其伸入到24孔板中。A、B、C、D组在含有牛牙骨质片的板孔中分别经各自不同处理液处理后,以Er:YAG激光分别照射30 s、1 min和3 min。E组(阴性对照组):将牛牙骨质片浸泡在1 mL生理盐水内分别处理30 s、1 min和3 min,不作激光照射。F组(阳性对照组):将牛牙骨质片分别浸泡在1 mL 52.5 g/L NaClO内处理30 s、1 min和3 min,不作激光照射。
1.3.2 SEM观察细菌的数目和形态
每组取3个样本,PBS缓冲液冲洗2遍以去除游离的细菌;然后转入40 g/L多聚甲醛溶液中固定12 h,取出后分别用300、500、700、800、900和1 000 mL/L的乙醇梯度脱水,其中1 000 mL/L无水乙醇脱水两次,其他浓度脱水1次,每次15 min;脱水后干燥、喷金,SEM观察并拍照,每例样本随意选取3个视野观察根尖外生物膜的情况以及细菌形态。
1.3.3 样本DNA的提取
取各组样本,每组3个,PBS缓冲液清洗两遍去除游离细菌后,用消毒刀片将各组处理后的残留细菌尽量全部刮下;刮下的细菌放入1.5 mL离心管中,加入1 mL PBS缓冲液振荡30 s,然后12 000 r/min离心1 min,收集细菌;利用细菌DNA试剂盒提取样本DNA后,-20℃冰箱冻存。
1.3.4 PCR引物设计
根据粪肠球菌的非保守序列应用引物设计软件primer premier 5.0设计粪肠球菌的特异性引物,以便对已知粪肠球菌浓度样本进行特异性扩增,用得到的Ct值与细菌浓度之间的关系绘制标准曲线,其引物序列为:
E16S 72f,5'-CGGAGTGCTTGCACTCAATTGG-3'E16S 210r,5'-CTCTTATGCCATGCGGCATAAAC-3'
同时根据粪肠球菌、血链球菌和衣氏放线菌的16srDNA基因序列的保守区域,设计3种细菌的通用PCR引物,对着3种细菌的同一段序列进行扩增获得Ct值,并与标准曲线对照,从而测定生物膜中的这3种细菌的总细菌数量。引物序列为:U16S 1020f,5'-TTAAACTCAAAGGAATTGACGG-3'U16S 1190r,5'-CTCACGRCACGAGCTGACGAC-3'1.3.5 标准曲线的建立
粪肠球菌标准株提取DNA,经普通PCR、琼脂糖凝胶电泳、切胶,回收后的DNA片段作为实时荧光定量PCR的标准品。用紫外分光光度计测量DNA浓度,调节DNA浓度,得到拷贝数分别为104、105、106、107、108、109/μL的DNA溶液各10μL,用于制作标准曲线。
1.3.6 实时荧光定量PCR反应
以各组提取的样本DNA以及所制成的梯度浓度标准品作为模板,采用经过优化后确定的最佳实时荧光定量PCR反应体系和条件进行扩增。实时荧光定量PCR总反应体系20μL,包括:正、反向引物各1μL(10μmol/L)、SYBR premix Ex TaqⅡ(2×)10μL、Rox Reference Dye(50×)0.4μL、DNA模板2.0μL以及去离子水6.0μL。实时荧光定量PCR的反应条件为:95℃30 s,1个循环;95℃5 s,60℃34 s,40个循环。梯度浓度标准品应用粪肠球菌的特异性引物,制做标准曲线,其他各组应用通用引物,根据最后的Ct值与标准曲线的关系,估算细菌数量的变化。
1.4 统计学分析
2 结果
2.1 SEM观察牛牙骨质片上细菌的数目和形态
扫描电镜下可见,A组细菌数量均较少,其中30 s时可见零星存活的细菌以及一些细菌残屑;1 min时细菌进一步减少;3 min时几乎未见细菌。B组细菌残存数量普遍比A组多,30 s时可见少量散在完整细菌;1 min时细菌发生皱缩,但数目变化不大;3 min时细菌数量进一步减少,且形态不完整。C组细菌残余量多,30 s时有大量残存细菌,且形态完整;1 min时细菌数量相对减少;3 min时部分细菌的细胞壁出现破裂。D组30 s时可见少量细菌残余,细菌形态完整;1min时细菌数量较30 s时减少。3min时细菌几乎消失,仅可见少量皱缩细菌。E组3min时可见杆状的衣氏放线菌,椭圆形的粪肠球菌以及排列成链状的血链球菌混合交错,镶嵌在细胞外基质中,在牛牙骨质表面形成膜样结构。F组处理3 min后几乎无残留细菌(图1)。

图1 各组牛牙骨质片上细菌数目和形态观察(SEM,×5 000)
2.2 实时荧光定量PCR检测各组样本的细菌数量
以标准品的log值为横轴,实时荧光定量PCR所得 Ct值为纵轴作图,得到标准曲线 Y=-1.478x+30.416,用以描述细菌数量与Ct值之间的关系(图2)。利用该标准曲线,根据各处理组所得Ct值,计算相应的DNA拷贝数(表1)。
根据表1可知,30s时,细菌DNA拷贝数除A组与F组之间无统计学差异(P>0.05)外,其他各组均明显高于F组而又低于E组(P<0.05)。其中B、C、D组之间无统计学差异(P>0.05)。
1min时,剩余细菌的DNA拷贝数A组最低,与其他几组相比均P<0.05;B、D、F组次之,3者之间无统计学差异(P>0.05);C组较以上4组高;E组细菌DNA拷贝数最高,与其他组相比均有统计学差异(P<0.05)。
3min时,A、B、D、F组细菌DNA拷贝数相比无统计学差异(P>0.05);C组较以上4组多;E组细菌数量最多,C组和E组相比有统计学差异(P<0.05)。
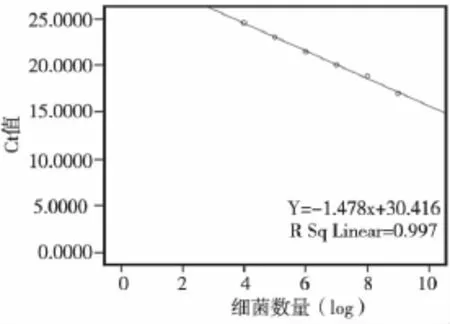
图2 标准曲线

表1 各组残余细菌DNA拷贝数
以上结果显示,各个处理组对于根尖外微生物膜均有一定的杀菌作用。其中A组在30s和3min时与阳性对照组的效果相当,而在1min时效果优于阳性对照组。B组和D组虽然30s时杀菌效果略次于F组,但在1min与3min时效果可以达到F组水平。C组杀菌效果相对上述几组杀菌能力较弱,无法达到阳性对照组的杀菌效果,但与阴性对照组相比,仍具有一定的杀菌能力。
3 讨论
造成顽固性根尖周炎的因素有很多,例如根管治疗不彻底,根尖外感染,自体异物反应,以及形成囊肿等等,普遍认为其原因在于根尖外部形成了微生物膜[12-13]。粪肠球菌、衣氏放线菌以及血链球菌都是难治性顽固性根尖周炎中常被检出的细菌[14-16]。有研究认为,衣氏放线菌与根尖脓肿的形成密切相关[17],血链球菌可以导致根管的程序性感染[16],而粪肠球菌则含有脂磷壁酸、溶细胞素、肽聚糖等多种毒力因子[18],并且具有耐受恶劣条件、耐药等影响;这些细菌形成的生物膜具有很强的致病性并很难被去除。Er:YAG激光可以通过组织内的水分吸收激光能量,在含水组织内发生微爆破。根尖外微生物膜内的水分含量远高于牙体硬组织,因此可以使用极低的能量去除微生物,而不破坏牙骨质[19]。当其与根管冲洗剂联合应用时,激光振荡液体介质冲击波可以在固体表面产生剪切力,导致表面形变以去除表面物质,从而进一步提高对微生物膜的杀菌作用[7]。同时,Er:YAG激光还可以促进根管冲洗剂中有效成分的裂解以增强杀菌效果。而几种液体介质也可以降低Er:YAG激光产生的热损伤,使非接触性照射的骨组织只有表面微层结构发生改变,使骨组织损伤减少,有利于骨组织恢复[20]。两者的联合应用可形成一种更有效且安全的消毒模式。
本实验中的实验组与阴性对照组相比均表现出杀菌效果。其中52.5g/LNaClO联合激光照射组的整体杀菌能力优于阳性对照组,1min时杀菌效果强于阳性对照组,30s和3min时则与阳性对照组效果相当。通常情况下,5g/LNaClO溶液需要30min以上处理才能抑制粪肠球菌的生长,52.5g/L的NaClO却仅需30s[21],本实验1min和3min时,5g/LNaClO+Er:YAG组与阳性对照组无统计学差异,表明低浓度NaClO与Er:YAG激光联合应用时可在短时间内就达到高浓度NaClO液的杀菌效果,且降低了NaClO液因浓度过高可能导致的细胞毒性,使得在口腔中的应用更加安全。CHX能够通过自身阳离子与细胞膜上的阴离子结合造成细菌溶解。本实验中C组与阴性对照组相比,起到了明显的杀菌作用,但效果较A、B组稍弱。这可能与其仅对细胞起作用,而不能去除坏死的组织有关。但与NaClO相比,CHX因较高的生物安全性,和对羟基磷灰石的亲和作用,使其可能有更广泛的应用[22]。SAEW是电解食盐形成的酸性水,具有快速杀菌、毒副作用小以及无污染等优点[23]。有研究表明,在根管处理中,SAEW与NaClO联合应用的冲洗效果与NaClO和150 g/L EDTA联合应用的效果相当[24],但Qing[25]则认为SAEW的杀菌作用不如30 g/L NaClO。本实验中,SAEW联合激光照射30 s时的杀菌能力较A、F组稍弱,但与E组相比具有明显杀菌作用;1、3 min时则可达到NaClO组水平,有效去除根尖外的生物膜。推测可能是由于与Er:YAG激光的联合应用促进了SAEW中自由基的产生,从而提高了杀菌效果。本结果表明,Er:YAG激光与根管冲洗剂联合应用均对体外根尖外多细菌生物膜具有有效的杀灭作用,为Er:YAG激光与根管冲洗液的联合应用去除根尖生物膜的临床应用提供了实验依据。
[1]Noiri Y,Ehara A,Kawahara T,et al.Participation of bacterial biofilms in refractory and chronic periapical periodontitis[J].J Endod,2002,28(10):679-683.
[2]Tsesis I,Rosen E,Schwartz-Arad D,et al.Retrospective evaluation of surgical endodontic treatment:traditional versusmodern technique[J].JEndod,2006,32(5):412-416.
[3]Hibst R,Keller U,Steiner R.Die Wirkung gepulster Er:YAG Laserstrahlung auf Zahngewebe[J].Laser Med Surg,1988,4:163-165(in German).
[4]Meire MA,Coenye T,Nelis HJ,et al.Evaluation of Nd:YAG and Er:YAG irradiation,antibacterial photodynamic therapy and sodium hypochlorite treatment on Enterococcus faecalis biofilms[J].Int Endod J,2012,45(5):482-491.
[5]Noiri Y,Katsumoto T,AzakamiH,etal.Effects of Er:YAG laser irradiation on biofilm-forming bacteria associated with endodontic pathogens in vitro[J].J Endod,2008,34(7):826-829.
[6]Cheng X,Guan S,Lu H,et al.Evaluation of the bactericidal effect of Nd:YAG,Er:YAG,Er,Cr:YSGG laser radiation,and antimicrobial photodynamic therapy(aPDT)in experimentally infected root canals[J].Lasers Surg Med,2012,44(10):824-831.
[7]Hmud R,Kahler WA,George R,et al.Cavitational effects in aqueous endodontic irrigants generated by near-infrared lasers[J].JEndod,2010,36(2):275-278.
[8]Neelakantan P,Cheng CQ,Mohanraj R,et al.Antibiofilm activity of three irrigation protocols activated by ultrasonic,diode laser or Er:YAG laser in vitro[J].Int Endod J,2014,doi:10.1111/iej.12354.
[9]Peeters HH,De Moor RJ.Measurementof pressure changes during laser-activated irrigant by an erbium,chromium:yttrium, scandium,gallium,garnet laser[J].Lasers Med Sci,2014,doi:10.1007/s10103-014-1605-5.
[10]Peeters HH,GutknechtN.Efficacy of laser-driven irrigation versus ultrasonic in removing an airlock from the apical third of a narrow root canal[J].Aust Endod J,2014,40(2):47-53.
[11]Ishikawa I,Aoki A,Takasaki AA.Potential applications of Erbium:YAG laser in periodontics[J].JPeriodontal Res,2004,39(4):275-285.
[12]Evans M,Davies JK,Sundqvist G,et al.Mechanisms involved in the resistance of Enterococcus faecalis to calcium hydroxide[J].Int Endod J,2002,35(3):221-228.
[13]Baumgartner JC,FalklerWA.Bacteria in the apical5mm of infected root canals[J].JEndod,1991,17(8):380-383.
[14]Dunavant TR,Regan JD,Glickman GN,et al.Comparative evaluation of endodontic irrigants against Enterococcus faecalis biofilms[J].JEndod,2006,32(6):527-531.
[15]Sunde PT,Olsen I,Debelian GI,etal.Microbiota of periapical lesions refractory to endodontic therapy[J].JEndod,2002,28(4):304-310.
[16]Siqueira JF Jr,Rocas IN,Souto R,etal.Actinomyces Species,Streptococci,and Enterococcus faecalis in Primary Root Canal Infections[J].JEndod,2002,28(3):168-172.
[17]Xia T,Baumgartner JC.Occurrence of Actinomyces in infections of endodontic origin[J].J Endod,2003,29(9):549-552.
[18]Baik JE,Ryu YH,Han JY,et al.Lipoteichoic acid partially contributes to the inflammatory responses to Enterococcus faecalis[J].JEndod,2008,34(8):975-982.
[19]Sasaki KM,Aoki A,Masuno H,et al.Compositional analysis of root cementum and dentin after Er:YAG laser irradiation compared with CO2 lased and intact roots using Fourier transformed infrared spectroscopy[J].J Periodontal Res,2002,37(1):50-59.
[20]Yoshino T,Aoki A,Oda S,etal.Long-term histologic analysis of bone tissue alteration and healing following Er:YAG laser irradiation compared to electrosurgery[J].JPeriodontol,2009,80(1):82-92.
[21]Gomes BP,Ferraz CC,Vianna ME,etal.In vitro antimicrobial activity of several concentrations of sodium hypochlorite and chlorhexidine gluconate in the elimination of Enterococcus faecalis[J].Int Endod J,2001,34(6):424-428.
[22]Varoni E,Tarce M,Lodi G,et al.Chlorhexidine(CHX)in dentistry:state of the art[J].Minerva Stomatol,2012,61:399-419.
[23]Tanaka N,Tanaka N,Fujisawa T,et al.The use of electroly zed solutions for the cleaning and disinfecting of dialyzers[J].Artif Organs,2000,24(12):921-928.
[24]Gulabivala K,Stock CJ,Lewsey JD,et al.Effectiveness of electrochemically activated water as an irrigant in an infected tooth model[J].Int Endod J,2004,37(9):624-631.
[25]Qing Y,Akita Y,Kawano S,et al.Cleaning efficacy and dentin micro-hardnessafter root canal irrigation with a strong acid electrolytic water[J].JEndod,2006,32(11):1102-1106.
Antibacterial effect of Er:YAG laser combined w ith root canal irrigants on apicalmultispecies biofilm
YANG Yang,CHENG Xiao-gang,QIU Jun,XIAO Min,TIAN Yu,YU Qing
(State Key Laboratory of Military Stomatology,Department of Operative Dentistry and Endodontics,School of Stomatology,〛The Fourth Military Medical University,Shaanxi Key Laboratory of Stomatology,Xi′an 710032,China)
AIM:To evaluate the bactericidaleffective of the Er:YAG laser combined with different irrigants on apicalmultispecies biofilm.METHODS:Actinomyces,Enterococcus faecalis and Streptococcus sanguiswere cocultured on bovine cementum slices to form multispecies biofilm.The specimens were divided into 6 groups randomly and were treated as the following:52.5 g/L sodium hypochlorite(NaClO)+Er:YAG laser(group A),5 g/L NaClO+Er:YAG laser(group B),20 g/L chlorhexidine(CHX)+Er:YAG laser(group C),strong acid electrolytic water(SAEW)+Er:YAG laser(group D),normal saline(group E,negative control),and 52.5 g/L NaClO(group F,positive control).Each group was divided into3 subgroups(n=6).In each subgroup,the specimenswere treated with differentmethods for30 s,1min and 3min respectively.Scanning electronmicroscope(SEM)was used to observe the morphology ofmultispecies biofilm after treatment.Real-time quantitative PCR was used to detect the bacterial number.RESULTS:The number of bacteria in every treatmentgroup was significantly less than that in the negative control group(P<0.05).Group A showed the same strong bactericidal effect as the positive control group in 30 s and 3 min(P>0.05)and stronger in 1 min(P<0.05).Group B and group D had similar effect on themultispecies biofilm to positive control group in 1 min and 3 min(P>0.05),but showed less effect in 30 s(P<0.05).The antibacterialeffect of group C is poorer compared with other groups exceptnegative group atall time points(P<0.05).CONCLUSION:Er:YAG combined with different root canal irrigants can remove the apicalmultispecies biofilm effectively.
Er:YAG laser;multispecies biofilm;root canal irrigants;sodium hypochlorite(NaClO);chlorhexidine(CHX);strong acid electrolytic water(SAEW)[Chinese Journal of Conservative Dentistry,2015,25(5):308]
R780.2
A
1005-2593(2015)05-0308-06
10.15956/j.cnki.chin.j.conserv.dent.2015.05.010
2014-12-12;
:2015-03-15
杨扬(1989-),女,汉族,山东泰安人。硕士生(导师:余擎)
余擎,E-mail:yuqing@fmmu.edu.cn
