扩大的血管周围间隙的磁共振表现
2015-04-19孙沄莫信曾琼莉汤小俐黄海彬
孙沄 莫信 曾琼莉 汤小俐 黄海彬
血管周围间隙(perivascular spaces,PVS)又名V-R间隙(Virchow-Robin Spaces,VRS)[1],也被称为血管周围的淋巴间隙,其生理意义是作为脑组织间液排出的一个主要通道。扩大的血管周围间隙(enlarged perivascular spaces,EPVS)指VRS直径>2 mm[2]。目前,EPVS尚未被广大临床神经科医生所重视。本文收集90例EPVS患者,综合分析其磁共振影像形态、大小、部位、边界、信号、占位效应等表现,期望加深临床医生对本病的认识,提高诊断率,以便进一步分析其临床意义。
1 资料与方法
1.1 一般资料 选取2014年1月-10月中南大学湘雅二医院及本院神经内科门诊及住院患者90例,磁共振影像提示EPVS,男55例,女35例;年龄47~89岁,平均(66.37±10.52)岁;合并高血压病76例,糖尿病32例,冠心病38例,脑血管病43例。90例患者均进行了MR平扫,其中16例进行了MR增强扫描,52例行弥散加权成像(diffusion weighted imaging,DWI)检查[3-4]。
1.2 诊断方法
1.2.1 EPVS诊断 EPVS在MRI上表现为边界清楚的圆形、卵圆形或线状、管状结构,与穿支血管走行一致,在T1WI、T2WI和FLAIR序列上与脑脊液信号相同(T1WI为低信号,T2WI为高信号,FLAIR序列为低信号),无对比剂增强效应和占位效应[5],并排除肿瘤及腔隙性梗死在内的其他病灶。EPVS直径一般 3 mm左右,本研究最大见15 mm。按照EPVS的部位和MRI信号特性可与多种病变鉴别。按照Maclullich方法将EPVS分为5分:0分为无EPVS;1分为≤ 10个 EPVS;2分为 11~20个 EPVS;3分为 21~40个EPVS;4分为≥41个 EPVS[6]。
1.2.2 头颅MRI检查 均采用飞利浦3.0T超导型磁共振扫描仪检查(8通道SENSE头线圈),轴位常规 T1WI、T2WI、FLAIR 扫描,T1WI(TR 450 ms,TE 15 ms),T2WI(TR/TE=4050/105 ms),FLAIR(TR 7000 ms,TE 120 ms,IR 2000 ms),FOV 190 mm×230 mm,矩阵240×320,层厚5.0 mm,层间距0.5 mm。扫描方位包括轴位、冠状位和矢状位,观察内容包括病灶信号、数量、位置、大小、形态、是否伴发其他病灶、病灶有无占位效应、周围有无水肿等。
1.2.3 评估方法 全部研究对象由2名受过专业培训的神经内科医师在24 h内对其进行评估[7]。由2位影像科医师共同阅片明确诊断,诊断存在分歧的病例予以剔除。
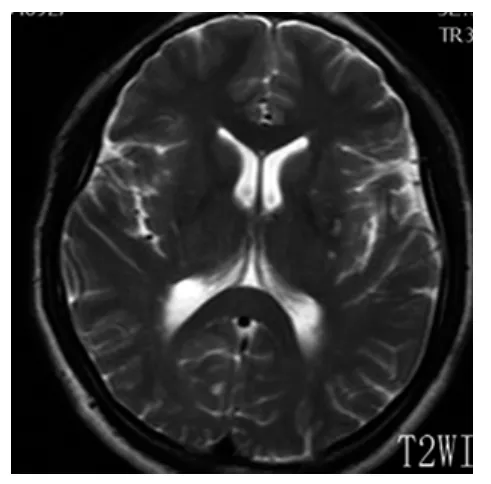
图2 基底节区T2WI所示EPVS
1.3 统计学处理 采用SPSS 22.0统计学软件进行数据分析,计量资料以(±s)表示,计数资料以例表示。
2 结果
2.1 一般结果 90例患者EPVS均为双侧多发,左右无明显差异,呈圆形、卵圆形或线状、管状,边界清楚,与穿支血管走行一致。在T1WI、T2WI和FLAIR序列上与脑脊液信号相同(T1WI为低信号,T2WI为高信号,FLAIR序列为低信号),无对比剂增强效应和占位效应。图1~8为典型部位EPVS图示。
2.2 各年龄组EPVS例数及部位分布 EPVS发生部位多见于基底节区、半卵圆中心及皮质下、桥脑、小脑、丘脑及脑室旁等,其中71~80岁年龄组EPVS数量明显高于其他年龄组别,见表1。
2.3 各年龄组与EPVS分级关系 EPVS数量随年龄年龄增长而增多,见表2。随访患者未发现明显变化。
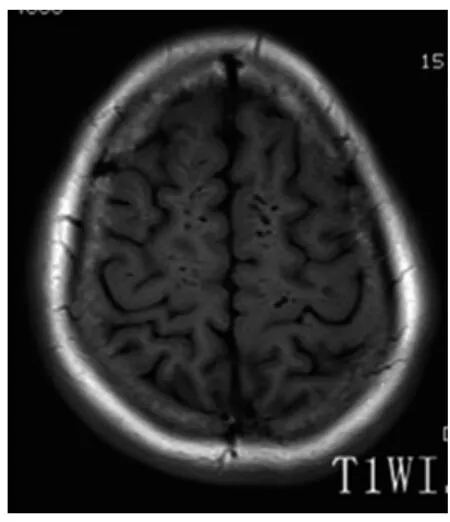
图4 半卵圆中心及皮质下T1WI所示EPVS
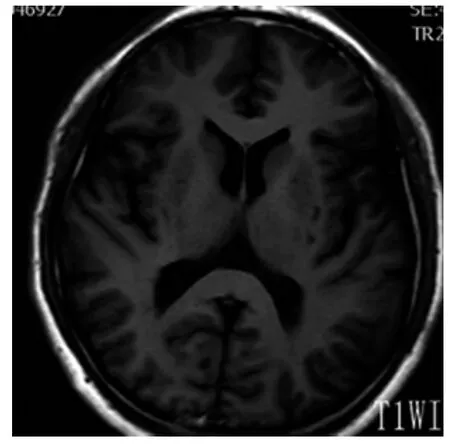
图1 基底节区T1WI所示EPVS

图3 基底节区T2Flari所示EPVS

图7 脑干T1WI所示EPVS

图6 半卵圆中心及皮质下T2Flair所示EPVS
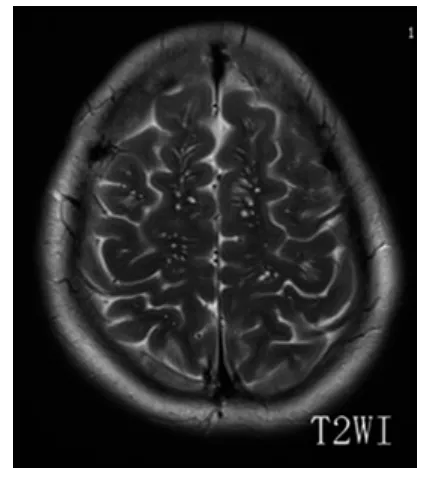
图5 半卵圆中心及皮质下T2WI所示EPVS

图8 脑干T2WI所示EPVS

表1 各年龄组EPVS例数及部位分布 个
3 讨论
血管周围间隙的概念已经提出了近200年,但其作用机制尚不明确,许多假设存在,如先天性异常、异常血管变性、感染、炎症、脱髓鞘等,均无法被认定或被否定。目前的理论仍认为,VRS与软脑膜下腔相连,是由软脑膜随穿通动脉和流出静脉进出脑实质延续而成。它是神经系统内的正常解剖结构,外界是神经胶质界膜,内界是血管外层,从而将血管与周围脑组织分隔开来,其内充满组织间液,而不是脑脊液,具有一定的生理和免疫调节功能。一般认为,直径<2 mm的VRS属正常解剖结构,见于各个年龄组的健康人。按照所在部位,VRS分为3种类型。基底节型:沿着豆纹动脉分布于基底节区周围(壳核外下部和外囊下部,常位于前连合两侧);大脑半球型:沿着髓质动脉分布,分布于皮层下白质(半卵圆中心、胼胝体和侧脑室附近);中脑型:随着来自大脑后动脉的穿通动脉进入中脑,分布于中脑、桥脑中脑连接处[8-9]。
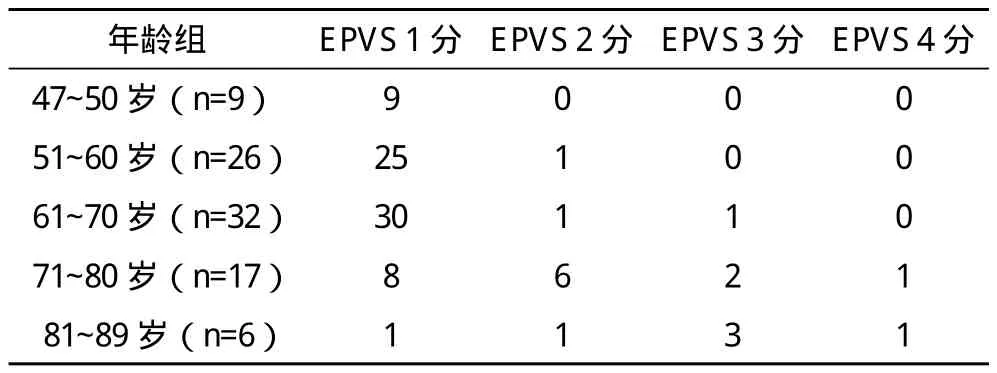
表2 各年龄组与EPVS分级关系 例
1843年Durant-Fardel[10]提出VRS扩大的理念,当时认为是囊性的扩张,中心包含一个固有的血管。由于EPVS极少造成脑实质损害,临床无直接症状表现,既往常被认为是良性或正常变异而被忽视,一直无法引起重视,直到近年磁共振技术突飞猛进的发展,EPVS的相关研究才再次被关注。尽管 EPVS 的发病机制目前尚不明确,但已有一些学者通过研究,发现基底节EPVS与年龄、高血压、无症状的腔隙性梗死灶及白质病变有关,认为它是小血管病病理学改变的另外一种表现形式[11]。有学者对97名65~70岁的健康男性进行了MRI研究,发现VRS扩大的数量增多与认知功能下降有关,特别是非文字推理和视觉空间能力,考虑是EPVS破坏了基底节区、半卵圆中心等部位中与认知功能相关的神经纤维所致[12]。上述国外研究所提,均指向EPVS与痴呆的关系,并积极推理其可能的发病机制:(1)动脉的节段性坏死性脉管炎[13];(2)不明原因的动脉壁通透性的改变[14];(3)脑脊液循环受阻;(4)脑萎缩和血管迂曲(老年脑);(5)VRS纤维化和闭塞及由此产生的流体流动阻力增加;等。多种假说均指向其与脑小血管病变、腔隙性脑梗死等有一定的联系[15]。因此,目前还不清楚EPVS是否是脑小血管病变的指标之一,还是仅代表对炎症、老年等血管或其他危险因素的反映。
而在MRI上EPVS常混淆于腔隙性脑梗死灶,两者均在MRI T1加权上呈低信号,T2加权上呈高信号,区别在于前者在FLARE序列上表达低信号,是与脑脊液信号一致的结构;后者则表达高信号,慢性期为低信号,周围可见薄边高信号影(胶质增生),DWI序列急性期呈高信号,随时间推移信号减低,变为等信号、低信号,MRI增强扫描周围见轻度环形强化或无强化[8]。
本研究90例患者,EPVS发生部位多见于基底节区、半卵圆中心及皮质下、桥脑、小脑、丘脑及脑室旁等。其中,71~80岁年龄组EPVS数量明显高于其他年龄组别。诊断较为明确。在正确认识EPVS的磁共振表现后,可以进一步探讨其与脑血管疾病、痴呆等的相关关系及发病机制,以期达到对脑血管疾病及痴呆的早期无创检查,早预防、早诊断、早治疗。
[1] Pearce J M S.Rudolf ludwig karl Virchow(1821-1902)[J].Neurol,2002,249(87):492-493.
[2] Mathias J,Koessler L,Brissart H,et al.Giant cystic widening of Vichow-Robin space:an anatomo functional study[J].AJNR,2007,28(8):1523-1525.
[3]张振勇.磁共振类PET成像技术的临床应用研究[J].中国医学创新,2012,9(7):89-90.
[4]苏国华,肖志季,王涛,等.磁共振DWI和1H-MRS在团块状脑梗死及脑肿瘤的鉴别诊断中的应用探索[J].中国医学创新,2012,9(23):89-90.
[5] Doubal F N,MacLullich A M,Ferguson K J,et al.Enlarged perivascular spaces on MRI are a feature of cerebral small vessel disease[J].Stroke,2010,41 (3):450-454.
[6] Maclullich A M,Wardlaw J M,Ferguson K J,et al.Enlarged perivascular spaces are associated with cognitive function in healthy elderly men[J].J Neurol Neurosurg Psychiatry,2004,75(11):1519-1523.
[7]石伟纲,薛文俊.53例青年脑梗死认知功能的研究[J].中国医学创新,2013,10(2):30-32.
[8]于丽波.多序列联合应用诊断超早期脑梗死的临床价值分析[J].中国医学创新,2013,10(12):15-16.
[9] Samuel G S,Chong W K,Surtees R,et al.Virchow-Robin spaces on magnetic resonance images:normative data,their dilatation,and a review of the literature[J].Neuroradiology,2006,48(2):745-754.
[10] Durand-Fardel M.Traite du ramollissement du cerveau[M].Paris:Balliere,1843.
[11] Rouhl R P,Van Oostenbrugge R J,Knottnerus I L,et al.Virchow-Robin spaces relate to cerebral small vessel disease severity[J].Neurol,2008,255(5):692-696.
[12] Doubal F N,MacLullich A M,Ferguson K J,et al.Enlarged perivascular spaces on MRI are a feature of cerebral small vessel disease[J].Stroke,2010,41(3):450-454.
[13] Kwee R M,Kwee T C.Virchow-Robin spaces at MR imaging[J].Radio Graphics,2007,27(8):1071-1086.
[14]陈继兴,钱加强.微血管周细胞在缺血性脑损伤中的作用[J].中国医学创新,2012,9(9):152-156.
[15]张九梅.缺血性脑卒中后痴呆危险因素分析[J].中国医学创新,2012,9(11):155-156.
