重楼活性单体PP-26抑制结肠癌SW 620细胞增殖并诱导细胞凋亡
2015-04-18陈家劲王娟娟王国才蒋建伟王跃春
陈家劲, 王娟娟, 张 鹏, 王 莉, 王国才, 蒋建伟, 王跃春
(1.暨南大学医学院生物化学系,广东广州510632;2.广州市番禺区中心医院检验科,广东广州511400;3.暨南大学药学院中药及天然产物研究所,广东广州510632;4.暨南大学医学院生理系,广东广州510632)
重楼活性单体PP-26抑制结肠癌SW 620细胞增殖并诱导细胞凋亡
陈家劲1, 王娟娟1, 张 鹏1, 王 莉2, 王国才3, 蒋建伟1, 王跃春4
(1.暨南大学医学院生物化学系,广东广州510632;2.广州市番禺区中心医院检验科,广东广州511400;3.暨南大学药学院中药及天然产物研究所,广东广州510632;4.暨南大学医学院生理系,广东广州510632)
目的:探讨重楼活性单体PP-26对人结肠癌SW620细胞增殖抑制作用及其机制.方法:采用噻唑蓝(MTT)法和克隆形成抑制实验观察不同浓度的重楼单体PP-26对人结肠癌SW620细胞增殖抑制作用;PI单染及AnnexinV-FITC/PI双染流式细胞术检测细胞周期变化及细胞凋亡水平;Western blotting检测PP-26对细胞周期、细胞凋亡相关蛋白以及Akt和ERK蛋白的表达.结果:与正常肝LO2细胞相比,重楼单体PP-26能显著抑制SW620细胞的生长,作用呈剂量-效应关系;随着PP-26浓度的增加,细胞克隆形成逐渐减少,与细胞对照组相比有显著差异;不同浓度PP-26作用后,细胞阻滞于G1期;PP-26作用细胞24 h后,CDK4、CDK6表达下降,P15、cyclin D1表达增加;不同浓度PP-26作用后,细胞晚期凋亡率增加,随浓度增加有上升趋势;PP-26作用细胞24 h后,线粒体相关凋亡信号通路蛋白Caspase-9、Caspase-3表达下降,PARP切割条带增加,细胞促凋亡蛋白Bax的表达增加,抗凋亡蛋白Bcl-2和Bcl-xL减少,p-Akt和p-ERK蛋白表达均下降.结论:重楼活性单体PP-26通过上调p15促进结肠癌SW620细胞阻滞于G1期,通过抑制P13K/Akt信号通路及ERK信号通路,活化线粒体凋亡通路,诱导细胞凋亡.
重楼; 结肠癌; SW620细胞; 凋亡
结肠癌(colorectal carcinoma)是中国常见恶性肿瘤之一,占胃肠道肿瘤的第3位.有调查显示,2010年全国28省市结肠直肠癌发病率达20.90/10万,病死率达10.05/10万[1].目前,结肠癌化疗常常使用5-FU、丝裂霉素和甲环亚硝脲,但是临床效果尚不满意[2].近年来植物类抗肿瘤药物逐渐引起人们的关注,有明确的抗肿瘤效果,还具有减少化疗的毒副反应,增强机体的抗病能力,减少术后复发转移等优点.
重楼(Rhizoma Paridis)又称七叶一枝花,为云南重楼Paris polyphylla Smith var.yunnanensis(Franch.)Hand和七叶一枝花Paris polyphylla Smith var.chinensis(Franch.)Hara的干燥根茎,具有清热解毒、消肿止痛、凉肝定惊的功效.现代药理研究显示重楼具有抗肿瘤、止血、抑菌和免疫调节等活性,其水提取物、醇提取物及其中的皂苷对多种肿瘤细胞具有增殖抑制作用[3-6].
本课题组李药兰教授前期采用噻唑蓝(3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-diphenytetrazoliumromide,MTT)法追踪重楼抗肿瘤有效成分,从重楼醇提取物中分离出51种活性单体,其中发现23种新化合物,并筛选出16种抗肿瘤效果优于化疗药物顺铂的候选单体,其中PP-26为具有代表性的新候选化合物.目前仅对鼻咽癌CNE2细胞采用MTT法初步筛选重楼单体的抗肿瘤活性[7-8],本研究探讨PP-26对人结肠癌SW620细胞的增殖抑制作用及机制,为PP-26的抗肿瘤应用及药物开发提供实验依据.
1 材料与方法
1.1 材料与试剂
人结肠癌SW620细胞、人正常肝LO2细胞由暨南大学医学院生物化学与分子生物教研室提供.重楼活性单体PP-26(C51H82O21)由暨南大学药学院李药兰教授提供;新生胎牛血清购自北京元亨圣马生物技术研究所;RPMI 1640干粉培养基购自GIBCO公司;胰蛋白酶、噻唑蓝(MTT)、二甲基亚砜(dimethylsulphoxide,DMSO)、膜连蛋白-异硫氢酸荧光素(AnnexinV-FITC)、碘化丙锭(propidium iodide,PI)购自于美国Sigma公司;结晶紫粉剂购自广州试剂厂;Caspase-3、Caspase-9、cleaved poly ADP-ribose polymerase(cleaved PARP)、Bax、Bcl-2、Bcl-xL、Akt、p-Akt、ERK、p-ERK、P15、CDK4、CDK6和cyclin D1一抗购自美国Cell Signaling Technology公司;电化学发光液(electrochemiluminescence,ECL)购于南京凯基生物科技发展有限公司.
1.2 实验方法
(1)细胞培养 结肠癌SW620细胞、人正常肝LO2细胞用含体积分数10%胎牛血清的RPMI1640培养基,置于37℃、体积分数5%CO2的细胞培养箱常规培养,每3天传代1次,镜下观察细胞贴壁达80%以上时,以质量分数0.25%胰酶消化传代.
(2)细胞增殖抑制实验 分别取对数生长期的结肠癌SW620细胞、人正常肝LO2细胞,用含体积分数10%胎牛血清RPMI1640培养液调整细胞密度至5.0×104/mL,接种至96孔细胞培养板,每孔100 μL.待细胞贴壁后分别加入不同浓度的重楼活性单体PP-26,每个药物浓度组设5个复孔,同时设细胞对照组和DMSO试剂对照组.培养48 h后加入质量浓度为5 mg/mL的MTT溶液20μL/孔,继续培养4 h,弃上清液,加入DMSO 150μL/孔,震荡至结晶溶解后,用酶联免疫检测仪以测量波长570 nm及参考波长600 nm测定各孔吸光度(ΔA)值,并计算各组抑制率以及IC50,抑制率(%)=(1-A实验组/A对照组)×100%.
(3)细胞克隆形成抑制实验 预先向12孔板加入含体积分数10%胎牛血清RPMI1640培养液1 mL/孔,取对数生长期的SW620细胞调整细胞密度至1.0×103/mL,接种到12孔板,每孔500μL.待细胞贴壁后加入不同浓度的重楼活性单体PP-26,每个药物浓度组设2个复孔,同时设细胞对照组.培养14 d后弃培养基,PBS洗涤,V甲醇∶V冰醋酸=3∶1固定液固定10 min,晾干.用结晶紫染液染色15 min,流水冲洗,数码相机拍照.
(4)流式细胞术检测细胞周期 取对数生长期SW620细胞,调整细胞密度至4.0×105/mL,接种于6孔板,总体积2mL.待细胞贴壁后加入不同浓度的PP-26,培养24 h后,消化收集细胞,600 r/min离心5min,弃上清.预冷PBS重悬细胞,离心洗涤3次,用体积分数为70%的乙醇4℃固定过夜.上机前用预冷的PBS洗涤,加入碘化丙啶(propidine iodide,PI)染色液内含RNA酶,终质量浓度500 g/L,避光染色30 min,300目尼龙网过滤后上流式细胞仪分析细胞DNA含量的变化,每个样本随机分析104个细胞.
(5)流式细胞术检测细胞凋亡 取对数生长期结肠癌SW620细胞,调整细胞度至4.0×105/mL,接种于6孔板,总体积2 mL.待细胞贴壁之后分别加入药物,浓度设置与上相同,培养24 h后,消化收集细胞,离心600 r/min,5 min,弃去上清.PBS重悬细胞,离心洗涤2次,以染色缓冲液重悬,分别加入10μL Annexin V-FITC和5μL PI,轻轻混匀,室温避光反应15 min.加入200μL染色缓冲液,流式细胞仪检测,分析早期凋亡细胞和晚期凋亡细胞的百分率,每个样本分析104个细胞.
(6)免疫印迹法检测凋亡相关蛋白表达的变化
取对数生长期SW620细胞,调整细胞至4.0× 105/mL,接种于6孔板,总体积2 mL.待细胞贴壁后加入不同浓度的PP-26,培养24 h后,收集悬浮及贴壁的细胞,细胞裂解液于冰上裂解30 min,在4℃ 12 000 r/min离心15 min,收集上清液.经Bradford法测定蛋白浓度后,以上样30μg为基准,计算出上样体积.往样品蛋白加入1倍SDS凝胶加样缓冲液,95℃加热5 min,电泳后将蛋白转印至PVDF膜上,质量分数5%脱脂奶粉封闭后,一抗孵育过夜,再以辣根过氧化物酶标记的二抗封闭液孵育2 h,ECL发光液孵育后,在凝胶成像系统中拍照.
1.3 统计学处理
采用SPSS 18.0软件进行统计学处理,计量资料以(均数±标准差)(±s)表示,数据分析采用“Independent Sample t test”,以P<0.05有统计学意义.
2 结果
2.1 重楼活性单体PP-26对人结肠癌SW 620细胞的增殖抑制作用
MTT比色法检测发现,对于人结肠癌SW620细胞,不同质量浓度的PP-26作用细胞48 h,均有增殖抑制作用.随药物浓度的增加,PP-26的抑制作用逐渐增强,与细胞对照组及DMSO对照组相比,具有统计学意义(P<0.05,图1).PP-26作用人结肠癌SW620细胞48 h的IC50浓度为(2.69±0.19)μmol/L.同时,PP-26对人正常肝LO2细胞的增殖抑制作用不明显.
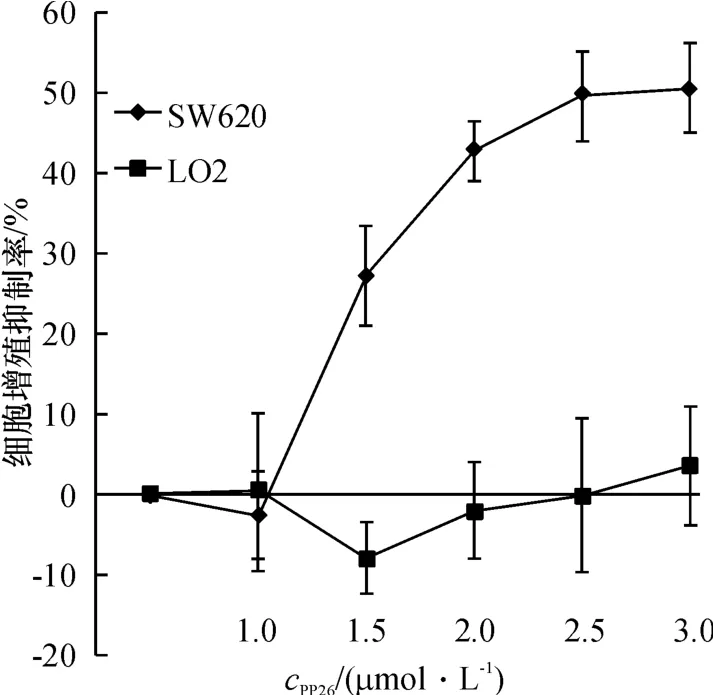
图1 不同浓度PP-26对人结肠癌SW620细胞与人正常肝LO2细胞的增殖抑制作用Fig.1 Proliferation inhibition of PP-26 on SW620 cells and LO2cells by MTT assay.SW620 cells and LO2 cells were incubated with different concentration of PP-26 for 48 h
2.2 重楼活性单体PP-26对结肠癌SW 620细胞克隆形成的影响
细胞克隆形成抑制实验结果显示,随着PP-26药物质量浓度的增加,12孔板的细胞克隆逐渐减少,与DMSO对照组相比,有明显差异(图2).当PP-26的药物浓度为1μmol/L时,产生明显的细胞克隆形成抑制作用,当药物浓度达1.25μmol/L时,几乎没有细胞克隆集落形成.

图2 不同浓度PP-26对人结肠癌SW620细胞克隆形成抑制作用Fig.2 Clone formation assay was used to evaluate the effects of PP-26 on the proliferation of SW620 cells
2.3 PI单染色检测结肠癌SW 620细胞周期改变
PI单染流式细胞仪检测显示,PP-26作用结肠癌SW620细胞24 h后,PP-26在浓度低于1.5 μmol/L时G1期细胞比例变化不大,但浓度高于1.5μmol/L后G1期细胞比例逐渐增加,S期细胞比例基本不变,G2/M期细胞比例逐渐减少(图3).

图3 不同浓度PP-26对SW620细胞细胞周期的影响Fig.3 Effect of PP-26 on induction of cell cylce in SW620 cells by Flow cytometry
2.4 Western blotting检测结肠癌SW 620细胞周期相关蛋白的表达水平
实验结果显示,重楼单体PP-26作用结肠癌SW620细胞24 h后,G1期相关蛋白CDK4、CDK6的表达水平随药物浓度增加而下降,cyclin D1、P15的表达水平逐渐增加(图4).
2.5 Annexin V-FITC/PI双染色检测结肠癌SW 620细胞凋亡率
对细胞进行不同浓度药物处理24 h后,利用Annexin V-FITC/PI双染色,经流式细胞仪检测,左下限(LL)为正常细胞群,右下限(LR)为早期凋亡细胞群,左上限(LU)为自噬性死亡和非特异性死亡细胞群,右上限(UR)为晚期凋亡细胞及坏死细胞群.实验结果显示,与DMSO对照组比较,随着PP-26的质量浓度增加,细胞早期凋亡率和晚期凋亡率逐渐增加(图5),浓度2.5μmol/L的PP-26作用细胞24 h,SW620细胞的凋亡率达35.95%.

图4 Western blotting检测细胞周期相关蛋白的表达变化Fig.4 The expression of cell cycle associated proteins were analyzed by Western blotting

图5 不同浓度PP-26对SW620细胞凋亡的影响Fig.5 Effect of PP-26 on induction of apoptosis in SW620 cells by Flow cytometry
2.6 Western blotting检测结肠癌SW 620细胞凋亡相关蛋白的表达水平
重楼活性单体PP-26作用结肠癌SW620细胞24 h后,蛋白免疫印迹法检测显示,与DMSO对照组相比,随PP-26的质量浓度增加,总Caspase-3和Caspase-9的表达逐渐下降,切割的PARP表达增加(图6),说明线粒体凋亡通路的活化.

图6 Western blotting检测细胞凋亡相关蛋白的表达变化Fig.6 The expression of apoptosis-associate proteins were analyzed by Western blotting
2.7 Western blotting检测结肠癌SW 620细胞Bcl-2家族蛋白的表达水平
重楼活性单体PP-26作用结肠癌SW620细胞24 h后,Western blotting检测显示,与DMSO对照组相比,随PP-26的质量浓度增加,抗凋亡蛋白Bcl-2、BclxL的表达逐渐下降,促凋亡蛋白Bax表达增加(图7).
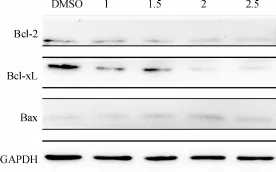
图7 Western blotting检测Bcl-2家族蛋白的表达变化Fig.7 The expression of Bcl-2 family proteins were analyzed by Western blotting
2.8 Western blotting检测结肠癌SW 620细胞Akt及ERK蛋白的表达水平
重楼活性单体PP-26作用结肠癌SW620细胞24 h后,Western blotting检测显示,与DMSO对照组相比,随PP-26的质量浓度增加,细胞凋亡相关的PI3K/Akt信号转导通路及ERK信号通路中,p-Akt表达减少,p-ERK表达减少(图8).
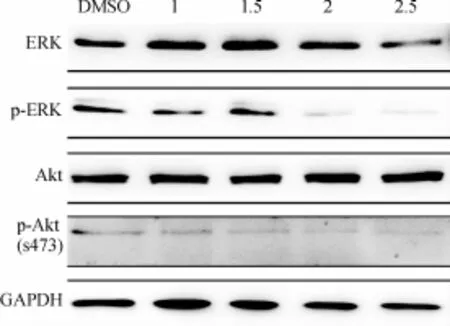
图8 Western blotting检测Akt、ERK蛋白的表达变化Fig.8 The expression of Akt and ERK were analyzed by Western blotting
3 讨论
近年来,植物类抗肿瘤药物越来越受到重视,已从香茶菜、水飞蓟、鹰嘴豆、黄花蒿,榄香烯等多种植物中分离提取出了有效的抗肿瘤成分,并研制新的植物类抗肿瘤药.重楼活性单体PP-26是本课题组从重楼醇提取物中分离的新单体,具有抗肿瘤活性[7-8].
重楼的主要有效成分是甾体皂苷,按苷元的不同主要有两类,一类为薯蓣皂苷元(diosgenin)的糖苷,另一类为偏诺皂苷元(pennogenin)的糖苷.本研究的重楼活性单体PP-26属于偏诺皂苷类化合物,全称为(3β,17α,25R)-spirost-5-ene-3,17-diol3-O-α-l-rhamnopyranosyl-(1→4)-α-l-rhamnopyranosyl-(1→4)-[α-l-rhamnopyranosyl-(1→2)]-β-d-glucopyr-anoside,化学式为C51H82O21(图9).本研究发现,PP-26具有抑制结肠癌SW620细胞生长的作用,具有剂量-效应关系,且对正常肝LO2细胞的抑制作用较小.
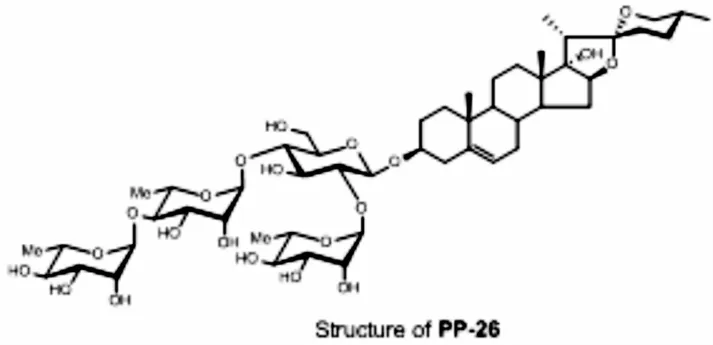
图9 PP-26化学结构Fig.9 The structure of PP-26
研究发现,重楼总皂甙能诱导细胞周期阻滞,保永亮等[9]研究发现重楼总皂苷使人胃癌MNK-45细胞增殖阻滞于G0/G1期,使人胃癌MGC-803细胞阻滞于S期.萧梅芳等[10]研究发现重楼皂苷I使人肝癌SMMC-7721细胞阻滞于G1期.本研究结果显示,重楼活性单体PP-26能使人结肠癌SW620细胞的细胞周期阻滞于G1期.研究表明,细胞周期蛋白(cyclins)、细胞周期蛋白依赖性蛋白激酶(cyclindependent kinases,CDKs)、细胞周期蛋白依赖性蛋白激酶抑制因子(cyclin-dependent kinase inhibitors,CKIs)调控细胞周期进展.CDK 4、CDK 6和CDK 2与cyclin D、cyclin E的复合体激活能直接促进G1/S转折,同时CKIs家族中的P15、P16、P18、P19可以特异性抑制CDK4或CDK6的活性[11].本研究显示,PP-26作用细胞24 h后,CKIs蛋白P15表达升高,G1期相关蛋白cyclin D1表达增加,G1期相关的细胞周期蛋白依赖性蛋白激酶CDK4、CDK6表达下降,说明PP-26通过上调P15的表达,抑制结肠癌SW620细胞于G1期,与流式细胞术结果相一致.
Caspase家族蛋白是一类半胱氨酸蛋白酶,在细胞凋亡过程中发挥关键作用.其中Caspase-3是细胞凋亡的执行蛋白,细胞受到凋亡信号刺激后,通过各种凋亡信号级联反应,最终活化Caspase-3,并引起其底物多聚(ADP-核糖)聚合酶(poly(ADP-ribose) polymerase,PARP)裂解,从而诱导细胞凋亡.线粒体凋亡通路与Caspase-9存在密切联系,在受到凋亡信号刺激情况下,线粒体上细胞色素C释放至胞浆中,与胞内的凋亡蛋白酶激活因子Apaf-1结合,同时在dATP作用下,募集并激活caspase-9,进而激活下游的凋亡执行因子Caspase-3诱导细胞凋亡[12].本研究结果显示重楼活性单体PP-26作用人结肠癌SW620细胞后存在Caspase-9和Caspase-3的活化,切割的PARP增加,说明PP-26通过线粒体凋亡途径诱导细胞凋亡.
Bcl-2家族蛋白在细胞凋亡过程中具有重要的调控作用,其包括抗凋亡蛋白(Bcl-2、Bcl-xL和Mcl-1等)、促凋亡蛋白(Bax、Bak等)以及BH3-only蛋白.Bcl-2是抑制细胞凋亡的蛋白,其通过调节线粒体钙离子的动态平衡和质子流方面发挥作用.Bax以单体的形式存在于细胞质中,当线粒体膜上的Bcl-2、Bcl-xL和Mcl-1减少时,Bax形成链式聚合物,镶嵌在线粒体膜上形成孔道,增加膜的通透性,使细胞色素C释放进入细胞质,从而激活Caspase-9并启动线粒体凋亡信号通路[13-14].本研究结果显示PP-26作用人结肠癌SW620细胞后Bcl-2和Bcl-xL出现表达下降,Bax表达增加,由此表明PP-26通过调控Bcl-2家族蛋白促进线粒体凋亡途径的活化.
PI3K/AKT途径属受体酪氨酸激酶信号转导通路,是细胞内重要的生存通路.研究证实,在肿瘤发生、发展的过程中,经常伴有PI3K/AKT信号通路的异常改变而导致AKT持续活化,而过度激活的AKT可进一步促使细胞的恶性转变,并且能够使肿瘤细胞对常规的放、化疗产生耐受性.激活的Akt可阻止Caspase-9和Caspase-3的活化而抑制细胞凋亡,还可抑制Bim及Bax的活性、通过抑制p53间接促进Bcl-2的表达等发挥抗凋亡作用[15].而且激活的Akt可磷酸化糖原合成酶(GSK-3)使之失活,从而防止cyclinD1被降解,促进细胞周期的进程.ERK信号转导途径是MAPK信号转导途径之一,在许多细胞过程中起作用,比如细胞增殖、分化、运动和死亡.ERK被激活后,能够使p90(RSK)被激活,引起Bad上的Ser112被磷酸化,引起Bad/Bcl-2或Bad/Bcl-xL异源性二聚体解聚,Bad结合14-3-3,释放Bcl-2或Bcl-xL,从而促进细胞的存活[16].本研究结果显示PP-26作用于结肠癌SW620细胞后p-Akt和p-ERK的表达下降,由此说明PP-26通过抑制PI3K/AKT信号通路及ERK信号通路引起线粒体凋亡途径诱导细胞凋亡.
综上所述,本研究证明重楼活性单体PP-26对结肠癌SW620细胞生长具有显著的抑制作用,其机制是上调P15的表达,促进细胞周期阻滞于G1期,通过抑制Akt通路、ERK通路,活化线粒体凋亡途径诱导细胞凋亡.但Akt的抑制、ERK的抑制与线粒体凋亡之间的关系、PP-26在整体水平如何抑制SW620细胞移植瘤的生长还有待进一步证明.
[1]CHENW,ZHENG R,ZHANG S,et al.Annual report on status of cancer in China,2010[J].Chin JCancer Res,2014,26(1):48-58.
[2]刘见荣,侯风刚.结肠癌治疗概况[J].辽宁中医药大学学报,2014,16(2):99-102.
[3]张兰天,左予桐,高文远,等.云南重楼提取物及化学成分的抗肿瘤活性研究[J].中草药杂志,2007,38(3):422-424.
[4]ZHANGW,ZHANG D,MA X,etal.Paris saponin VII suppressed the growth ofhuman cervical cancer Hela cells[J].Eur JMed Res,2014,19(1):41.
[5]MAN S,FANW,LIU,etal.Antitumor pathway of Rhizoma Paridis Saponins based on the metabolic regulatory network alterations in H22 hepatocarcinoma mice[J].Steroids,2014,84(6):17-21.
[6]XIAO X,ZOU J,BUI-NGUYEN TM,et al.Paris saponin IIof Rhizoma Paridis——a novel inducer of apoptosis in human ovarian cancer cells[J].Biosci Trends,2012,6(4):201-211.
[7]WU X,WANG L,WANGG C,etal.Triterpenoid saponins from rhizomes of Paris polyphylla var.yunnanensis[J].Carbohydrate Research,2013,368(7):1-7.
[8]WU X,WANG L,WANG H,et al.Steroidal Saponins from Paris polyphylla var Yunnanensis[J].Phytochemistry,2012,81(13):133-143.
[9]保永亮,龚晓燕,方海雁,等.重楼总皂苷对人胃癌MNK-45和MGC80-3细胞增殖的影响[J].安徽中医学院学报,2012,31(6):51-55.
[10]萧梅芳,戴霞红,贺新春,等.重楼皂苷I对肝癌细胞的增殖及凋亡的影响[J].生命科学研究,2011,15(6):519-523.
[11]MALUMBRESM,BARBACIDM.Cell cycle,CDKs and cancer:a changing paradigm[J].Nat Rev Cancer,2009,9(3):153-166.
[12]KUNAR S.Mechanisms mediating caspase activation in cell death[J].Cell Death Differ,1999,6(11):1060-1066.
[13]AUTRET A,MARTIN S J.Emerging role formembers of the Bcl-2 family in mitochondrial morphogenesis[J].Mol Cell,2009,36(3):355-363.
[14]ZHANG L,ZHANG S.Modulating Bcl-2 family proteins and caspase-3 in induction of apoptosis by paeoniflorin in human cervicalcancer cells[J].Phytother Res,2011,25(10):1551-1557.
[15]MOON D O,PARK SY,CHOIY H,et al.Melittin induces Bcl-2 and caspase-3dependent apoptosis through downregulation of Akt phosphorylation in human leukemic U937 cells[J].Toxicon,2008,51(1):112-112.
[16]BONNIA,BRUNET A,WEST A E,etal.Cell survival promoted by the Ras-MAPK signaling pathway by transcription-dependent and-independent mechanisms[J].Science,1999,286(5443):1358-1362.
[责任编辑:朱颖嫄]
A monomer purified from Paris Polyphylla,PP-26 inhibits cell growth and induces apoptosis of human colorectal cancer SW 620 cells
CHEN Jiajing1, WANG Juanjuan1, ZHANG Peng1, WANG Li2,WANG Guocai3, JIANG Jianwei1, WANG Yuechun4
(1.Department of Biochemistry,Medical College,Jinan University,Guangzhou 510632,China;2.Department of Laboratory,Guangzhou Panyu Central Hospital,Guangzhou 511400,China;3.Institute of Traditional Chinese Medicine and Nature Products,College of Pharmacy,Jinan University,Guangzhou 510630,China;4.Department of Physiology,Medical College,Jinan University,Guangzhou 510632,China)
Aim:To investigate the inhibitory effectand apoptotic effects of PP-26,amonomer purified from Paris Polyphylla,on human colorectal cancer SW620 cells.Methods:MTT assay and cell colony formation inhibitory assay were used to determine the inhibitory effects of PP-26 on human colorectal cancer SW620 cells.The percentage of apoptotic cells and cell cycle distribution were determined by flowcytometry.Expressions of cell cycle and apoptosis associated proteins were analyzed by Western blotting.Results:MTT assay showed that PP-26 inhibited colorectal cancer SW620 cells in a dose-dependent manner(P<0.05),but did not inhibit the growth of normal liver LO2 cells at the same concentration.Cell colony formation inhibitory assay demonstrated that cell colonies decreased with the increase of the drug concentrations.PI staining analysis showed that cell cycle was arrested at G1 phase.Western blotting analysis showed that the expressions of CDK4 and CDK6 were decreased,while the expressions of P15 and cyclin D1were increased.Annexin V-FITC/PI staining analysis showed that the percentage of apoptotic cells was increased in a dose-dependent manner after the treatment with PP-26 for 24 h.After the treatment of PP-26 for 24h,the expressions of Caspase-9,and Caspase-3 were downregulated,suggesting that the full length protein was cleaved,and the cleaved-PARP was upregulated,the Bcl-2 antiapoptotic members Bcl-2 and Bcl-xL were downregulated,and the pro-apoptotic protein Bax was upregulated,while phospho-Akt,and phospho-ERK were downregulated.Conclusion:PP-26 inhibits cell proliferation and induces cell cycle arrested at G1 phase via upregulation p15,and inducing apoptosis through down-regulation of Akt and ERK pathway,and activating the mitochondrial pathway in human colorectal cancer SW620 cells.
Paris Polyphylla; colorectal cancer; SW620 cells; Apoptosis
R966;R735.3+5
A
1000-9965(2015)02-0124-07
10.11778/j.jdxb.2015.02.006
2014-10-09
广东省科技计划项目(2011B031800012);广东省医学科学技术研究基金(A2014379);暨南大学第一临床医学院科研培育基金青年项目(2014203)
陈家劲(1988-),男,硕士,研究方向:劳动卫生与环境卫生学
王跃春,女,副教授,博士,硕士生导师,Tel:020-85220260;E-mail:monkeymei2@aliyun.com
