胡椒碱对脂多糖和金黄色葡萄球菌抑制人结肠腺癌细胞系表达防御素的拮抗作用
2015-04-18侯小凤徐丽慧何贤辉欧阳东云
侯小凤, 潘 浩, 徐丽慧, 何贤辉, 欧阳东云
(暨南大学生命科学技术学院1.免疫生物学系;2.细胞生物学系,广东广州510632)
胡椒碱对脂多糖和金黄色葡萄球菌抑制人结肠腺癌细胞系表达防御素的拮抗作用
侯小凤1, 潘 浩1, 徐丽慧2, 何贤辉1, 欧阳东云1
(暨南大学生命科学技术学院1.免疫生物学系;2.细胞生物学系,广东广州510632)
目的:研究胡椒碱(piperine,PIP)对脂多糖(LPS)和灭活金黄色葡萄球菌(SAC)菌体抑制人结肠腺癌HT-29和Caco-2细胞表达防御素(Defensin)的影响.方法:WST-1法检测PIP对HT-29和Caco-2细胞增殖的作用;定量PCR(qRT-PCR)检测人α防御素DEFA5(HD5)和DEFA6(HD6),人β防御素HBD-1以及胰岛再生源蛋白(Reg)Reg IIIγ等mRNA的表达水平.结果:PIP处理可剂量依赖性地抑制HT-29和Caco-2细胞的增殖,半数抑制浓度IC50分别为328.5μmol/L和155.1μmol/L,表明PIP对细胞的毒性较小;定量PCR检测显示,PIP处理对LPS或SAC下调HT-29和Caco-2细胞DEFA5和DEFA6 mRNA表达水平具有显著的拮抗作用,对DEFB1和Reg IIIγ mRNA的表达没有明显影响.结论:胡椒碱可能通过拮抗病原体诱导细胞表达防御素的抑制作用,进而发挥其抗肠炎作用.
胡椒碱; HT-29细胞; Caco-2细胞; LPS; SAC; 人防御素; 抗菌肽
胡椒不仅是日常用作促进消化和食欲的佐料,也是亚洲国家传统医学中长期使用的一味草药,用于治疗肠胃疾病和癫痫症等疾病[1-2].许多传统医学书籍中均记载有胡椒的药用价值,尤其是其对治疗肠胃功能紊乱如便秘、腹泻和消化不良的疗效,大多数传统止泻药配方中均含有一定比例的胡椒成分.现代药物化学揭示了胡椒碱(Piperine,PIP)是黑胡椒(Piper nigrum Linn)和长胡椒(Piper longum Linn)等胡椒属植物果实主要成分中的1种植物碱,具有广泛的生物活性,包括抗抑郁和抗癫痫作用[3-4]、减肥降血脂[5]以及促进药物吸收[6]等.此外,胡椒碱还具有抗炎作用,如关节炎[7-9]、急性胰腺炎[10]和内毒素引起的休克[11],抑制炎症细胞中的各种炎症因子的产生[12-13].尽管有研究证明胡椒碱对多种肠胃疾病具有疗效,如胃溃疡和腹泻,肠郁积等[14-15],但对于胡椒碱在肠炎方面的研究很少,其抗肠炎作用的机制也还不够清楚.金黄色葡萄球菌(Staphylococcus aureus cells,SAC)属于革兰氏阳性细菌,分布广泛,常见于皮肤表面及上呼吸道黏膜,机会感染时可引起各种化脓性炎症;金黄色葡萄球菌同时也是食品污染引起肠炎的常见病原菌之一,其产生的细菌毒素,可引起呕吐、高烧、腹泻、电解质紊乱等肠炎症状,如不及时治疗可导致脱水、休克和死亡,因此是一种危险的病原微生物.革兰氏阴性菌的脂多糖(lipopolysaccharide,LPS)或者革兰氏阳性菌的灭活SAC菌体刺激人结肠癌腺细胞(HT-29、SW480、Caco-2等)是常用的人体肠炎体外细胞模型[16].本研究利用LPS或SAC分别刺激HT-29和Caco-2细胞,体外模拟人肠道感染细菌发生炎症,检测胡椒碱对LPS和SAC作用下这些细胞表达防御素(human defensins,HD)和胰岛再生源蛋白(regenerating islet-derived protein,Reg)Reg IIIγ(广义上均属于抗菌肽)mRNA表达水平的影响,初步探索胡椒碱的抗肠炎作用机制.
1 材料与方法
1.1 材料
(1)药物 PIP(纯度99.2%)购自广东省食品药品检验所,溶于二甲基亚砜(dimethylsulfoxide,DMSO)后在-20℃保存备用.临用前以DMEM培养液稀释成不同浓度,其中DMSO的体积分数低于0.1%.
(2)主要试剂与仪器 SAC悬液购自Calbiochem/Merck公司(Darmstadt,Germany).LPS(Escherichi a coli0111:B4)和DMSO购自Sigma-Aldrich公司(St.Louis,MO,USA).DMEM培养基、胎牛血清、青霉素和链霉素、Trizol试剂等购自Gibco/Invitrogen公司(Carlsbad,CA,USA).WST-1试剂为Roche公司(Penzberg,Germany)产品.SYBR®Premix Ex TaqTMII(TliRNaseH Plus)kit购自宝生物工程(大连)有限公司.
1.2 方法
(1)细胞培养 人结肠腺癌HT-29和Caco-2细胞(购自中国科学院上海细胞库).其中HT-29细胞用含有体积分数为10%胎牛血清、100 U/mL的青霉素和质量浓度为100 mg/L链霉素的McCOY's 5A培养基;Caco-2细胞用含有体积分数为20%胎牛血清、100 U/mL的青霉素和质量浓度为100 mg/L链霉素的DMEM培养基分别进行培养,各置于37℃及体积分数为5%CO2的细胞培养箱,湿度饱和条件下培养,每2 d换液传代一次,取对数生长期的细胞用于实验,实验均重复3次.
(2)WST-1法检测细胞增殖 取对数生长期的HT-29和Caco-2细胞以每孔5×103的密度接种于96孔板内(每孔100μL),24 h后将培养液换成含有对照溶剂或含有倍比稀释浓度PIP的新鲜培养液,培养48 h.然后加入10μLWST-1继续培养,每30 min在酶标仪上测量吸光度A,测定波长450 nm,参考波长为630 nm[17].设置只含有培养基的空白组.增殖率=(实验组A450nm-空白组A450nm)/(对照组A450nm-空白组A450nm)×100,并通过GraphPad Prism 5.0软件绘制细胞增殖活性直方图和曲线图,算出IC50值.
(3)Real-time qRT-PCR HT-29细胞和Caco-2细胞分别以5×105/孔和1.8×105/孔的密度接种于6孔板,每孔含培养基2 mL.含药物组加入指定浓度的PIP,预处理1 h后分别加入LPS(质量浓度为0.1μg/mL)和/或SAC(质量浓度为75μg/mL)继续培养5 h.收集各组细胞,按照Trizol说明书提取总RNA,定量后按TaKaRa逆转录试剂盒说明书进行cDNA的合成.合成的cDNA用Bio-Rad Chromo4多色实时荧光定量PCR仪进行PCR扩增[18].基因表达的相对定量用2-△△CT法分析.为检测细胞内各种抗菌肽mRNA的表达水平,我们设计了一系列人抗菌肽(包括防御素)的RT-PCR扩增引物,部分基因扩增的上、下游引物见表1.
1.3 统计学方法
所得数据以均数±标准差表示,GraphPad Prism 5.0软件进行单因素方差分析,处理组与对照组间比较采用Newman-Keuls检验,P<0.05为差异有统计学意义.
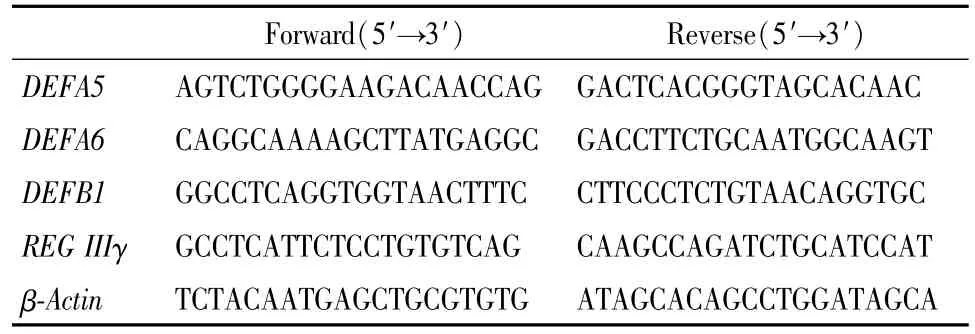
表1 Real-time qRT-PCR引物Table 1 Primer of Real-time qRT-PCR
2 结果
2.1 PIP对HT-29和Caco-2细胞增殖的影响
如图1所示,PIP作用于HT-29细胞48 h后,其细胞毒性较小,半数抑制浓度IC50>200μmol/L;作用于Caco-2细胞,高浓度PIP(>50μmol/L)显示出较大的细胞毒性,抑制细胞增殖,其IC50浓度为155.1μmol/L,而低浓度PIP(≤50μmol/L)对细胞没有明显毒性,本实验据此选择了毒性较小的PIP浓度进行后续研究.
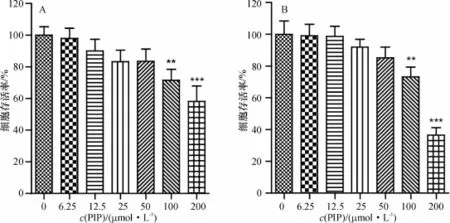
图1 PIP对HT-29(A)和Caco-2(B)细胞增殖的影响Fig.1 Effect of piperine on the proliferation of HT-29(A)and Caco-2(B)cells
2.2 PIP对LPS和/或SAC刺激的HT-29和Caco-2细胞表达人防御素和其他抗菌肽m RNA的影响
在以上实验基础上,选择PIP浓度为50μmol/L在mRNA水平上进一步研究胡椒碱对LPS和/或SAC刺激的HT-29和Caco-2细胞炎症反应的影响.利用Real-time qRT-PCR同时检测人α防御素DEFA5和DEFA6,β防御素DEFB1以及Reg IIIγ(REG IIIγ)mRNA的表达水平.结果显示,与对照组相比,单独PIP处理对DEFA5、DEFA6、DEFB1和Reg IIIγ的mRNA表达水平均没有显著影响.如图2所示,LPS和SAC刺激5 h使HT-29细胞的DEFA5和DEFA6的mRNA表达水平极显著下降(P<0.01或P<0.001),PIP预处理能使LPS刺激造成的下调明显回升(P<0.05)(PIP+LPS处理组vs LPS处理组),但对SAC造成的下调没有显著作用(PIP+SAC处理组vs SAC处理组).SAC刺激5 h使Caco-2细胞的DEFA5和DEFA6 mRNA表达水平极显著下降(P<0.01),而PIP预处理能使其显著回升(P<0.05)(PIP+SAC处理组vs SAC处理组);由于预实验中LPS未能有效激活Caco-2细胞产生炎症信号和炎症因子,因此本实验中未检测LPS刺激下Caco-2细胞各相关基因的表达水平.图3和图4显示LPS和SAC分别刺激HT-29细胞后,只能明显下调HT-29细胞Reg IIIγmRNA的表达水平(P<0.01),PIP预处理对此没有显著影响.此外,SAC刺激虽使Caco-2细胞DEFB1和Reg IIIγmRNA的表达水平有下降的趋势,但没有统计学差异,PIP预处理对上述两种抗菌肽的表达也没有明显影响.以上结果提示,LPS或SAC能分别抑制HT-29和Caco-2细胞中DEFA5、DEFA6的mRNA表达水平,而PIP预处理对LPS或SAC的这种抑制作用具有明显的拮抗效应.
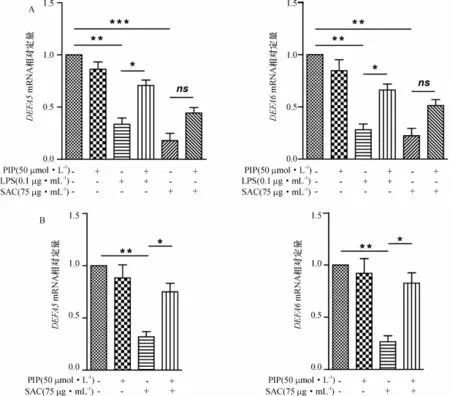
图2 PIP对SAC刺激的HT-29(A)和Caco-2(B)细胞HD5和HD6 mRNA表达水平的影响Fig.2 Effect of piperine(PIP)on DEFA5 and DEFA6 mRNA expression in HT-29(A)and Caco-2(B)cells upon Staphylococcus aureus cell(SAC)stimulation
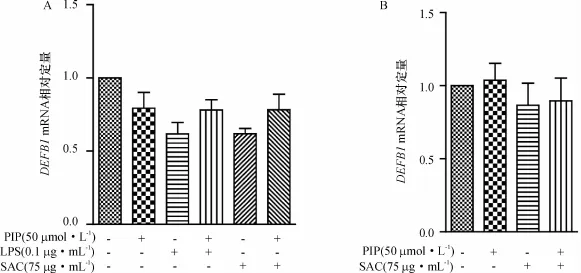
图3 PIP对SAC刺激的HT-29(A)和Caco-2(B)细胞HBD-1 mRNA表达水平的影响Fig.3 Effect of piperine(PIP)on DEFB1 mRNA expression in HT-29(A)and Caco-2(B)cells upon Staphylococcus aureus cell(SAC)stimulation

图4 PIP对SAC刺激的HT-29(A)和Caco-2(B)细胞Reg IIIγmRNA表达水平的影响Fig.4 Effect of piperine(PIP)on Reg IIIγmRNA expression in HT-29(A)and Caco-2(B)cells upon Staphylococcus aureus cell(SAC)stimulation
3 讨论
人防御素(human defensins)是一类内源性阳离子抗微生物肽,在固有免疫防御中起重要作用,也能增强适应性免疫应答,同时具有强烈的广谱抗微生物活性并且不易对微生物产生耐药性[19].迄今为止,相继发现了6种人α防御素HNP-1~4(human neutrophil peptide-1~4)、HD5~6(即DEFA5~6)和4种人β防御素HBD1~4(即DEFB1~4)[20].哺乳动物防御素表达有两种方式:组成性表达和诱导性表达,后者指在微生物入侵或引起发炎、感染的诱导剂存在下被诱导表达[21].其中,被看作肠内防御素的DEFA5和DEFA6主要是在小肠潘氏细胞(Paneth cell)中合成和表达分泌.据近来的研究报道推测DEFA5作为固有免疫效应分子可能在维持肠黏膜平衡中起重要作用[19].在使用LPS(来自革兰氏阴性细菌)和/或SAC(革兰氏阳性细菌)刺激HT-29和Caco-2细胞后,检测到DEFA5和DEFA6的mRNA表达水平均有显著下降,能侧面反映出肠道在感染细菌后免疫力有所下降;PIP处理本身对HT-29和Caco-2细胞内防御素mRNA的表达没有明显影响,但它对LPS或SAC引起的DEFA5和DEFA6 mRNA的抑制效应具有明显的拮抗作用,提示PIP可能通过拮抗细菌感染对肠道上皮表达抗菌肽的抑制作用,在一定程度上恢复肠道上皮分泌抗菌肽的能力,发挥其抗肠炎作用,增强肠道上皮的固有免疫功能.另外,防御素的表达具有组织特异性,DEFB1大量表达于肾,而Caco-2属于肠上皮细胞,这可能是用LPS和/或SAC刺激HT-29和Caco-2细胞后检测不到DEFB1 mRNA有显著变化的原因之一.PIP对SAC刺激HT-29和Caco-2细胞DEFA5和DEFA6的蛋白质表达水平上是否有相似的影响值得进一步研究.
本研究初步探讨了LPS和/或SAC刺激对人结肠腺癌细胞HT-29和Caco-2表达防御素的抑制作用以及胡椒碱对LPS或SAC抑制防御素基因表达的拮抗效应,结果显示胡椒碱能在mRNA水平上恢复这些细胞内被LPS或SAC刺激所抑制的HD5和HD6的表达,提示这可能是胡椒碱发挥其抗肠炎作用的机制之一,值得深入研究.
[1]MEHMOOD M H,GILANIA H.Pharmacological basisfor themedicinal use of black pepper and piperine in gastrointestinal disorders[J].Med Food,2010,13(5):1086-1096.
[2]裴印权,岳 微,崔景荣,等.胡椒碱衍化物的中枢药理作用研究[J].药学学报,1980,15(4):198-205.
[3]MAO Q Q,HUANG Z,IP S P,et al.Role of 5-HT(1A)and 5-HT(1B)receptors in the antidepressant-like effect of piperine in the forced swim test[J].Neurosci Lett,2001,504(2):181-184.
[4]MAO Q Q,HUANG Z,ZHONG X M,et al.Brain-derived neurotrophic factor signalling mediates the antidepressant-like effect of piperine in chronically stressed mice[J].Behav Brain Res,2014,261(2014):140-145.
[5]DUANGJAI A,INGKANINAN K,PRAPUTBUT S,et al.Black pepper and piperine reduce cholesterol uptake and enhance translocation of cholesterol transporter proteins[J].JNat Med,2013,67(2):303-310.
[6]REZAEE M M,KAZEMIS,KAZEMIM T,et al.The effect of piperine on midazolam plasma concentration in healthy volunteers,a research on the CYP3A-involving metabolism[J].Daru,2014,22(1):8.
[7]SABINA E P,NAGAR S,RASOOL M.A role of piperine on monosodium urate crystal-induced inflammation—an experimentalmodel of gouty arthritis[J].Inflammation,2011,34(3):184-192.
[8]BANG JS,OH DA H,CHOIH M,et al.Anti-inflammatory and antiarthritic effects of piperine in human interleukin 1beta-stimulated fibroblast-like synoviocytes and in rat arthritis models[J].Arthritis Res Ther,2009,11(2):R49.
[9]MURUNIKKARA V,PRAGASAM S J,KODANDARAMAN G,et al.Anti-inflammatory effect of piperine in adjuvant-induced arthritic rats——a biochemical approach[J].Inflammation,2012,35(4):1348-1356.
[10]BAE G S,KIM M S,JEONG J,et al.Piperine ameliorates the severity of cerulein-induced acute pancreatitis by inhibiting the activation ofmitogen activated protein kinases[J].Biochem Biophys Res Commun,2011,410(3):382-388.
[11]BAE G S,KIM M S,JUNGW S,et al.Inhibition of lipopolysaccharide-induced inflammatory responses by piperine[J].Eur JPharamacol,2010,642(1/3):154-162.
[12]CHUCHAWANKUL S,KHORANA N,POOVORAWAN Y,et al.Piperine inhibits cytokine production by human peripheral blood mononuclear cells[J].Genet Mol Res,2012,11(1):617-627.
[13]PRADEEPCR,KUTTAN G.Piperine is a potent inhibitor of nuclear factor-kappa B(NF-kappa B),c-Fos,CREB,ATF-2 and proinflammatory cytokine gene expression in B16F-10 melanoma cells[J].Int Immunopharmacol,2004,4(14):1795-1803.
[14]BAIY F,XU H.Protective action of piperine against experimental gastric ulcer[J].Acta Pharmacol Sin,2000,21(4):356-359.
[15]BAJAD S,BEDIK L,SINGLA A K,et al.Antidiarrhoeal activity of piperine inmice[J].Planta Med,2001,67(3):284-287.
[16]GADALETA R M,VAN ERPECUM KJ,OLDENBURQ B,et al.Farnesoid X receptor activation inhibits inflammation and preserves the intestinalbarrier in inflammatory bowel disease[J].Gut,2011,60(4):463-472.
[17]王 遥,刘坤鹏,宋方茗,等.雪胆素乙对小鼠淋巴细胞体外活化及增殖的影响[J].免疫学杂志,2013,29(3):190-194.
[18]闫小娟,查县丰,沈 琦,等.慢性粒细胞白血病患者FcεRⅠγ链基因表达上调[J].暨南大学学报:医学版,2011,32(4):379-382.
[19]高金湖,唐存多,邬敏辰.人防御素分子生物学研究进展及其应用[J].生物技术通报,2009,(12):30-36.
[20]彭力,徐志南,方向明,等.人防御素的研究进展[J].生物工程学报,2003,19(3):261-266.
[21]李洪军,胡宗利,魏泓.防御素(Defensin研究进展)[J].生物工程进展,2001,21(3):34-37.
[责任编辑:刘蔚绥]
Piperine counteracts the inhibitory effect of lipopolysaccharide and staphylococcus aureus cells on the expression of defensins by human colon carcinoma HT-29 and Caco-2 cells
HOU Xiaofeng1, PAN Hao1, XU Lihui2, HE Xianhui1, OUYANG Dongyun1
(1.Department of Immunobiology,2.Department of Cell Biology,College of Life Science and Technology,Jinan University,Guangzhou 510632,China)
Aim:To explore the effect of piperine on the down-regulation of human defensins caused by lipopolysaccharide(LPS)and Staphylococcus aureus cells(SAC)stimulation in HT-29 and Caco-2 cells.Methods:The effect of piperine on cell proliferation was measured by WST-1 assay.The mRNA levels of human defensins(DEFA5,DEFA6 and DEFB1)and regenerating islet-derived protein(Reg)were detected by quantitative real-time RT-PCR.Results:Piperine could inhibit the proliferation of HT-29 and Caco-2 cells in a dose-dependentmanner with their IC50values of 328.5μmol/L and 155.1 μmol/L,respectively,demonstrating that the cytotoxicity of piperine was relatively low.RT-PCR showedthat LPS and SAC greatly suppressed the expression of human defensins DEFA5 and DEFA6 in HT-29 cells and Caco-2 cells while piperine significantly counteracted the inhibitory effect of LPS and SAC on the expression of DEFA5 and DEFA6 mRNAs,instead of DEFB1 and Reg IIIγmRNA.Conclusion:Piperinemightexert its anti-colitis effect through antagonizing the inhibitory effect of LPSand SAC on the expression of defensins in human intestinal epithelial cells.
piperine; HT-29 cells; Caco-2 cells; lipopolysaccharide; Staphylococcus aureus;defensins; antibacterial peptide
R392.5
A
1000-9965(2015)02-0102-06
10.11778/j.jdxb.2015.02.002
2014-11-12
国家自然科学基金项目(81373423)
侯小凤(1989-),研究方向:分子细胞生物学
欧阳东云,男,副研究员,研究方向:炎症与抗炎免疫药理,Tel:020-85227730;E-mail:dongyun1967@aliyun.com
